Kroonilise neeruhaiguse ennetus ja käsitlus (ajakohastatud)
Siinne ravijuhend on 2017. aastal valminud ravijuhendi "Kroonilise neeruhaiguse ennetus ja käsitlus" ajakohastatud versioonRavijuhendi koostajad
Ravijuhendi töörühma liikmed
Ravijuhendi sekretariaadi liikmed
| Kadri Telling (juht) | Nefroloog, SA Tartu Ülikooli Kliinikum; Eesti Nefroloogide Selts |
| Merike Luman | Nefroloog, SA Põhja-Eesti Regionaalhaigla; Eesti Nefroloogide Selts |
| Mai Rosenberg | Nefroloog, SA Tartu Ülikooli Kliinikum; professor, Tartu Ülikool; Eesti Nefroloogide Selts |
| Evelin Seppet | Nefroloog, AS Lääne-Tallinna Keskhaigla; Eesti Nefroloogide Selts |
| Ruth Kalda | Peremeditsiini professor, Tartu Ülikool; perearst, Ränilinna perearstikeskus OÜ; Eesti Perearstide Selts |
| Galina Zemtsovskaja | Kliinilise keemia labori vanemarst, SA Põhja-Eesti Regionaalhaigla; Eesti Laborimeditsiini Ühing |
| Ly Anton | Kardioloog, SA Põhja-Eesti Regionaalhaigla sisehaiguste kliinik; kardioloog- vanemarst, kardioloogiakeskus |
| Mart Roosimaa | Endokrinoloog, SA Põhja-Eesti Regionaalhaigla; Eesti Endokrinoloogia Selts |
| Pille Soon | Pereõde; Rakvere Laste Tervisekeskus OÜ; Eesti Õdede Liit |
| Varje Mantsik | Õendusjuht, SA Põhja-Eesti Regionaalhaigla |
| Jaanika Alak | Patsientide esindaja |
| Liisi Leis (juht) | Nefroloog, SA Põhja-Eesti Regionaalhaigla, Eesti Nefroloogide Selts |
| Annika Adoberg | Nefroloog, SA Põhja-Eesti Regionaalhaigla, Eesti Nefroloogide Selts |
| Helen Kannela | Õde (nefroloogia), SA Tartu Ülikooli Kliinikum |
| Julia Piel | Nefroloog, SA Põhja-Eesti Regionaalhaigla, Eesti Nefroloogide Selts |
| Kadi Kallavus (metoodiline tugi) | Tartu Ülikool, ravijuhendite püsisekretariaat |
Lühendid ja mõisted
Lühendid
| A1–A3 | Kroonilise neeruhaiguse raskusaste vastavalt albumiini ja kreatiniini suhtele uriinis (vt lisa 2) |
| AGREE | Ravijuhendite hindamise tööriist, ingl appraisal of guidelines research and evaluation instrument |
| AKEI | Angiotensiini konverteeriva ensüümi inhibiitor |
| ARB | Angiotensiin I (AT1) retseptorite blokaator |
| CKD-EPI | Valem hinnangulise glomerulaarfiltratsiooni kiiruse arvutamiseks, ingl chronic kidney disease epidemiology collaboration equation |
| eGFR | Hinnanguline glomerulaarfiltratsiooni kiirus, ingl estimated glomerular filtration rate |
| G1–G5 | Kroonilise neeruhaiguse raskusaste vastavalt hinnangulise glomerulaarfiltratsiooni väärtusele (vt lisa 2) |
| GRADE | Soovituste määramise, hindamise ja koostamise liigitussüsteem, ingl grading of recommendations assessment, development and evaluation system |
| Hb | Hemoglobiin |
| HbA1c | Glükohemoglobiin |
| HDL-kolesterool | Suure tihedusega lipoproteiinides sisalduv kolesterool, ingl high density lipoprotein cholesterol |
| KA | Kontrastaine |
| KDIGO | Ülemaailmne mittetulundusühing, mis töötab välja ja rakendab tõenduspõhiseid neeruhaiguse ravijuhendeid, ingl Kidney Disease Improving Global Outcomes |
| KMI | Kehamassiindeks |
| KNH | Krooniline neeruhaigus |
| KVA | Kodade virvendusarütmia |
| LDL-kolesterool | Madala tihedusega lipoproteiinides sisalduv kolesterool, ingl low density lipoprotein cholesterol |
| LSNH | Lõppstaadiumi neeruhaigus, ingl end stage kidney disease (ESKD) |
| MDK | Multidistsiplinaarne käsitlus, ingl multidisciplinary care |
| MeSH | USA Meditsiini Rahvusraamatukogu meditsiiniliste ainevaldkondade märksõnad, ingl Medical Subject Headings, U.S. National Library of Medicine |
| MRA | Mineralokortikoidide retseptorite antagonist |
| MSPVA | Mittesteroidne põletikuvastane aine |
| NAR | Neeruasendusravi. Vt mõisteid |
| NICE | Ühendkuningriigi Riiklik Tervishoiu ja Kliinilise Kvaliteedi Instituut, ingl National Institute for Health and Care Excellence |
| OSAK | Otsese toimega suukaudsed antikoagulandid |
| PICO | Patsient-sihtrühm-sekkumine-võrdlus-tulemusnäitaja, ingl patient/population-intervention-comparison- outcome |
| PCSK9 inhibiitor | Subtilisiini- ja keksiinisarnase proproteiini konvertaasi 9 vastased antikehad |
| RAAS | Reniini-angiotensiini-aldosterooni süsteem |
| SGLT2 | Naatriumi-glükoosi kotransporter 2, ingl sodium- glucose co-transporter-2 |
| S,P-Crea | Kreatiniin seerumis/plasmas |
| SVH | Südame-veresoonkonnahaigused |
| U-Alb/U-Crea | Albumiini ja kreatiniini suhe uriinis |
| U-Prot/U-Crea | Valgu ja kreatiniini suhe uriinis |
| WHO | Maailma Terviseorganisatsioon, ingl World Health Organization |
Mõisted
| Alkoholitarvitamine väikese riski piirides | Alkohoolse joogi tarvitamine koguses, mille puhul on tervisekahju ja alkoholisõltuvuse tekke tõenäosus väike. Üks alkoholiannus võrdub alkohoolse joogi kogusega, mis sisaldab 10 g absoluutset alkoholi ehk ühe alkoholiühiku (joodud alkohoolse joogi kogus (liitrites) ´ joogi kangus (etanooli protsent) ´ 0,789). Päevaseks madala riski piiriks loetakse meestel 20 g puhast alkoholi (2 ühikut) ja naistel 10 g puhast alkoholi (1 ühik). (1) |
| Asümptomaatiline hüperurikeemia | Seerumi kusihappesisalduse suurenemine üle referentsväärtuse, mille korral ei esine viiteid kusihappekristallide ladestumisest põhjustatud haigustele (nt podagra, neerukivitõbi) |
| Diabeetiline nefropaatia | Neerude struktuurne ja funktsionaalne kahjustus, mis on tekkinud diabeedi hilistüsistusena. Kliiniline sündroom, mida iseloomustab albuminuuria, neeru- funktsiooni vähenemine, kõrge vererõhk |
| Krooniline neeruhaigus | Üle kolme kuu kestnud neerude struktuuri või funktsiooni hälve, mille korral esineb vähemalt üks järgmistest tunnustest: albuminuuria, haiguslik leid uriini sademes, tubulaarkahjustusest tingitud elektrolüütide häire, haiguslik morfoloogiline leid, kuvamisuuringutel ilmnenud struktuuri- muutus, neerusiirdamine anamneesis ja/või glome- rulaarfiltratsiooni kiiruse vähenemine alla 60 mL/ min/1,73 m2 (glomerulaarfiltratsiooni kiiruse astmed G3a–G5) (2) |
| Kroonilise neeruhaiguse konservatiivne ravi | Haiguspõhine ja patsiendi elukvaliteeti maksi- maalselt säilitav ravi, mis hõlmab üldjuhul medika- mentoosset ravi |
| Kulutõhusus | Analüüsimeetod, mida kasutatakse tervisetehno- loogia kulu ja saadavate naturaalühikutes väljen- datud tulemite (nt säästetud inimelu, vererõhu muutus) võrdlevaks hindamiseks agregeeritud suhtarvuna (nt ICER) |
| Metaboolne sündroom | Südame-veresoonkonnahaiguste ja 2. tüüpi diabeedi riskifaktoreid koondav ühtne diagnoos. Metaboolse sündroomi diagnoosimiseks peab olema täidetud vähemalt kolm alljärgnevatest kriteeriumitest:
|
| Multidistsiplinaarne käsitlus | Patsiendi käsitlusviis, mis ühendab erialaspetsialis- tide kompetentsi, teadmisi ja kogemusi ning mille eesmärk on tagada patsientide parem teadlikkus kroonilisest neeruhaigusest, selle progresseeru- misest ja ravivõimalustest. Käsitlusrühma moodus- tavate spetsialistide koosseis võib neerukeskustes erineda, kuid üldiselt kuuluvad rühma nefroloog, neeruõde, dieediõde või dietoloog, sotsiaaltöötaja, kirurg (dialüüsitee rajamiseks) ja füsioterapeut. Soovitatav on kaasata farmatseut/proviisor või kliiniline farmakoloog, vajaduse korral ka muude erialade spetsialistid (perearst, diabeediõde, endo- krinoloog, kardioloog, taastusarst jne) |
| Mõõduka intensiivsusega aeroobne treening | Füüsiline tegevus, mida soovitatakse teha vähemalt 5–7 korda nädalas 30–60 minuti jooksul. Mõõduka pingutusega aeroobne tegevus on näiteks kõndimine tempoga 4–6 km/h, puude kandmine ja ladumine, muud tempokalt tehtud aiatööd, rattasõit umbes 15 km/h, tantsimine, mittevõistluslikult sportmängude mängimine ja kergete raskuste tõstmine jõusaalis. Soovitatav pulsisagedus liikumise ajal on 60–75% maksimaalsest ealisest pulsist. Maksimaalse ealise pulsisageduse arvutamiseks lahutatakse arvust 220 vanus aastates. 60–70% maksimaalsest ealisest pulsist annab võimekust säilitava ja kehakaalu langetava efekti, 70–80% arendab südame tervist |
| Neeruasendusravi | Lõppstaadiumi neeruhaiguse korral rakendatav ravivorm jääkainete, vedelikubilansi ja metaboolsete nihete korrigeerimiseks. Neeruasendusravi vormid on hemodialüüs, peritoneaaldialüüs ja neeru- siirdamine |
| Neerukeskus | Tervishoiuasutus, millel on predialüüsi ja neeru- asendusravi planeerimise võimekus ja kroonilise neeruhaiguse multidistsiplinaarse käsitluse kogemus. Eestis on praegu kolm neerukeskust: Tartu Ülikooli Kliinikumis, Põhja-Eesti Regionaalhaiglas ja Lääne- Tallinna Keskhaiglas |
| Predialüüs | Kroonilise neeruhaigusega patsiendi (eGFR alla 30 mL/min/1,73 m2) neeruasendusraviks ettevalmis- tamine, mis sisaldab nõustamist eluviisi ja ravimite suhtes, neeruasendusravi meetodite tutvustust ning püsiva dialüüsitee loomist |
| Predialüüsi programm | Õppeprogramm, mille eesmärk on parandada patsiendi elu- ja ravikvaliteeti ning aeglustada kroonilise neeruhaiguse progresseerumist. Patsiendile antakse infot haiguse olemuse kohta, selgitatakse mittemedikamentoosse ja medikamentoosse ravi võimalusi haiguse progresseerumise aeglustamiseks ning tüsistuste raviks, tutvustatakse neeruasendusravi ja konservatiivse ravi võimalusi |
| RAAS-i antagonistid | Ravimid, mis toimivad reniini-angiotensiini- aldosterooni süsteemi pärssijatena. Selles ravi- juhendis mõeldakse nende all AKEI-sid ja ARB-e |
| Ravimiresistentne kõrgvererõhktõbi | Seisund, mille korral püsivad vähemalt kolme eri klassi kuuluva adekvaatses annuses antihüperten- siivse ravimi (sh diureetikum) samaaegsele kasutamisele vaatamata vererõhuväärtused ees- märkväärtustest kõrgemal või kõrgvererõhktõbi progresseerub kiiresti |
| Uriini ribaanalüüs | Analüüsimeetod, milles määratakse poolkvanti- tatiivselt testriba abil uriinist kindlad parameetrid. Eelistatud on esmane hommikune keskjoa uriin. Ribaanalüüsi kasutatakse sõeltestina neerude või kuseteede haiguse kahtlusel esmase uurimis- meetodina |
| Äge neerukahjustus | Igasugune kiirelt (vähem kui 48 tunni jooksul) tekkinud neerufunktsiooni vähenemine sõltumata kahjustuse põhjusest. Lihtsustatult on see olukord, kus hüpotensioon, hüpovoleemia või nefrotoksiline aine põhjustab neerude hüpoperfusiooni. Ägedat neerukahjustust saab diagnoosida, kui esineb vähemalt üks järgmistest tunnustest:
äge neerupuudulikus, mille puhul on vajalik neeruasendusravi. (3) |
Sissejuhatus
Ravijuhendi vajadus ja eesmärk
Krooniline neeruhaigus (KNH) esineb rahvastiku hulgas sagedasti ja on muutunud ülemaailmseks tervishoiuprobleemiks. Eri raskusastmega KNH levimus on
> 10% maailma rahvastikust, seega kannatab KNH käes praegu ligi 850 miljonit inimest (4). KNH on algstaadiumis oluliste kaebusteta kulgev haigus, mistõttu on see sageli aladiagnoositud ja -ravitud. Koos KNH-ga arenevad südame- veresoonkonnahaigused (SVH) ja KNH-ga patsientide kardiovaskulaarne suremus on üldrahvastikuga võrreldes suurem. Viimastel aastatel on KNH üks juhtivaid suremuse põhjuseid kogu maailmas (5). Seetõttu on väga oluline parandada teadmisi KNH õigeaegse diagnoosimise ja adekvaatse ravi kohta, milleks on vajalik mitme eriala spetsialistide koostöö. Eesmärk on avastada KNH varakult, aeglustada KNH progresseerumist, parandada neeruhaigete elukvaliteeti ja valmistada neid õigel ajal ette neeruasendusraviks.
Neeruasendusravi (NAR) on tervishoiusüsteemile suur rahaline koormus. Ainuüksi dialüüsravi moodustab maailmas umbes 5–7% tervishoiukuludest ja seoses patsientide arvu kasvamisega suureneb see näitaja järgnevatel aastatel (6). Eesti Nefroloogide Seltsi andmetel oli 2022. aasta seisuga Eestis neeruasendusravil (hemodialüüs, peritoneaaldialüüs, neerusiirdamine) ligi 1000 patsienti. Kuigi uute NAR-patsientide arv on viimastel aastatel stabiliseerunud (60–70 miljoni elaniku kohta aastas), on nende juurdekasvu tendents jätkunud. See on seletatav NAR-patsientide pikema elulemusega. (7)
KNH ravijuhendi kasutamise tulemusel paraneb KNH-ga patsientide käsitlus nii esmatasandi arstiabis kui ka erialaspetsialistide juures. Nii on võimalik vähendada patsientide kardiovaskulaarset suremust, parandada nende elukvaliteeti ja vähendada tervishoiukulusid.
> 10% maailma rahvastikust, seega kannatab KNH käes praegu ligi 850 miljonit inimest (4). KNH on algstaadiumis oluliste kaebusteta kulgev haigus, mistõttu on see sageli aladiagnoositud ja -ravitud. Koos KNH-ga arenevad südame- veresoonkonnahaigused (SVH) ja KNH-ga patsientide kardiovaskulaarne suremus on üldrahvastikuga võrreldes suurem. Viimastel aastatel on KNH üks juhtivaid suremuse põhjuseid kogu maailmas (5). Seetõttu on väga oluline parandada teadmisi KNH õigeaegse diagnoosimise ja adekvaatse ravi kohta, milleks on vajalik mitme eriala spetsialistide koostöö. Eesmärk on avastada KNH varakult, aeglustada KNH progresseerumist, parandada neeruhaigete elukvaliteeti ja valmistada neid õigel ajal ette neeruasendusraviks.
Neeruasendusravi (NAR) on tervishoiusüsteemile suur rahaline koormus. Ainuüksi dialüüsravi moodustab maailmas umbes 5–7% tervishoiukuludest ja seoses patsientide arvu kasvamisega suureneb see näitaja järgnevatel aastatel (6). Eesti Nefroloogide Seltsi andmetel oli 2022. aasta seisuga Eestis neeruasendusravil (hemodialüüs, peritoneaaldialüüs, neerusiirdamine) ligi 1000 patsienti. Kuigi uute NAR-patsientide arv on viimastel aastatel stabiliseerunud (60–70 miljoni elaniku kohta aastas), on nende juurdekasvu tendents jätkunud. See on seletatav NAR-patsientide pikema elulemusega. (7)
KNH ravijuhendi kasutamise tulemusel paraneb KNH-ga patsientide käsitlus nii esmatasandi arstiabis kui ka erialaspetsialistide juures. Nii on võimalik vähendada patsientide kardiovaskulaarset suremust, parandada nende elukvaliteeti ja vähendada tervishoiukulusid.
Ravijuhendi ajakohastamise vajadus
Ravijuhendi „Kroonilise neeruhaiguse ennetus ja käsitlus“ ajakohastamine algatati, sest algse juhendi ilmumisest 2017. aastal oli möödunud viis aastat. Lisaks toetab soovituste ajakohastamist uute teemakohaste teadusuuringute avaldamine ja uute ravimite kasutuselevõtt. Ravijuhendis on täiendatud KNH-ga patsiendi nõustamise ja erialaspetsialistile suunamisega seotud soovitusi ning lisatud soovitused kaugvastuvõtu rakendamiseks. Muudetud on soovitusi SVH riski hindamise ja vererõhuravi, diabeediravi eesmärkväärtuste, asümptomaatilise hüperurikeemia ja KNH aneemia käsitluse kohta. Uute teemadena on ravijuhendis
antikoagulantide, SGLT-2 inhibiitorite ja mittesteroidsete mineralokortikoidi antagonistide kasutamine KNH-ga patsientidel. Uuendatud ravijuhend aitab tagada kroonilise neeruhaigusega patsientide tõenduspõhise ja ajakohase käsitluse Eestis.
Ravijuhendi käsitlusala ja sihtrühm
Ravijuhend käsitleb täiskasvanute KNH diagnoosimist, ravi ja jälgimist vähemalt 18-aastastel KNH kahtluse või diagnoosiga patsientidel.
Ravijuhend on mõeldud kasutamiseks perearstidele ja teistele eriarstidele, samuti pereõdedele ja õenduspersonalile, kes tegelevad KNH-patsientidega.
Ravijuhend ei käsitle järgmisi teemasid:
Ravijuhend on mõeldud kasutamiseks perearstidele ja teistele eriarstidele, samuti pereõdedele ja õenduspersonalile, kes tegelevad KNH-patsientidega.
Ravijuhend ei käsitle järgmisi teemasid:
- KNH ravi lastel ja rasedatel;
- ägeda neerukahjustuse ravi;
- neeruasendusravi (hemodialüüs, peritoneaaldialüüs, neerusiirdamine);
- nefroloogi määratud spetsiifiline ravi;
- konkreetsete neeruhaiguste ravi (nt glomerulonefriit, harva esinevad neeru- haigused);
- erütropoeesi stimuleerivate ainete (ESA) kasutus.
Ravijuhendi soovitustes lähtutakse tõenduspõhiste uuringute ja kliinilise praktika tulemustest, kuid need ei asenda vajadust kohaldada igale patsiendile sobivat lähenemist tema seisundi põhjal. Ravijuhendis ei anta üksikasjalikku teavet konkreetsete ravimite kohta ja nende kasutamisel tuleb lähtuda ravimite omaduste kokkuvõtetest (www.ravimiamet.ee).
Ravijuhendi koostamine
Siinne ravijuhend on 2017. aastal valminud ravijuhendi „Kroonilise neeruhaiguse ennetus ja käsitlus“ ajakohastatud versioon.
Ravijuhendi ajakohastamiseks moodustati eri kutsealade esindajatest koosnev 11-liikmeline töörühm (koosseis on esitatud ravijuhendi alguses), kellest osa liikmeid kuulus ka algse juhendi töörühma. Metoodilist nõu andis Tartu Ülikooli ravijuhendite püsisekretariaadi metoodikanõunik. Ravijuhendite Nõukoda kinnitas ravijuhendi töörühma liikmete koosseisu 15. märtsil 2022 ja ravijuhendi käsitlusala
30. juunil 2022.
Ravijuhendi ajakohastamiseks vaatas töörühm läbi algse ravijuhendi koostamisel esitatud kliinilised küsimused ja neile vastamisel antud soovitused ning arutas uue tõendusmaterjali otsimise vajadust. Kui mõne kliinilise küsimuse kohta oli vahepealse viie aasta jooksul töörühma liikmete hinnangul suure tõenäosusega lisandunud uut tõenduspõhist infot, siis avati see küsimus uue tõendusmaterjali otsimiseks.
Kokku võttis töörühm arutelu alla algse juhendi neli kliinilist küsimust, esitas neli uut kliinilist küsimust ning lisas kolm tervishoiukorralduslikku küsimust. Kliiniliste ja tervishoiukorralduslike küsimuste kohta saate lugeda täpsemalt ravijuhendi käsitlusalast (www.ravijuhend.ee).
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2020) (8) põhimõtetest. Kliiniliste küsimuste arutamiseks ja soovituste sõnastamiseks, tervishoiukorralduslikele küsimustele vastamiseks ja juhendi muude materjalide (lisad, rakenduskava ja patsiendimaterjal) arutamiseks pidas töörühm kokku 11 koosolekut. Neist esimesel kahel pani töörühm paika, millised algse juhendi koostamise aluseks olnud kliinilised küsimused tuleb arutelu alla võtta, arvestades lisandunud uut tõendusmaterjali. Iga koosoleku alguses vaadati läbi töörühma ja sekretariaadi liikmete võimalike huvide konfliktide deklaratsioonid ja veenduti otsustajate kallutamatuses. Koosolek oli otsustusvõimeline, kui kohal oli vähemalt 3/4 töörühma liikmetest. Koosolekute otsused olid üksmeelsed.
Kui juhendi ajakohastamisel läbi töötatud teaduslik jm tõendusmaterjal ei andnud põhjust muuta algses ravijuhendis antud soovitust, ajakohastati vaid soovituse sõnastust. Kui ajakohastatud ravijuhendis muudeti uue teadusliku tõendusmaterjali põhjal või muudel kaalutlustel soovituse sisu, tehti soovituse juurde märge „[AJAKOHASTATUD 2023]“. Kui koostati täiesti uus soovitus, siis lisati soovitusele märge „[UUS 2023]“.
Kui juhendi soovitus ei olnud ravijuhendi koostamise ajal täielikult rakendatav, lisati soovituse juurde märge „[RAKENDUSPIIRANG]“. Rakenduspiirangu põhjus on kirjas vastava soovituse all olevas selgitavas tekstis.
Ravijuhendi käsitlusala, täistekst, tõendusmaterjali kokkuvõtte tabelid, soovituste koostamise tabelid, rakenduskava, ravijuhendi koostajate huvide deklaratsioo- nide kokkuvõte ja töörühma koosolekute protokollid leiab veebiaadressilt www.ravijuhend.ee.
Pärast ravijuhendi kinnitamist ajakohastatakse seda uue olulise info lisandumisel või viie aasta pärast.
Ravijuhendi ajakohastamiseks moodustati eri kutsealade esindajatest koosnev 11-liikmeline töörühm (koosseis on esitatud ravijuhendi alguses), kellest osa liikmeid kuulus ka algse juhendi töörühma. Metoodilist nõu andis Tartu Ülikooli ravijuhendite püsisekretariaadi metoodikanõunik. Ravijuhendite Nõukoda kinnitas ravijuhendi töörühma liikmete koosseisu 15. märtsil 2022 ja ravijuhendi käsitlusala
30. juunil 2022.
Ravijuhendi ajakohastamiseks vaatas töörühm läbi algse ravijuhendi koostamisel esitatud kliinilised küsimused ja neile vastamisel antud soovitused ning arutas uue tõendusmaterjali otsimise vajadust. Kui mõne kliinilise küsimuse kohta oli vahepealse viie aasta jooksul töörühma liikmete hinnangul suure tõenäosusega lisandunud uut tõenduspõhist infot, siis avati see küsimus uue tõendusmaterjali otsimiseks.
Kokku võttis töörühm arutelu alla algse juhendi neli kliinilist küsimust, esitas neli uut kliinilist küsimust ning lisas kolm tervishoiukorralduslikku küsimust. Kliiniliste ja tervishoiukorralduslike küsimuste kohta saate lugeda täpsemalt ravijuhendi käsitlusalast (www.ravijuhend.ee).
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2020) (8) põhimõtetest. Kliiniliste küsimuste arutamiseks ja soovituste sõnastamiseks, tervishoiukorralduslikele küsimustele vastamiseks ja juhendi muude materjalide (lisad, rakenduskava ja patsiendimaterjal) arutamiseks pidas töörühm kokku 11 koosolekut. Neist esimesel kahel pani töörühm paika, millised algse juhendi koostamise aluseks olnud kliinilised küsimused tuleb arutelu alla võtta, arvestades lisandunud uut tõendusmaterjali. Iga koosoleku alguses vaadati läbi töörühma ja sekretariaadi liikmete võimalike huvide konfliktide deklaratsioonid ja veenduti otsustajate kallutamatuses. Koosolek oli otsustusvõimeline, kui kohal oli vähemalt 3/4 töörühma liikmetest. Koosolekute otsused olid üksmeelsed.
Kui juhendi ajakohastamisel läbi töötatud teaduslik jm tõendusmaterjal ei andnud põhjust muuta algses ravijuhendis antud soovitust, ajakohastati vaid soovituse sõnastust. Kui ajakohastatud ravijuhendis muudeti uue teadusliku tõendusmaterjali põhjal või muudel kaalutlustel soovituse sisu, tehti soovituse juurde märge „[AJAKOHASTATUD 2023]“. Kui koostati täiesti uus soovitus, siis lisati soovitusele märge „[UUS 2023]“.
Kui juhendi soovitus ei olnud ravijuhendi koostamise ajal täielikult rakendatav, lisati soovituse juurde märge „[RAKENDUSPIIRANG]“. Rakenduspiirangu põhjus on kirjas vastava soovituse all olevas selgitavas tekstis.
Ravijuhendi käsitlusala, täistekst, tõendusmaterjali kokkuvõtte tabelid, soovituste koostamise tabelid, rakenduskava, ravijuhendi koostajate huvide deklaratsioo- nide kokkuvõte ja töörühma koosolekute protokollid leiab veebiaadressilt www.ravijuhend.ee.
Pärast ravijuhendi kinnitamist ajakohastatakse seda uue olulise info lisandumisel või viie aasta pärast.
Tõendusmaterjali sünteesimine ja soovituste koostamine
Ravijuhendi koostamiseks otsiti tõendusmaterjali „Eesti ravijuhendite koostamise käsiraamatu 2020“ (7) juhiste järgi. Esmalt otsiti KNH-d käsitlevaid tõenduspõhiseid ravijuhendeid. Leitud ravijuhendite kvaliteeti hinnati AGREE II struktureeritud instrumendiga. Igat ravijuhendit hindas teineteisest sõltumatult kaks sekretariaadi liiget, olulisi hinnangute lahknevusi ei esinenud.
Pärast AGREE II struktureeritud instrumendiga hindamist kaasati ravijuhendi töösse kolm ravijuhendit:
Pärast AGREE II struktureeritud instrumendiga hindamist kaasati ravijuhendi töösse kolm ravijuhendit:
- Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021;99(3S):S1–S87.
- Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2020;98(4S):S1–S115.
- Chronic kidney disease: assessment and management NICE guideline [NG203] 2021.
Lisaks kaasati teemaga seotud kardioloogia ravijuhend:
- Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-3104.
Töösse kaasatud ravijuhendites vaadati läbi koostatava juhendi käsitlusalaga haakuvad soovitused, nende aluseks olnud teaduslik tõendusmaterjal ning muud soovituse suunda ja tugevust mõjutanud tegurid. Tõendusmaterjali kokkuvõtte koostamiseks tehti lisaks süstemaatilised otsingud andmebaasis PubMed. Kaasati süstemaatilisi ülevaateid, metaanalüüse ja üksikuuringuid, eelistades jälgimisuuringutele juhuslikustatud kontrolluuringuid. Ravijuhendi koostamisel kasutatud teadusartiklid on juhendi tekstis viidatud.
Iga kliinilise küsimuse kohta koostas sekretariaat tõendusmaterjali kokkuvõtte tabeli ja valmistas ette soovituse koostamise tabeli, kasutades veebipõhist tarkvara GRADEpro. Peale huvipakkuva sekkumise kohta teadusuuringutest leitud kasu ja kahju ning tõendusmaterjali kvaliteedi kaalumist võttis töörühm kliinilise soovituse koostamisel arvesse ka patsientide eelistusi ja väärtushinnanguid, sekkumise vastuvõetavust kõigile sellega seotud osapooltele ja soovitusega kaasneda võivat patsientide ebavõrdsesse olukorda jätmist. Lisaks arvestati võimaluste ja ressurssidega (sh ravimite kättesaadavusega) soovitatava tegevuse rakendamiseks Eestis. Soovituste suuna ja tugevuse otsustas ning soovituse sõnastas töörühm üksmeelselt nii teadusliku tõendusmaterjali kui ka teiste eelnimetatud kriteeriumite põhjal. Kõik tabelid on kättesaadavad ravijuhendite veebilehel www.ravijuhend.ee.
Iga kliinilise küsimuse kohta koostas sekretariaat tõendusmaterjali kokkuvõtte tabeli ja valmistas ette soovituse koostamise tabeli, kasutades veebipõhist tarkvara GRADEpro. Peale huvipakkuva sekkumise kohta teadusuuringutest leitud kasu ja kahju ning tõendusmaterjali kvaliteedi kaalumist võttis töörühm kliinilise soovituse koostamisel arvesse ka patsientide eelistusi ja väärtushinnanguid, sekkumise vastuvõetavust kõigile sellega seotud osapooltele ja soovitusega kaasneda võivat patsientide ebavõrdsesse olukorda jätmist. Lisaks arvestati võimaluste ja ressurssidega (sh ravimite kättesaadavusega) soovitatava tegevuse rakendamiseks Eestis. Soovituste suuna ja tugevuse otsustas ning soovituse sõnastas töörühm üksmeelselt nii teadusliku tõendusmaterjali kui ka teiste eelnimetatud kriteeriumite põhjal. Kõik tabelid on kättesaadavad ravijuhendite veebilehel www.ravijuhend.ee.
Ravijuhendi soovitused
|
Kroonilise neeruhaiguse varajane avastamine
|
||
| 1 | |
Sõeluge kroonilise neeruhaiguse suhtes diabeedi, kõrgvere- rõhktõve ja teiste südame ja veresoonkonna haigustega ning potentsiaalselt neeru kahjustava süsteemse haigusega patsiente. |
| 2 |
|
Kroonilise neeruhaiguse suhtes on soovitatav sõeluda patsiente, kel on järgmised riskitegurid:
|
| 3 | |
Vanus ei ole kroonilise neeruhaiguse suhtes sõelumise näidustus. |
| 4 | |
Pärast ägeda neerukahjustuse episoodi jälgige patsiente kroonilise neeruhaiguse tekke osas kahe-kolme aasta jooksul. |
| 5 |
|
Diabeedi, kõrgvererõhktõve ja teiste südame ja veresoonkonna haiguste, potentsiaalselt neeru kahjustava süsteemse haigusega ning regulaarselt nefrotoksilisi ravimeid kasutavaid patsiente on soovitatav kroonilise neeruhaiguse suhtes sõeluda vähemalt üks kord aastas (vt lisa 1). |
| 6 |
Kroonilise neeruhaiguse suhtes on soovitatav sõeluda klii- nilise näidustuse põhjal iga kahe kuni viie aasta tagant meta- boolse sündroomi, struktuursete urotrakti haiguste, korduvate neerukivide, eesnäärme hüpertroofia ja neeruhaiguste pere kondliku anamneesiga patsiente (vt lisa 1). | |
| 7 |
|
Kroonilise neeruhaiguse suhtes sõelumiseks on soovitatav määrata patsiendil järgmised laboratoorsed uuringud: albumi- nuuria hindamiseks albumiini ja kreatiniini suhe uriinis, glo- merulaarfiltratsiooni hindamiseks kreatiniin seerumis/plasmas ning eGFR. |
|
Kroonilise neeruhaiguse diagnoosimine
|
||
| 8 |
|
Kroonilise neeruhaiguse kahtlusega patsiendile määrake diagnoosi kinnitamiseks laboratoorsed uuringud: kreatiniin seerumis/plasmas, eGFR ja albumiini ja kreatiniini suhe uriinis. Kordusuuringud tehke ühe nädala ja seejärel kolme kuu möödudes. |
| 9 |
|
Esmadiagnoositud kroonilise neeruhaigusega patsiendile tehke vajaduse korral ja uroloogilise haiguse kahtlusel lisaks kuseteede ultraheliuuring (k.a jääkuriini määramine), eesnäärme ultraheliuuring ning prostataspetsiifilise antigeeni analüüs. |
| 10 | |
Esmadiagnoositud kroonilise neeruhaigusega patsient, kelle kaebused viitavad günekoloogilisele haigusele, suunake güne- koloogi konsultatsioonile. |
| 11 |
|
Kroonilise neeruhaiguse riskirühma või kroonilise neeruhai- guse diagnoosiga patsiendil määrake proteinuuria täpsemaks hindamiseks albumiini ja kreatiniini suhe kvantitatiivselt (eelis- tatult esmasest hommikusest uriinist). |
| 12 |
|
Väljendunud albuminuuria korral (albumiini ja kreatiniini suhe uriinis üle 30 mg/mmol*, A3) eelistage proteinuuria korduvaks hindamiseks ja dünaamika jälgimiseks valgu ja kreatiniini suhte määramist uriinis. *mg/mmol = g/mol |
| 13 | |
Ärge kasutage proteinuuria suuruse määramiseks uriini riba- analüüsi. |
| 14 |
|
Kroonilise neeruhaiguse riskirühma või kroonilise neeruhaigu- sega patsiendil määrake glomerulaarfiltratsiooni täpsemaks hindamiseks lisaks seerumi/plasma kreatiniini määramisele ka eGFR, kasutades CKD-EPI valemit. [AJAKOHASTATUD 2023] |
|
Kroonilise neeruhaigusega patsientide nõustamine eluviisi teemal
|
||
| 15 |
|
Kroonilise neeruhaiguse riskirühma patsienti nõustage tervislike eluviiside järgimise asjus olenevalt riskiteguritest (füüsilise aktiivsuse suurendamine ja ülekaalu vähendamine, suitsetamisest loobumine, alkoholitarvitamise piiramine). |
| 16 |
|
Kroonilise neeruhaigusega patsiendile soovitage mõõduka intensiivsusega aeroobset treeningut võimaluse korral vähemalt 30 minutit järjest viis korda nädalas. Arvestama peab patsiendi füüsilist võimekust, kroonilise neeruhaiguse raskusastet ja kaas- nevaid haigusi. |
| 17 |
|
Kroonilise neeruhaigusega patsienti nõustage tervisliku toitumise teemal. [UUS 2023] Praktiline soovitus |
| 18 | |
Ülekaalulist kroonilise neeruhaigusega patsienti nõustage kaalu langetamiseks toitumise teemal, lähtudes haiguse raskusastmest Suitsetavaid patsiente nõustage suitsetamisest loobumiseks. |
| 19 |
|
Kroonilise neeruhaigusega patsiendi nõustamisel doku- menteerige füüsiline aktiivsus, kehakaal, kehamassiindeks, toitumissoovitused, suitsetamine, alkoholitarvitamine, tursete olemasolu, vedelikutarbimine. [UUS 2023] Praktiline soovitus |
| 20 | |
Kroonilise neeruhaigusega patsiendil soovitage hoida alko- holitarvitamist väikese riski piirides. |
|
Südame-veresoonkonnahaiguste riski hindamine kroonilise neeruhaigusega patsientidel
|
||
| 21 |
|
Kroonilise neeruhaigusega patsiendil, kelle eGFR on võrdne või kõrgem kui 60 mL/min/1,73 m2 (G1–G2), hinnake riski südame- veresoonkonnahaiguste tekkeks sarnaselt tavarahvastikuga. Kroonilise neeruhaigusega patsienti, kelle eGFR on 30–59 mL/ min/1,73 m2 (G3a–G3b), käsitlege südame-veresoonkonnahaiguste suure riskiga patsiendina. Kroonilise neeruhaigusega patsienti, kelle eGFR on alla 30 mL/ min/1,73 m2 (G4–G5), käsitlege südame-veresoonkonnahaiguste ülisuure riskiga patsiendina. |
|
Kroonilise neeruhaigusega patsientide jälgimine
|
||
| 22 |
|
Kroonilise neeruhaigusega patsiendil määrake kroonilise neeruhaiguse progresseerumise hindamiseks regulaarselt kreatiniini tase seerumis/plasmas koos eGFR-i hindamisega ning albumiini ja kreatiniini suhe uriinis. Hindamise sagedus sõltub kroonilise neeruhaiguse raskusastmest, progresseerumise kiirusest ja patsiendi kliinilisest seisundist (vt lisa 3). |
| 23 |
|
Kroonilise neeruhaigusega patsiendi ägeda haigestumise (nt infektsioon, müokardiinfarkt jt) korral või neeruhaiguse ägenemisel hinnake neerufunktsiooni (kreatiniin seerumis/ plasmas, eGFR) dünaamikas. |
| 24 |
|
Kroonilise neeruhaigusega patsiendil kiire ja ebaselge neeru- funktsiooni vähenemise korral (eGFR-i alanemine enam kui 15 mL/min/1,73 m2 aastas või võrreldes eelmise määramisega) on soovitatav korrata kreatiniini ja eGFR-i analüüsi kahe nädala jooksul, teha lisaks põhjuse täpsustamiseks ultraheliuuring ja konsulteerida vajaduse korral nefroloogiga. |
| 25 |
|
Kroonilise neeruhaigusega patsiendi regulaarseks jälgimiseks võite teha lisaks kontaktvastuvõtule kaugvastuvõttu. [UUS 2023] Praktiline soovitus |
| 26 |
|
Kroonilise neeruhaigusega patsiendi kaugvastuvõtul
[UUS 2023]
Praktiline soovitus |
| 27 |
|
Kroonilise neeruhaiguse patsiendil hoidke ravitulemuste paran- damiseks vererõhk alla 140/90 mm Hg. [AJAKOHASTATUD 2023] Tugev soovitus, mõõdukas tõendatuse aste. |
| 28 |
|
Kroonilise neeruhaigusega patsiendil kaaluge kardiovasku- laarsete sündmuste ja üldsuremuse vähendamiseks süstoolse vererõhu hoidmist alla 120 mm Hg. [AJAKOHASTATUD 2023] Nõrk soovitus, madal tõendatuse ast |
| 29 |
|
Kroonilise neeruhaiguse ja diabeediga patsiendil kindlustage kroonilise neeruhaiguse progresseerumise pidurdamiseks parim võimalik diabeedi kompensatsioon, hoides võimaluse korral glükohemoglobiini väärtust alla 53 mmol/mol ehk alla 7%. [AJAKOHASTATUD 2023] Nõrk soovitus, madal tõendatuse aste |
| 30 |
|
Kroonilise neeruhaiguse ja diabeediga patsiendil arvestage ravieesmärkide seadmisel hüpoglükeemia suurema tekkeriskiga. [UUS 2023] Praktiline soovitus |
| 31 |
|
Kroonilise neeruhaiguse ja 2. tüüpi diabeediga patsiendil järgige ravi eesmärkväärtuste määramisel 2. tüüpi diabeedi ravijuhendi soovitusi. [UUS 2023] Praktiline soovitus |
| 32 |
|
Kroonilise neeruhaigusega patsiendil hüperurikeemia käsitluses on vajalik puriinivaene dieet, eluviisi korrigeerimine, vajadusel diureetilise ravi vähendamine.[AJAKOHASTATUD 2023] Praktiline soovitus |
| 33 |
|
Kroonilise neeruhaigusega patsiendil kaaluge asümptomaatilise hüperurikeemia puhul ravi kusihappesisaldust alandavate ravimitega. [AJAKOHASTATUD 2023] Nõrk positiivne soovitus, madal tõendatuse aste |
| 34 |
|
Kroonilise neeruhaiguse tüsistuste õigeaegseks raviks on vajalik koostöö nefroloogiga. Tüsistuste teke sõltub kroonilise neeruhaiguse raskusastmest. Sagedasemad tüsistused on aneemia, kõrgenenud vererõhk, hüperkaleemia, hüperfosfateemia, hüpokaltseemia, sekundaarne hüperparatüreoos, metaboolne atsidoos, hüpoalbumineemia, kardiovaskulaarsed tüsistused. |
| 35 |
|
Kroonilise neeruhaigusega patsiendil määrake aneemia diagnoosimiseks hemoglobiini kontsentratsioon järgmise sagedusega:
[AJAKOHASTATUD 2023]
Praktiline soovitus |
36 |
|
Kroonilise neeruhaiguse ja aneemiaga patsiendil (sõltumata haiguse raskusastmest) täpsustage aneemia põhjus ning määrake seejuures ferritiinisisaldus ja transferriini küllastatus veres. [UUS 2023] Praktiline soovitus |
Krooniline neeruhaigus ja ravimid |
||
|
Kroonilise neeruhaiguse progressiooni aeglustavad ravimid
|
||
| 37 |
|
Kroonilise neeruhaigusega patsiendil, kel esineb väljendunud albuminuuria (albumiini ja kreatiniini suhe uriinis üle 30 mg/mmol, A3), kasutage vastunäidustuste puudumisel kroonilise neeruhaiguse progresseerumise aeglustamiseks reniini-angiotensiini-aldosterooni süsteemi (RAAS) antagoniste. |
| 38 |
|
Diabeetilise nefropaatiaga kroonilise neeruhaigusega patsiendil, kel esineb albuminuuria (albumiini ja kreatiniini suhe uriinis üle 3 mg/mmol, A2), kasutage sõltumata kõrgvererõhktõve olemasolust vastunäidustuste puudumisel kroonilise neeruhaiguse progresseerumise aeglustamiseks RAAS-i antagoniste. |
| 39 |
|
Kui kroonilise neeruhaigusega patsiendil alaneb pärast RAAS-i antagonistiga ravi alustamist eGFR rohkem kui 25% algväärtusest, on soovitatav välistada teised neerufunktsiooni vähenemise põhjused (hüpovoleemia, südamepuudulikkus, nefrotoksilised ravimid jt põhjused), vähendada RAAS-i antagonistide annust ja kontrollida kahe nädala jooksul uuesti neerufunktsiooni. |
| 40 |
|
Kui kroonilise neeruhaiguse korral alustatakse ravi RAAS-i antagonistidega ja/või mineralokortikoidretseptori antagonistidega, jälgige vere kaaliumisisaldust. Väljendunud hüperkaleemia tekkimisel (kaalium üle 6 mmol/L) lõpetage ajutiselt ravimi kasutamine, välistage teised hüperkaleemia põhjused ja konsulteerige nefroloogiga. [AJAKOHASTATUD 2023] |
| 41 | |
Hoiduge kroonilise neeruhaigusega patsientide puhul AKEI ja ARB-i kombinatsioonravist. |
| 42 |
|
Kroonilise neeruhaigusega patsiendil kasutage kroonilise neeruhaiguse progresseerumise aeglustamiseks SGLT-2 inhibiitorit. [UUS 2023] Tugev soovitus, kõrge tõendatuse aste |
| 43 |
|
Kroonilise neeruhaiguse ja 2. tüüpi diabeediga patsiendil kaaluge lisaks standardravile kroonilise neeruhaiguse progresseerumise aeglustamiseks mittesteroidsete mineralokortikoidide retseptorite antagonistide kasutamist. [UUS 2023] Tugev soovitus, kõrge tõendatuse aste |
|
Statiinid
|
||
| 44 |
|
Kroonilise neeruhaiguse ja düslipideemiaga patsiendil kasutage südame-veresoonkonnahaiguste primaarses ja sekundaarses ennetuses statiinravi. [AJAKOHASTATUD 2023] Tugev soovitus, mõõdukas tõendatuse aste |
| 45 |
|
Kroonilise neeruhaigusega patsiendil kasutage statiinravi koos esetimiibiga, kui statiinravi monoteraapiaga ei ole võimalik saavutada LDL-kolesterooli sihtväärtust. [UUS 2023] Tugev soovitus, mõõdukas tõendatuse aste |
|
Metformiin
|
||
| 46 |
|
Kroonilise neeruhaigusega patsiendi puhul arvestage metformiini kasutamisel ja annustamisel neerufunktsiooniga:
|
|
Antiagregandid
|
||
| 47 | |
Kui kasutate kroonilise neeruhaigusega patsiendil südame- veresoonkonnahaiguste primaarseks ennetuseks antiagregantravi, kaaluge võimaliku kardiovaskulaarse kasu ja veritsuse riski suhet. |
| Antikoagulandid | ||
| 48 |
|
Kroonilise neeruhaigusega patsiendile antikoagulantravi määra- misel eelistage patsiendi ohutust ja kasutusmugavust silmas pidades otsese toimega suukaudset antikoagulanti, kui ei ole kaasnevat haigust, mille puhul on näidustatud ainult varfariinravi. [UUS 2023] Nõrk soovitus, mõõdukas tõendatuse aste |
| Digoksiin | ||
| 49 |
|
Kroonilise neeruhaigusega patsiendi puhul arvestage digoksiini annustamisel neerufunktsiooni ja suurt individuaalset varieeru- vust seerumi terapeutilise kontsentratsiooni saavutamisel ning kõrvaltoimete tekkimisel. Ravimi manustamist alustage väiksemas annuses ja hoidke seerumi terapeutiline kontsentratsioon pigem madalal tasemel. |
|
Mittesteroidsed põletikuvastased ained
|
||
| 50 |
Kroonilise neeruhaigusega patsiendil, kes kasutab pikalt mitte- steroidseid põletikuvastaseid aineid, kontrollige neerufunktsiooni. Kontrollimise sagedus sõltub neeruhaiguse progresseerumise kiirusest. | |
| 51 | |
Kroonilise neeruhaigusega patsiendil vältige mittesteroidse põletikuvastase aine kasutamist, kui eGFR on alla 30 mL/min/ 1,73 m2 (G4–G5). |
|
Aminoglükosiidid
|
||
| 52 | |
Kui kasutate kroonilise neeruhaigusega patsiendil aminoglükosiide, annustage ravimit olenevalt seerumi kontsentratsioonist. |
|
D-vitamiin ja krooniline neeruhaigus
|
||
| 53 | |
Kroonilise neeruhaigusega patsiendil ei ole rutiinne D-vitamiini manustamine vajalik. |
| 54 | |
Kroonilise neeruhaigusega patsiendil on hüpovitaminoosi korral D-vitamiini manustamisel soovitatav lähtuda vitamiin D (25-OH) laboratoorselt määratud sisaldusest (sarnaselt üldrahvastikule). |
|
Radioloogilised uuringud kroonilise neeruhaigusega patsientidel
|
||
| 55 | |
Kroonilise neeruhaigusega patsiendil hinnake enne intra- vaskulaarse kontrastainega uuringu tegemist ägeda neeru- kahjustuse tekkimise riski. |
| 56 |
|
Kui kroonilise neeruhaigusega patsiendile, kelle eGFR on alla 60 mL/min/1,73 m2 (G3a–G5), on vaja teha intravaskulaarse kontrastainega uuring, siis
|
| 57 |
Vältige gadoliiniumi sisaldusega kontrastainet kroonilise neeruhaigusega patsientidel, kellel on neerukahjustuse tõttu suurenenud risk nefrogeense süsteemse fibroosi tekkeks (eGFR alla 30 mL/min/1,73 m2, G4–G5). | |
|
Patsiendi suunamine erialaspetsialisti vastuvõtule
|
||
| 58 |
|
Kroonilise neeruhaigusega patsient suunake nefroloogi konsultatsioonile, kui
|
| 59 |
|
Kroonilise neeruhaigusega patsient vajab nefroloogi konsul- tatsiooni, kui esmakordse neerukahjustuse avastamisel
Kuseteede obstruktsiooni välistamiseks tuleb enne konsul- tatsiooni teha kõhuõõne ja vaagna ultraheliuuring.
|
| 60 |
|
Kroonilise neeruhaigusega patsient suunake kuseteede kasvaja või uudismoodustise kahtluse korral uroloogi e-konsultatsioonile. [UUS 2023] Praktiline soovitus |
| 61 |
|
Kroonilise neeruhaigusega patsient suunake neerupealise kasvaja kahtlusel endokrinoloogi e-konsultatsioonile. [UUS 2023] Praktiline soovitus |
| 62 | |
Kroonilise neeruhaigusega patsiendi nõustamiseks on soovitatav kroonilise neeruhaiguse alase koolitusega õe konsultatsioon neerukeskuses. |
Kroonilise neeruhaigusega patsientide predialüüsi käsitlus |
||
| 63 | |
Kroonilise neeruhaigusega patsient, kelle eGFR on alla 30 mL/ min/1,73 m2 (G4–G5), kaasake neerukeskuse predialüüsi programmi. |
| 64 | Kroonilise neeruhaigusega patsiendil rakendage paremate ravitulemuste saavutamiseks predialüüsi käsitluses multi- distsiplinaarset lähenemist. | |
| 65 |
|
Kroonilise neeruhaigusega patsiendil hinnake lõppstaadiumi neeruhaiguse ravimeetodi (neeruasendusravi vs. konservatiivne ravi) valikul patsiendi seisundit, kaasnevaid haigusi ja arvestage tema soove. |
Ravijuhendi soovitused koos tõendusmaterjali lühikokkuvõtetega
Kroonilise neeruhaiguse varajane avastamine
| 1 |
|
Sõeluge kroonilise neeruhaiguse suhtes diabeedi, kõrgvere- rõhktõve ja teiste südame ja veresoonkonna haigustega ning potentsiaalselt neeru kahjustava süsteemse haigusega patsiente. |
| 2 |
|
Kroonilise neeruhaiguse suhtes on soovitatav sõeluda patsiente, kel on järgmised riskitegurid:
|
| 3 | |
Vanus ei ole kroonilise neeruhaiguse suhtes sõelumise näidustus. |
| 4 | |
Pärast ägeda neerukahjustuse episoodi jälgige patsiente krooni- lise neeruhaiguse tekke osas kahe-kolme aasta jooksul. |
Süstemaatiliste ülevaadete andmete põhjal ei ole üldrahvastiku sõelumine KNH suhtes kulutõhus. Väga kulutõhus on KNH suhtes sõeluda suure riskiga patsiente (diabeedi või kõrgvererõhktõvega patsiendid). (9–11)
Ühes süstemaatilises ülevaates leiti, et metaboolse sündroomiga patsientidel esineb neerufunktsiooni vähenemist oluliselt sagedamini (hinnanguline glomerulaarfiltratsiooni kiirus (eGFR) alla 60 mL/min/1,73 m2). Seos on seda tugevam, mida rohkem metaboolse sündroomi üksikkomponente patsiendil esineb (12). NICE-i kroonilise neeruhaiguse ravijuhendi raames koostatud süstemaatilises ülevaates rõhutatakse metaboolse sündroomiga patsientide sõelumise vajadust: uuringud üksnes suure kehamassiindeksi (KMI) ja KNH seostest on vastukäivad, kuid metaboolse sündroomi korral on tõestatud oluline lisarisk KNH tekkeks (9).
11 kohortuuringul põhineva süstemaatilise ülevaate alusel suurendab äge neeru- kahjustus KNH esmashaigestumise ja progresseerumise riski, mis ei olene varasemast neerufunktsioonist. Suurem risk jääb püsima ka pärast neerufunkt- siooni näitajate normaliseerumist. (9)
Ühes süstemaatilises ülevaates leiti, et metaboolse sündroomiga patsientidel esineb neerufunktsiooni vähenemist oluliselt sagedamini (hinnanguline glomerulaarfiltratsiooni kiirus (eGFR) alla 60 mL/min/1,73 m2). Seos on seda tugevam, mida rohkem metaboolse sündroomi üksikkomponente patsiendil esineb (12). NICE-i kroonilise neeruhaiguse ravijuhendi raames koostatud süstemaatilises ülevaates rõhutatakse metaboolse sündroomiga patsientide sõelumise vajadust: uuringud üksnes suure kehamassiindeksi (KMI) ja KNH seostest on vastukäivad, kuid metaboolse sündroomi korral on tõestatud oluline lisarisk KNH tekkeks (9).
11 kohortuuringul põhineva süstemaatilise ülevaate alusel suurendab äge neeru- kahjustus KNH esmashaigestumise ja progresseerumise riski, mis ei olene varasemast neerufunktsioonist. Suurem risk jääb püsima ka pärast neerufunkt- siooni näitajate normaliseerumist. (9)
Ka ravijuhendites ei soovitata kogu elanikkonda KNH suhtes sõeluda. Ravijuhendite soovituste põhjal kuuluvad kindlalt KNH suhtes sõelumist vajavate riskirühmade hulka diabeedi või kõrgvererõhktõvega patsiendid ja ka muu SVH-ga (südame isheemiatõbi, krooniline südamepuudulikkus, perifeersete arterite ateroskleroos, ateroskleroosist tingitud ajuvereringe häired) patsiendid (8, 12–14). Samuti tuleks KNH suhtes sõeluda patsiente, kellel on pereanamneesis neerupuudulikkus või pärilik neeruhaigus, esineb kuseteede struktuurne haigus, neerukivitõbi, eesnäärme suurenemine või potentsiaalselt neeru kahjustav süsteemne haigus (nt süsteemne erütematoosluupus), ning patsiente, kes tarvitavad regulaarselt nefrotoksilisi ravimeid, sh mittesteroidseid põletikuvastaseid aineid (MSPVA) (8, 12–14).
Vanust käsitletakse KNH riskitegurina neljas ravijuhendis, kuid tõenduspõhisus vanemaealise elanikkonna sõelumiseks KNH suhtes on ebapiisav (8, 12–14). Ravijuhendi raames tehtud süstemaatiline ülevaade ja kulutõhususe analüüs näitasid, et kaasnevate riskiteguriteta üle 55-aastaste inimeste KNH suhtes sõelumine ei ole kulutõhus (9).
Töörühma arvates on KNH suhtes vaja sõeluda riskirühmade patsiente, sest KNH varasem diagnoosimine ja ravi alustamine pidurdab selle progresseerumist, vähendab lõppstaadiumi neeruhaiguse (LSNH) kujunemist ja suremust. Samuti on patsientide regulaarne sõelumine KNH suhtes kindlasti vajalik pärast ägeda neerupuudulikkuse episoodi, et avastada haigus võimalikult varajases staadiumis (vt lisa 1).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K1.
Vanust käsitletakse KNH riskitegurina neljas ravijuhendis, kuid tõenduspõhisus vanemaealise elanikkonna sõelumiseks KNH suhtes on ebapiisav (8, 12–14). Ravijuhendi raames tehtud süstemaatiline ülevaade ja kulutõhususe analüüs näitasid, et kaasnevate riskiteguriteta üle 55-aastaste inimeste KNH suhtes sõelumine ei ole kulutõhus (9).
Töörühma arvates on KNH suhtes vaja sõeluda riskirühmade patsiente, sest KNH varasem diagnoosimine ja ravi alustamine pidurdab selle progresseerumist, vähendab lõppstaadiumi neeruhaiguse (LSNH) kujunemist ja suremust. Samuti on patsientide regulaarne sõelumine KNH suhtes kindlasti vajalik pärast ägeda neerupuudulikkuse episoodi, et avastada haigus võimalikult varajases staadiumis (vt lisa 1).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K1.
| 5 |
|
Diabeedi, kõrgvererõhktõve ja teiste südame ja veresoonkonna haiguste, potentsiaalselt neeru kahjustava süsteemse haigusega ning regulaarselt nefrotoksilisi ravimeid kasutavaid patsiente on soovitatav kroonilise neeruhaiguse suhtes sõeluda vähemalt üks kord aastas (vt lisa 1). |
| 6 |
|
Kroonilise neeruhaiguse suhtes on soovitatav sõeluda kliinilise näidustuse põhjal iga kahe kuni viie aasta tagant metaboolse sündroomi, struktuursete urotrakti haiguste, korduvate neeru- kivide, eesnäärme hüpertroofia ja neeruhaiguste perekondliku anamneesiga patsiente (vt lisa 1). |
| 7 |
|
Kroonilise neeruhaiguse suhtes sõelumiseks on soovitatav määrata patsiendil järgmised laboratoorsed uuringud: albumi- nuuria hindamiseks albumiini ja kreatiniini suhe uriinis, glo- merulaarfiltratsiooni hindamiseks kreatiniin seerumis/plasmas ning eGFR. |
Süstemaatilisi ülevaateid ega juhuslikustatud kontrolluuringuid, mis käsitleksid KNH suhtes sõelumiseks vajalikke laboratoorseid uuringuid või uuringute tegemise sagedust, ei leitud. Ravijuhendite soovitustes tuginetakse kohortuuringute tulemustele ja ekspertide konsensusele. Prospektiivse kohortuuringu ja juhus- likustatud kontrolluuringu tulemuste põhjal on progresseeruv albuminuuria kõige olulisem ennustav tegur KNH väljakujunemisel: albuminuuria hindamine on (kardiovaskulaarsete tüsistuste riski aspektist) olulisem kui SVH tekkeriski hindamine (15, 16). eGFR alla 70 mL/min/1,73 m2 suurendab SVH tekkimise riski (18). Retrospektiivses uuringus leiti, et nii kardiovaskulaarne kui ka üldine suremus suurenevad oluliselt, kui eGFR on alla 45 mL/min/1,73 m2 (19).
Läbilõikeuuringu põhjal, milles jälgiti uuritavate U-Alb/U-Crea ning eGFR-i väärtuseid, peaks KNH klassifitseerimise aluseks olema samaaegne albuminuuria ja eGFRi hindamine. Ainuüksi albumiini ja kreatiniini suhte määramisega uriinist (U-Alb/U-Crea) ei saa ennustada võimalikke tüsistusi ega mõjutada kliinilist tegevusplaani. (20)
Inimestel, kellel on diagnoositud KNH, on soovitatav vähemalt kord aastas määrata kreatiniinisisaldus seerumis/plasmas (S,P-Crea) ja hinnata eGFR-i ning U-Alb/ U-Crea-d. eGFR-i ja albuminuuriat peaks sagedamini hindama inimestel, kel on suurem risk KNH progresseerumiseks ja/või kelle uuringu tulemus mõjutaks edasisi raviotsuseid. Kõiki KNH-ga patsiente pole vaja sagedasti jälgida, tähtis on kliiniline kontekst. (1, 8, 17)
Läbilõikeuuringu põhjal, milles jälgiti uuritavate U-Alb/U-Crea ning eGFR-i väärtuseid, peaks KNH klassifitseerimise aluseks olema samaaegne albuminuuria ja eGFRi hindamine. Ainuüksi albumiini ja kreatiniini suhte määramisega uriinist (U-Alb/U-Crea) ei saa ennustada võimalikke tüsistusi ega mõjutada kliinilist tegevusplaani. (20)
Inimestel, kellel on diagnoositud KNH, on soovitatav vähemalt kord aastas määrata kreatiniinisisaldus seerumis/plasmas (S,P-Crea) ja hinnata eGFR-i ning U-Alb/ U-Crea-d. eGFR-i ja albuminuuriat peaks sagedamini hindama inimestel, kel on suurem risk KNH progresseerumiseks ja/või kelle uuringu tulemus mõjutaks edasisi raviotsuseid. Kõiki KNH-ga patsiente pole vaja sagedasti jälgida, tähtis on kliiniline kontekst. (1, 8, 17)
Toetudes olemasolevale tõendusmaterjalile, on soovitatav neerufunktsiooni hinnata ka ägeda haigestumise puhul või perioperatiivselt kõigil patsientidel, kel on diagnoositud KNH. Hindamise sagedus sõltub kliinilisest vajadusest. (9)
Ravijuhendi töörühm soovitab tõendusmaterjalile tuginedes jälgida patsiente KNH suhtes olenevalt haiguse raskusastmest (vt lisa 3) (2). Regulaarne KNH hindamine on patsiendi seisukohast oluline, et avastada haigus varakult ja teha õigeaegsed raviotsused, mis võimaldavad haiguse süvenemist pidurdada. Kuigi metaboolse sündroomi, urotrakti struktuursete haiguste, korduvate neerukivide, eesnäärme hüpertroofia ning neeruhaiguste perekondliku anamneesiga patsientide jälgimise sageduse kohta KNH suhtes puudub kvaliteetne tõendusmaterjal, on oluline, et nende riskirühmade patsiendid ei jääks regulaarse kontrollita. Selle teema vähest tõenduspõhisust selgitab asjaolu, et selliste juhuslikustatud kontrolluuringute tegemine ei ole eetilistel põhjustel võimalik. (8, 12)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K2.
Ravijuhendi töörühm soovitab tõendusmaterjalile tuginedes jälgida patsiente KNH suhtes olenevalt haiguse raskusastmest (vt lisa 3) (2). Regulaarne KNH hindamine on patsiendi seisukohast oluline, et avastada haigus varakult ja teha õigeaegsed raviotsused, mis võimaldavad haiguse süvenemist pidurdada. Kuigi metaboolse sündroomi, urotrakti struktuursete haiguste, korduvate neerukivide, eesnäärme hüpertroofia ning neeruhaiguste perekondliku anamneesiga patsientide jälgimise sageduse kohta KNH suhtes puudub kvaliteetne tõendusmaterjal, on oluline, et nende riskirühmade patsiendid ei jääks regulaarse kontrollita. Selle teema vähest tõenduspõhisust selgitab asjaolu, et selliste juhuslikustatud kontrolluuringute tegemine ei ole eetilistel põhjustel võimalik. (8, 12)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K2.
Kroonilise neeruhaiguse diagnoosimine
| 8 |
|
Kroonilise neeruhaiguse kahtlusega patsiendile määrake diag- noosi kinnitamiseks laboratoorsed uuringud: kreatiniin seerumis/ plasmas, eGFR ja albumiini ja kreatiniini suhe uriinis. Kordu- suuringud tehke ühe nädala ja seejärel kolme kuu möödudes. |
| 9 |
|
Esmadiagnoositud kroonilise neeruhaigusega patsiendile tehke vajaduse korral ja uroloogilise haiguse kahtlusel lisaks kuseteede ultraheliuuring (k.a jääkuriini määramine), eesnäärme ultraheli- uuring ning prostataspetsiifilise antigeeni analüüs. |
| 10 |
|
Esmadiagnoositud kroonilise neeruhaigusega patsient, kelle kae- bused viitavad günekoloogilisele haigusele, suunake günekoloogi konsultatsioonile. |
Süstemaatilisi ülevaateid ega metaanalüüse KNH diagnoosi täpsustavate uuringute kohta ei leidunud. Üks ravijuhend toetub 11 kohortuuringule, kuid soovituste aluseks on ravijuhendite töörühmade eksperdiarvamus (9). Kõikides ravijuhendites leiduvate soovituste põhjal on KNH esmase diagnoosimise kriteerium eGFR alla 60 mL/min/1,73 m2 (KNH G3a–G5 raskusastmes) rohkem kui kolme kuu vältel, mida saab praegu pidada diagnoosimise standardiks. Seetõttu on KNH diagnoosi kinnitamiseks ning kulu hindamiseks tähtis määrata korduvad laboratoorsed uuringud (S,P-Crea, eGFR). (1, 8, 12, 14) eGFR-i alanemist enam kui 2 mL/min/1,73 m2 aasta jooksul ei saa käsitleda üksnes ealise muutusena, eriti kui eGFR alaneb alla 60 mL/min/1,73 m2. Selge põhjuseta neerufunktsiooni vähenemist peaks kontrollima vähemalt kolmel korral 90 päeva vältel. (9)
Vältimaks viivitust raske neerupuudulikkusega patsientide nefroloogi jälgimisele suunamisel, peab töörühm oluliseks, et kui patsientidel leitakse esimest korda G5 raskusastmes neerufunktsiooni langus, konsulteeritaks edasise tegevuse asjus nefroloogiga (vt ka soovitused nr 58 ja 59).
Vältimaks viivitust raske neerupuudulikkusega patsientide nefroloogi jälgimisele suunamisel, peab töörühm oluliseks, et kui patsientidel leitakse esimest korda G5 raskusastmes neerufunktsiooni langus, konsulteeritaks edasise tegevuse asjus nefroloogiga (vt ka soovitused nr 58 ja 59).
Üks ravijuhend soovitab KNH diagnoosimisel ja haiguse kulu hindamisel arvestada ka vähemalt kolm kuud püsinud hälvet uriini sademes, nihkeid elektrolüütide tasakaalus, neerude struktuurseid kõrvalekaldeid ning haiguslikke muutusi histoloogias. KNH diagnoos peaks olema ka neerusiiriku olemasolul. (2)
Ultraheli võiks olla esmane lisauuring esmadiagnoositud neeruhaiguse korral, kuna see võimaldab eristada KNH-d võimalikust taaspöörduvast ägedast neerupuudulikkusest või avastada KNH varem. Uuringu käigus hinnatakse näiteks neerude kuju ja suurust, parenhüümi paksust, võimalikku obstruktsiooni, armistumist ning seda, kas esineb polütsüstiline neeruhaigus (9).
Töörühma hinnangul tuleb KNH diagnoosi kinnitamiseks korduvalt määrata S,P- Crea, eGFR ja U-Alb/U-Crea alguses ühe nädala möödudes ning seejärel kolme kuu jooksul. Kuna töörühma hinnangul on oluline enne lõplikku KNH diagnoosi määramist välistada neerufunktsiooni vähenemise põhjusena uroloogilised ja günekoloogilised haigused, koostas töörühm piisava tõenduspõhise materjali puudumisel hea tava suunised. Praegu suunatakse nefroloogi vastuvõtule sageli patsiendid, kelle kaebuste põhjus on uroloogiline või günekoloogiline haigus. Seepärast on uroloogiliste või günekoloogiliste haiguste kahtluse korral vaja teha lisauuringud (näiteks kuseteede ultraheliuuring (k.a jääkuriini määramine), eesnäärme ultraheliuuring, prostataspetsiifilise antigeeni analüüs, günekoloogiline läbivaatus) ning suunata patsient vajaduse korral eriarsti vastuvõtule.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K3.
Ultraheli võiks olla esmane lisauuring esmadiagnoositud neeruhaiguse korral, kuna see võimaldab eristada KNH-d võimalikust taaspöörduvast ägedast neerupuudulikkusest või avastada KNH varem. Uuringu käigus hinnatakse näiteks neerude kuju ja suurust, parenhüümi paksust, võimalikku obstruktsiooni, armistumist ning seda, kas esineb polütsüstiline neeruhaigus (9).
Töörühma hinnangul tuleb KNH diagnoosi kinnitamiseks korduvalt määrata S,P- Crea, eGFR ja U-Alb/U-Crea alguses ühe nädala möödudes ning seejärel kolme kuu jooksul. Kuna töörühma hinnangul on oluline enne lõplikku KNH diagnoosi määramist välistada neerufunktsiooni vähenemise põhjusena uroloogilised ja günekoloogilised haigused, koostas töörühm piisava tõenduspõhise materjali puudumisel hea tava suunised. Praegu suunatakse nefroloogi vastuvõtule sageli patsiendid, kelle kaebuste põhjus on uroloogiline või günekoloogiline haigus. Seepärast on uroloogiliste või günekoloogiliste haiguste kahtluse korral vaja teha lisauuringud (näiteks kuseteede ultraheliuuring (k.a jääkuriini määramine), eesnäärme ultraheliuuring, prostataspetsiifilise antigeeni analüüs, günekoloogiline läbivaatus) ning suunata patsient vajaduse korral eriarsti vastuvõtule.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K3.
| 11 |
|
Kroonilise neeruhaiguse riskirühma või kroonilise neeruhai- guse diagnoosiga patsiendil määrake proteinuuria täpsemaks hin- damiseks albumiini ja kreatiniini suhe kvantitatiivselt (eelistatult esmasest hommikusest uriinist). |
| 12 |
|
Väljendunud albuminuuria korral (albumiini ja kreatiniini suhe uriinis üle 30 mg/mmol*, A3) eelistage proteinuuria korduvaks hindamiseks ja dünaamika jälgimiseks valgu ja kreatiniini suhte määramist uriinis. *mg/mmol = g/mol |
| 13 | |
Ärge kasutage proteinuuria suuruse määramiseks uriini riba- analüüsi. |
Albuminuuria hindamine on populatsioonipõhiste kohortuuringute ja statistiliste analüüside alusel glomerulaarfiltratsiooni aspektist spetsiifilisem ning tundlikum meetod kui proteinuuria hindamine. Ravijuhendite soovitused põhinevad prospektiivsetel kohortuuringutel, milles käsitleti rasedusaegse proteinuuria hindamist ja näidati, et uriini ribaanalüüs ei ole piisavalt spetsiifiline ning annab palju valepositiivseid tulemusi. (1, 8)
Populatsioonipõhise kestvusuuringu põhjal on uriini ribaanalüüsi tundlikkus 58% juhul, kui U-Alb/U-Crea on üle 3 mg/mmol, ning 99%, kui U-Alb/U-Crea on üle 30 mg/mmol. Albuminuuria hindamiseks ei soovitata kasutada uriini ribaanalüüsi, sest meetod ei täida hea sõeltesti kriteeriume ega võimalda hinnata KNH kulgu. (2)
U-Prot/U-Crea määramine sobib kasutamiseks üksnes väljendunud proteinuuria korral. Vähesema proteinuuria korral tuleks vajaduse korral taas määrata pro- teinuuria hindamiseks U-Alb/U-Crea (9). U-Prot/U-Crea ja valgu määramist 24 tunni uriinis võib vaadelda samaväärsete meetoditena (2).
Proteinuuria hindamine selleks, et KNH riskiteguritega patsiente sõeluda ja haiguse progresseerumist hinnata, on kulutõhususe aspektist põhjendatud (1, 13, 20).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K4.
U-Prot/U-Crea määramine sobib kasutamiseks üksnes väljendunud proteinuuria korral. Vähesema proteinuuria korral tuleks vajaduse korral taas määrata pro- teinuuria hindamiseks U-Alb/U-Crea (9). U-Prot/U-Crea ja valgu määramist 24 tunni uriinis võib vaadelda samaväärsete meetoditena (2).
Proteinuuria hindamine selleks, et KNH riskiteguritega patsiente sõeluda ja haiguse progresseerumist hinnata, on kulutõhususe aspektist põhjendatud (1, 13, 20).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K4.
| 14 |
|
Kroonilise neeruhaiguse riskirühma või kroonilise neeruhai- gusega patsiendil määrake glomerulaarfiltratsiooni täpsemaks hindamiseks lisaks seerumi/plasma kreatiniini määramisele ka eGFR, kasutades CKD-EPI valemit. [AJAKOHASTATUD 2023] |
2017. aastal koostatud algses ravijuhendis tugineti seda soovitust andes kõrge kvaliteediga vaatlusuuringutele, süstemaatilisele ülevaatele ja kulutõhususe analüüsile. Tõendust arvestades on kroonilise neeruhaiguse hindamiseks eelistatud S,P-Crea kontsentratsiooni määramine ja saadud tulemuse põhjal eGFR-i määramine. Üksnes S,P-Crea kontsentratsiooni määramine on neerude funktsiooni hindamiseks liiga vähese tundlikkusega. S,P-Crea ja eGFR-i samaaegne määramine suurendab meetodi tundlikkust ning on enamjaolt sobiv KNH raskusastme täpsustamiseks ja KNH progresseerumise jälgimiseks. eGFR tuleks arvutada CKD-EPI valemi alusel. eGFR-i tulemuste tõlgendamisel tuleb arvestada, et glomerulaarfiltratsiooni suurema kiiruse puhul on eGFR ebatäpne. (1, 8, 13, 21)
24 tunni uriinist mõõdetava kreatiniini kliirensi määramine on glomerulaar- filtratsiooni kiiruse hindamiseks ebatäpne ja rutiinselt seda teha ei soovitata (1, 8, 13, 21, 22).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K5.
Ravijuhendi ajakohastamise käigus soovis töörühm teada saada, kas lisaks kreatiniinil põhinevale eGFR-i hindamisele tuleks eGFR-i hinnata ka tsüstatiin C alusel. Leitud tõendus on uuringute varieeruvuse tõttu madal. Ühele metaanalüüsile (24) ja kolmele kohortuuringule (25–27) toetudes võib tsüstatiin C-d kaasavaid eGFR-i võrrandeid pidada küll kreatiniinil põhinevast eGFR-i võrrandist täpsemaks, kuid tulemuste erinevused ei olnud suured ning diagnostiline täpsus oli mõnevõrra mõjutatud uuritavate omadustest (kehakaal, standardmeetodil mõõdetud GFR-i väärtus).
Töörühm leidis, et neerufunktsiooni hindamisel on kreatiniini ja selle alusel eGFR-i määramine tavapraktika. Diagnostiline täpsus GFR-i määramisel on tähtis neerufunktsiooni täpsel hindamisel ja KNH staadiumi määramisel ning võib mõjutada kliinilises praktikas sobiva ravimiannuse määramist ja ravimeetodi valikut. Kreatiniinil põhineva eGFR-i tulemused võivad teatud olukordades olla vähem usaldusväärsed (näiteks ägeda neerupuudulikkuse, raseduse, tursete, alatoitumuse, vähenenud lihasmassi või amputatsioonide ning ka suure lihasmassi ja valgupreparaatide tarvitamise korral). Nendes olukordades võib diagnoosi kinnitamisel olla abi lisaks tsüstatiin C määramisest. Töörühm rõhutas, et KNH-ga patsiendi jälgimisel on oluline eGFR-i eri väärtuste võrdlemine ajas. Et tulemused oleksid võrreldavad, on soovitatav kasutada ühtset eGFR-i hindamise meetodit. Viidates nii tekkivale lisakulule kui ka ebapiisavale tõendusele tsüstatiin C määramise teemal, soovitab töörühm neerufunktsiooni rutiinseks hindamiseks kasutada kreatiniini ja sellel põhinevat eGFR-i määramist. Euroopa Laborimeditsiini Föderatsioon (EFLM) soovitab kasutada CKD-EPI 2009. aasta valemit ja mitte minna üle 2021. aasta valemile, kuna viimasega saavutataks europiidsel rassil halvem korrelatsioon tegeliku glomerulaarfiltratsiooni kiirusega kui praeguse CKD-EPI 2009 valemiga (28).
Vaata veebilehelt www.ravijuhend.ee ajakohastatud ravijuhendi kliinilise küsimuse nr 1 TõKo ja SoKo tabelit.
Kroonilise neeruhaigusega patsientide nõustamine eluviisi teemal
| 15 |
|
Kroonilise neeruhaiguse riskirühma patsienti nõustage tervislike eluviiside järgimise asjus olenevalt riskiteguritest (füüsilise ak- tiivsuse suurendamine ja ülekaalu vähendamine, suitsetamisest loobumine, alkoholitarvitamise piiramine). |
| 16 |
|
Kroonilise neeruhaigusega patsiendile soovitage mõõduka inten- siivsusega aeroobset treeningut võimaluse korral vähemalt 30 minutit järjest viis korda nädalas. Arvestama peab patsiendi füüsi- list võimekust, kroonilise neeruhaiguse raskusastet ja kaasnevaid haigusi. |
| 17 |
|
Kroonilise neeruhaigusega patsienti nõustage tervisliku toitumise teemal. [UUS 2023] Praktiline soovitus |
| 18 |
|
Ülekaalulist kroonilise neeruhaigusega patsienti nõustage kaalu langetamiseks toitumise teemal, lähtudes haiguse raskusastmest Suitsetavaid patsiente nõustage suitsetamisest loobumiseks. |
| 19 |
|
Kroonilise neeruhaigusega patsiendi nõustamisel dokumenteerige füüsiline aktiivsus, kehakaal, kehamassiindeks, toitumissoovi- tused, suitsetamine, alkoholitarvitamine, tursete olemasolu, vede- likutarbimine. [UUS 2023] Praktiline soovitus |
| 20 | |
Kroonilise neeruhaigusega patsiendil soovitage hoida alkoholi- tarvitamist väikese riski piirides. |
KNH-ga patsientide nõustamise kohta eluviiside muutmiseks ravitulemuste parandamise eesmärgil leidus üheksa eri kvaliteediga uuringut, kus enamasti kasutati terviseprogramme ja spetsialistipoolset nõustamist või jälgimist. Soovitusi anti viies ravijuhendis.
Kehakaal
Rasvumisest tingitud KNH-ga patsientide neerufunktsiooni parandamiseks on esimene valik süsivesikuvaene ja väiksema kalorsusega dieet. Samuti on soovitatav pidada kinni tervislikest eluviisidest. Oluline on alustada kehakaalu langetamist KNH varases staadiumis. (29)
Süstemaatilises ülevaates (17 uuringut), milles uuriti energiavaese dieedi mõju diabeedi ja KNH-ga (G3–G5) patsientidele, leiti, et energiavaesem dieet vähendas neil patsientidel oluliselt proteinuuriat ning pidurdas neerufunktsiooni vähenemist. Aeroobsete harjutuste lisamisega vähenesid KMI, kehakaal ja rasvaprotsent. Selle tulemusel paranesid füüsiline vorm ja üldine elukvaliteet. (30)
Ravijuhendites soovitatakse süstemaatiliste ülevaadete, kohortuuringute ja kliiniliste uuringute põhjal nii KNH riskirühma kui ka KNH-ga patsientidele tervislike eluviiside ja dieedi teemal nõustamist, oluline on hoida kehakaal normi piires (13). Nõustamisega peaks tegelema erialaspetsialist (1, 12–14). Soovitatav KMI on 18,5–24,9 kg/mm2, vööümbermõõt meestel alla 102 cm ja naistel alla 88 cm (13).
Süstemaatilises ülevaates (17 uuringut), milles uuriti energiavaese dieedi mõju diabeedi ja KNH-ga (G3–G5) patsientidele, leiti, et energiavaesem dieet vähendas neil patsientidel oluliselt proteinuuriat ning pidurdas neerufunktsiooni vähenemist. Aeroobsete harjutuste lisamisega vähenesid KMI, kehakaal ja rasvaprotsent. Selle tulemusel paranesid füüsiline vorm ja üldine elukvaliteet. (30)
Ravijuhendites soovitatakse süstemaatiliste ülevaadete, kohortuuringute ja kliiniliste uuringute põhjal nii KNH riskirühma kui ka KNH-ga patsientidele tervislike eluviiside ja dieedi teemal nõustamist, oluline on hoida kehakaal normi piires (13). Nõustamisega peaks tegelema erialaspetsialist (1, 12–14). Soovitatav KMI on 18,5–24,9 kg/mm2, vööümbermõõt meestel alla 102 cm ja naistel alla 88 cm (13).
Füüsiline aktiivsus
KNH-ga patsientide füüsilise aktiivsuse kohta süstemaatilisi ülevaateid ei leitud. Füüsilist aktiivsust nõudvaid tegevusi soovitatakse ravijuhendis harrastada viiel korral nädalas vähemalt 30 minutit korraga, et tagada tervislik kehakaal (2). KNH riskirühma ja KNH-ga patsiente peab regulaarse füüsilise aktiivsuse teemal nõustama erialaspetsialist. Regulaarne füüsiline aktiivsus peab sobima patsiendi füüsilise vormi, võimete ja haiguse anamneesiga. (13)
Soolatarbimine
KNH-ga patsientidele on soovitatav vähese soolasisaldusega dieet (< 2,4 g või
< 100 mmol naatriumi päevas või < 6 g keedusoola päevas), et alandada vererõhku ja vähendada SVH-sse haigestumise riski (3, 11–13).
Juhuslikustatud kontrolluuringu andmetel alandab väiksem soolatarbimine kõrgvererõhktõve diagnoosiga KNH-ga patsientidel vererõhku ja parandab neerufunktsiooni. Väiksema soolasisaldusega toidu tarbijatel vähenesid ka rakuvälise vedeliku maht, kehakaal, albuminuuria ja proteinuuria. (31)
< 100 mmol naatriumi päevas või < 6 g keedusoola päevas), et alandada vererõhku ja vähendada SVH-sse haigestumise riski (3, 11–13).
Juhuslikustatud kontrolluuringu andmetel alandab väiksem soolatarbimine kõrgvererõhktõve diagnoosiga KNH-ga patsientidel vererõhku ja parandab neerufunktsiooni. Väiksema soolasisaldusega toidu tarbijatel vähenesid ka rakuvälise vedeliku maht, kehakaal, albuminuuria ja proteinuuria. (31)
Valgutarbimine
Süstemaatilise ülevaate tulemuste põhjal on toidus loomse valgu piiramine oluline patsientidel, kelle eGFR on alla 15 mL/min/1,73 m2 (32). Valgutarbimist soovitatakse vähendada (kuni 0,8 g/kg päevas) patsientidel, kelle eGFR on alla 30 mL/min/1,73 m2 või kellel on diabeet (2). Samas ei soovitata vähese valgu- sisaldusega dieeti kõikidele KNH-ga patsientidele: tähtis on arvestada patsiendi vanust, KNH raskusastet, kaasnevaid haigusi (nt diabeet) jm tegureid (9).
Suitsetamine
Uuringu „Third National Health and Nutrition Examination Survey“ (NHANES) jätkuanalüüsis leiti, et KNH-ga mittesuitsetavate (46%) või suitsetamisest loobunud (39%) patsientide suremus vähenes märgatavalt enam kui suitsetavatel KNH-ga patsientidel (33). Et aidata suitsetamisest loobumisele kaasa, on soovitatav patsienti nõustada ja vajaduse korral koostada loobumisplaan (34).
Alkoholitarvitamine
KNH-ga patsientidel on riski vähendamiseks soovitatav alkoholitarvitamist piirata (12, 14). Alkoholi liigtarvitamise puhul tuleks patsienti alkoholist loobumisel nõustada ja suunata ta vajaduse korral psühhiaatri e-konsultatsioonile (1).
Kuigi süstemaatilistes ülevaadetes ei leitud seoseid alkoholi tarvitamise ja KNH progresseerumise vahel, otsustas töörühm juhtida tähelepanu tervislike eluviiside olulisusele ning sõnastada hea tava suunise.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K6_K7.
Infomaterjali kroonilise neeruhaigusega patsiendi toitumissoovitustest leiab veebilehelt www.ravijuhend.ee/patsiendivarav/juhendid.
Ravijuhendi ajakohastamise käigus soovis töörühm rõhutada KNH-ga patsiendi nõustamise tähtsust. Teemad, millele KNH-ga patsientide nõustamisel tähelepanu pöörata, on füüsiline aktiivsus, kehakaal ja KMI, tervislik toitumine, kahjulikud harjumused (suitsetamine ja alkoholitarvitamine), vedelikutarbimine ning tursete kontrollimine. Soovitada tuleks vähese soolasisaldusega dieeti. Osal patsientidest võib osutuda vajalikuks piirata valgu- või kaaliumirikka toidu tarbimist. Patsiendi esmane nõustamine peaks toimuma arsti või õe kontaktvastuvõtuna, edaspidi võib nõustada ka kaugvastuvõtu teel. Vastuvõtu käigus on vajalik kõne all olnud teemad dokumenteerida patsiendi tervisekaarti või vastuvõtu käigus koostatavasse epikriisi.
Kuigi süstemaatilistes ülevaadetes ei leitud seoseid alkoholi tarvitamise ja KNH progresseerumise vahel, otsustas töörühm juhtida tähelepanu tervislike eluviiside olulisusele ning sõnastada hea tava suunise.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K6_K7.
Infomaterjali kroonilise neeruhaigusega patsiendi toitumissoovitustest leiab veebilehelt www.ravijuhend.ee/patsiendivarav/juhendid.
Ravijuhendi ajakohastamise käigus soovis töörühm rõhutada KNH-ga patsiendi nõustamise tähtsust. Teemad, millele KNH-ga patsientide nõustamisel tähelepanu pöörata, on füüsiline aktiivsus, kehakaal ja KMI, tervislik toitumine, kahjulikud harjumused (suitsetamine ja alkoholitarvitamine), vedelikutarbimine ning tursete kontrollimine. Soovitada tuleks vähese soolasisaldusega dieeti. Osal patsientidest võib osutuda vajalikuks piirata valgu- või kaaliumirikka toidu tarbimist. Patsiendi esmane nõustamine peaks toimuma arsti või õe kontaktvastuvõtuna, edaspidi võib nõustada ka kaugvastuvõtu teel. Vastuvõtu käigus on vajalik kõne all olnud teemad dokumenteerida patsiendi tervisekaarti või vastuvõtu käigus koostatavasse epikriisi.
Südame-veresoonkonnahaiguste riski hindamine kroonilise neeruhaigusega patsientidel
| 21 |
|
Kroonilise neeruhaigusega patsiendil, kelle eGFR on võrdne või kõrgem kui 60 mL/min/1,73 m2 (G1–G2), hinnake riski sü- dame-veresoonkonnahaiguste tekkeks sarnaselt tavarahvastikuga. Kroonilise neeruhaigusega patsienti, kelle eGFR on 30–59 mL/ min/1,73 m2 (G3a–G3b), käsitlege südameveresoonkonnahaiguste suure riskiga patsiendina. Kroonilise neeruhaigusega patsienti, kelle eGFR on alla 30 mL/ min/1,73 m2 (G4–G5), käsitlege südameveresoonkonnahaiguste ülisuure riskiga patsiendina. |
14 üldrahvastikul põhinevat kohortuuringut hõlmavas metaanalüüsis käsitleti eGFR-i ja albuminuuria seost üldsuremuse ning SVH-sse suremusega. U-Alb/ U-Crea ja suremuse vahel oli statistiliselt oluline seos. Suremusrisk suureneb kumuleeruvalt, kui eGFR on alla 75 mL/min/1,73 m2. Nii eGFR kui ka U-Alb/ U-Crea on teineteisest sõltumatud suremusenäitajad. (35)Ravijuhendi soovitustes on tuginetud kahele kestvusuuringule. Alanenud eGFR ja suurenenud U-Alb/U-Crea on SVH riskifaktorid kõigis vanuserühmades, eriti üle 70aastaste seas. (2)
Süstemaatilises ülevaates, mille eesmärk oli hinnata KNH-ga patsientide kõrgvererõhktõve ravi esmatasandi meditsiinis, leiti, et kõrgvererõhu ravi vähendab SVH riski ning KNH süvenemise tõenäosust (36). Prospektiivse kohortuuringu (KNH G3–G5) tulemused näitasid vererõhuväärtuste, ja surma vahel statistiliselt olulist seost, mis on proportsionaalne eGFR-i alanemisega (37). Parem kardiovaskulaarne staatus tähendab kroonilise neeruhaiguse (eGFR alla 60 mL/min/1,73 m2) korral väiksemat suremust (38).
KNH-ga patsientide riski ja suremuse vähendamiseks on oluline saavutada optimaalsed vererõhuväärtused (nelja kohortuuringu tulemuste põhjal) ning korrigeerida hüperlipideemiat (kahe metaanalüüsi ning kahe kohortuuringu tulemuste põhjal). Seejuures rõhutatakse võimalust vähendada statiinraviga proteinuuriast tingitud riskitegureid. Lisaks soovitatakse loobuda suitsetamisest, saavutada optimaalne kehakaal ja vere glükoosisisaldus ning olla füüsiliselt aktiivne. (2)
Süstemaatilises ülevaates, mille eesmärk oli hinnata KNH-ga patsientide kõrgvererõhktõve ravi esmatasandi meditsiinis, leiti, et kõrgvererõhu ravi vähendab SVH riski ning KNH süvenemise tõenäosust (36). Prospektiivse kohortuuringu (KNH G3–G5) tulemused näitasid vererõhuväärtuste, ja surma vahel statistiliselt olulist seost, mis on proportsionaalne eGFR-i alanemisega (37). Parem kardiovaskulaarne staatus tähendab kroonilise neeruhaiguse (eGFR alla 60 mL/min/1,73 m2) korral väiksemat suremust (38).
KNH-ga patsientide riski ja suremuse vähendamiseks on oluline saavutada optimaalsed vererõhuväärtused (nelja kohortuuringu tulemuste põhjal) ning korrigeerida hüperlipideemiat (kahe metaanalüüsi ning kahe kohortuuringu tulemuste põhjal). Seejuures rõhutatakse võimalust vähendada statiinraviga proteinuuriast tingitud riskitegureid. Lisaks soovitatakse loobuda suitsetamisest, saavutada optimaalne kehakaal ja vere glükoosisisaldus ning olla füüsiliselt aktiivne. (2)
Olemasolevale tõendusmaterjalile tuginedes võib järeldada, et albuminuuria ja alanenud eGFR on teineteisest sõltumatult suremuse ning sealhulgas kardiovaskulaarse suremuse riskitegurid. KNH-ga patsiendi risk surra on suurem kui risk, et haigus progresseerub LSNH-ni. Leitud tõendusele tuginedes leidis töörühm, et eGFR-i langedes alla 60 mL/min/1,73 m2 on patsiendi SVH risk suur või väga suur. Kõrgema eGFR-i korral riski hindama nagu tavapopulatsioonis SCORE2 või SCORE-OP tabelite alusel (39). SVH tekkeriski hindamise sagedus võiks olla samasugune albuminuuria, S,P-Crea ja eGFR-i hindamise sagedusega (vt lisa 3).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K8.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K8.
Kroonilise neeruhaigusega patsientide jälgimine
| 22 |
|
Kroonilise neeruhaigusega patsiendil määrake kroonilise neeru- haiguse progresseerumise hindamiseks regulaarselt kreatiniini tase seerumis/plasmas koos eGFR-i hindamisega ning albumiini ja kreatiniini suhe uriinis. Hindamise sagedus sõltub kroonilise neeruhaiguse raskusastmest, progresseerumise kiirusest ja pat- siendi kliinilisest seisundist (vt lisa 3). |
| 23 |
Kroonilise neeruhaigusega patsiendi ägeda haigestumise (nt in- fektsioon, müokardiinfarkt jt) korral või neeruhaiguse ägenemisel hinnake neerufunktsiooni (kreatiniin seerumis/plasmas, eGFR) dünaamikas. | |
| 24 |
|
Kroonilise neeruhaigusega patsiendil kiire ja ebaselge neeru- funktsiooni vähenemise korral (eGFR-i alanemine enam kui 15 mL/min/1,73 m2 aastas või võrreldes eelmise määramisega) on soovitatav korrata kreatiniini ja eGFR-i analüüsi kahe nädala jooksul, teha lisaks põhjuse täpsustamiseks ultraheliuuring ja konsulteerida vajaduse korral nefroloogiga. |
| 25 |
|
Kroonilise neeruhaigusega patsiendi regulaarseks jälgimiseks võite teha lisaks kontaktvastuvõtule kaugvastuvõttu. [UUS 2023] Praktiline soovitus |
| 26 |
|
Kroonilise neeruhaigusega patsiendi kaugvastuvõtul
[UUS 2023]
Praktiline soovitus |
Proteinuuria ja eGFR on teineteisest sõltumatus seoses üldsuremuse, SVH tüsistuste ning LSNH-ga (32). Kahele kohortuuringule tuginedes soovitab ülevaateartikkel 2. tüüpi diabeedi diagnoosimisel kohe hinnata albuminuuriat ning 1. tüüpi diabeedi puhul teha seda viiendal haigusaastal. Eelistatud meetod on U-Alb/U-Crea. Albuminuuriaga patsientidel tuleb analüüse korrata minimaalselt aastase intervalliga. Hüperglükeemia ja kõrge vererõhk suurendavad albuminuuriat. (40)
Ravijuhendites rõhutatakse vajadust dokumenteerida KNH kulgu. Oluline on fikseerida KNH süvenemine juhul, kui 12 kuu jooksul alaneb eGFR järjepidevalt 25% (või rohkem) ja KNH raskusaste muutub. eGFR-i alanemine peaks olema väljendatud eGFR-i astme muutusena (nt G3 > G4 või eGFR-i alanemine baasväärtusest). Kiire KNH progresseerumine tähendab eGFR-i alanemist eri ravijuhendite põhjal 5–15 mL/min/1,73 m2 aastas. KNH ja südamepuudulikkusega patsientidel on soovitatav pärast iga raviskeemi muutmist või üldseisundi halvenemist hinnata eGFR-i ja kaaliumisisaldust veres. (1, 8, 14, 40, 41)
Ühes ravijuhendis on sõnastatud soovitused ultraheliuuringu (UH) tegemiseks. UH on vajalik neerufunktsiooni kiire vähenemise korral (eGFR-i alanemine rohkem kui 5 mL/min/1,73 m2 aastas või rohkem kui 10 mL/min/1,73 m2 viie aasta vältel), makrohematuuria episoodi või püsiva mikrohematuuria esinemisel. Samuti tuleb UH teha juhul, kui esinevad urotrakti obstruktsiooni sümptomid, perekonnaanamneesis esineb polütsüstiline neeruhaigus (üle 20-aastastel patsientidel), KNH esineb G4 või G5 raskusastmes või kui on vaja teha neerubiopsia. (15)
Ravijuhendi töörühma arvamusel võimaldab KNH varajases raskusastmes diagnoosimine, riski hindamine ja KNH jälgimine selle progresseerumisele õigel ajal reageerida ning seeläbi haiguse kulgu pidurdada. Oluline on KNH riskitegureid vähendada ja olemasolevate tüsistuste (nt aneemia, kõrgvererõhktõbi, hüperfosfateemia, hüpoalbumineemia, hüperparatüreoidism jne) hindamine ja ravimine. Vaatamata kõrge kvaliteediga tõendusmaterjali puudumisele on ravijuhendi koostamisel arvestatud kliinilist praktikat ja ravijuhendi sihtrühma ning sõnastatud vastavad soovitused KNH-ga patsientide jälgimiseks.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K9.
Ravijuhendi ajakohastamise käigus lisas töörühm kaks praktilist soovitust patsiendi jälgimise kohta kaugvastuvõtu teel. Töörühm sõnastas soovituses ka kaugvastuvõtu tegevused.
Ühes ravijuhendis on sõnastatud soovitused ultraheliuuringu (UH) tegemiseks. UH on vajalik neerufunktsiooni kiire vähenemise korral (eGFR-i alanemine rohkem kui 5 mL/min/1,73 m2 aastas või rohkem kui 10 mL/min/1,73 m2 viie aasta vältel), makrohematuuria episoodi või püsiva mikrohematuuria esinemisel. Samuti tuleb UH teha juhul, kui esinevad urotrakti obstruktsiooni sümptomid, perekonnaanamneesis esineb polütsüstiline neeruhaigus (üle 20-aastastel patsientidel), KNH esineb G4 või G5 raskusastmes või kui on vaja teha neerubiopsia. (15)
Ravijuhendi töörühma arvamusel võimaldab KNH varajases raskusastmes diagnoosimine, riski hindamine ja KNH jälgimine selle progresseerumisele õigel ajal reageerida ning seeläbi haiguse kulgu pidurdada. Oluline on KNH riskitegureid vähendada ja olemasolevate tüsistuste (nt aneemia, kõrgvererõhktõbi, hüperfosfateemia, hüpoalbumineemia, hüperparatüreoidism jne) hindamine ja ravimine. Vaatamata kõrge kvaliteediga tõendusmaterjali puudumisele on ravijuhendi koostamisel arvestatud kliinilist praktikat ja ravijuhendi sihtrühma ning sõnastatud vastavad soovitused KNH-ga patsientide jälgimiseks.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K9.
Ravijuhendi ajakohastamise käigus lisas töörühm kaks praktilist soovitust patsiendi jälgimise kohta kaugvastuvõtu teel. Töörühm sõnastas soovituses ka kaugvastuvõtu tegevused.
| 27 |
|
Kroonilise neeruhaiguse patsiendil hoidke ravitulemuste paran- damiseks vererõhk alla 140/90 mm Hg. [AJAKOHASTATUD 2023] Tugev soovitus, mõõdukas tõendatuse aste |
| 28 |
|
Kroonilise neeruhaigusega patsiendil kaaluge kardiovasku- laarsete sündmuste ja üldsuremuse vähendamiseks süstoolse vererõhu hoidmist alla 120 mm Hg. [AJAKOHASTATUD 2023] Nõrk soovitus, madal tõendatuse aste |
2017. aastal koostatud algses ravijuhendis tugineti soovitusi andes järgnevale tõendusmaterjalile. Süstemaatilises ülevaates, mis sisaldas 11 juhuslikustatud uuringut, võrreldi madalamaid vererõhuväärtusi vererõhu tavapäraste siht- väärtustega ja nende seost SVH tüsistuste (müokardiinfarkt, insult, südame- puudulikkus) ning suremusega. Statistiliselt olulist erinevust ei ilmnenud. (43)
15 juhuslikustatud kontrolluuringust koosnevas süstemaatilises ülevaates uuriti kõrgvererõhktõve ravi ja vererõhu sihtväärtuste seost üldsuremuse ning kardiovaskulaarse suremusega üle 60-aastastel patsientidel. Vererõhuravi puhul vähenes kardiovaskulaarne suremus, kuid mitte üldsuremus. Väga madalaid vererõhuväärtusi ei peeta vanemaealistel ohutuks. (2)
Ravijuhendite soovitused põhinevad ühel metaanalüüsil ja viiel kohortuuringul ning nendes jäädakse seisukohale, et vererõhu ravi on vaja alustada, kui vererõhk on üle 140/90 mm Hg. Rõhutatakse, et soovitatavad vererõhu sihtväärtused ei sõltu KNH raskusastmest, vaid diabeedi või albuminuuria olemasolust. (1, 8)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K10.
Ravijuhendi ajakohastamise käigus ilmnes uut tõendusmaterjali vererõhu senisest madalamate sihtväärtuste kohta KNH-ga patsientidel. Materjali ülevaatamisel lähtuti KDIGO 2021. aastal uuendatud ravijuhendist ja ESC/ESH 2018. aasta ravijuhendist (43, 44).
KDIGO 2021. aasta soovitused põhinevad ühel kõrge kvaliteediga juhuslikustatud kontrolluuringul, mis sisaldas ka olulise arvu KNH patsiente. Patsientidel, kellel eelistati intensiivset antihüpertensiivset ravi (süstoolne rõhk alla 120 mm Hg) oli võrreldes võrdlusrühmaga (süstoolne rõhk alla 140 mm Hg) vähem kardiovaskulaarseid sündmuseid ja väiksem suremus (46). Sellele tulemusele sekundeerivad ka neli juhuslikustatud kontrolluuringut (47–50), mida kasutab soovituste sõnastamisel ESC/ESH ravijuhend. Vererõhuväärtuste individuaalsel optimaalsel tasemel hoidmine aeglustab kroonilise neeruhaiguse progresseerumist lõppstaadiumi neeruhaiguseni. U-Alb/Crea on SVH riski ja neeruhaiguse süvenemisel iseseisev prognostiline näitaja (51). Vererõhu langetamine vähendab proteinuuriat ja see pidurdab eGFR-i vähenemist ning kardiovaskulaarsete haiguste kujunemist (52).
Intensiivse antihüpertensiivse ravi rakendamisel on täheldatud eGFR-i vähe- nemist (52, 53). Aastane vähenemine üle 5,6% seostub suurema kroonilise südamepuudulikkuse ja suremusega alates KNH 3. raskusastmest (55). eGFR-i vähenemist seostatakse eelkõige intensiivse diureetilise ravi ja RAAS-i inhi- biitorite kasutamisega (53).
Eeltoodud tõendust arvesse võttes soovitab ravijuhendi töörühm kaaluda KNH-ga patsientidel teatud juhtudel varasemast eesmärgist 130/80 mm Hg veelgi madalama vererõhu eesmärkväärtuse seadmist. Kindlasti tuleb seejuures vältida sümptomaatilist hüpotensiooni.
Vaata veebilehelt www.ravijuhend.ee ajakohastatud ravijuhendi kliinilise küsimuste nr 2 TõKo ja SoKo tabelit.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K10.
Ravijuhendi ajakohastamise käigus ilmnes uut tõendusmaterjali vererõhu senisest madalamate sihtväärtuste kohta KNH-ga patsientidel. Materjali ülevaatamisel lähtuti KDIGO 2021. aastal uuendatud ravijuhendist ja ESC/ESH 2018. aasta ravijuhendist (43, 44).
KDIGO 2021. aasta soovitused põhinevad ühel kõrge kvaliteediga juhuslikustatud kontrolluuringul, mis sisaldas ka olulise arvu KNH patsiente. Patsientidel, kellel eelistati intensiivset antihüpertensiivset ravi (süstoolne rõhk alla 120 mm Hg) oli võrreldes võrdlusrühmaga (süstoolne rõhk alla 140 mm Hg) vähem kardiovaskulaarseid sündmuseid ja väiksem suremus (46). Sellele tulemusele sekundeerivad ka neli juhuslikustatud kontrolluuringut (47–50), mida kasutab soovituste sõnastamisel ESC/ESH ravijuhend. Vererõhuväärtuste individuaalsel optimaalsel tasemel hoidmine aeglustab kroonilise neeruhaiguse progresseerumist lõppstaadiumi neeruhaiguseni. U-Alb/Crea on SVH riski ja neeruhaiguse süvenemisel iseseisev prognostiline näitaja (51). Vererõhu langetamine vähendab proteinuuriat ja see pidurdab eGFR-i vähenemist ning kardiovaskulaarsete haiguste kujunemist (52).
Intensiivse antihüpertensiivse ravi rakendamisel on täheldatud eGFR-i vähe- nemist (52, 53). Aastane vähenemine üle 5,6% seostub suurema kroonilise südamepuudulikkuse ja suremusega alates KNH 3. raskusastmest (55). eGFR-i vähenemist seostatakse eelkõige intensiivse diureetilise ravi ja RAAS-i inhi- biitorite kasutamisega (53).
Eeltoodud tõendust arvesse võttes soovitab ravijuhendi töörühm kaaluda KNH-ga patsientidel teatud juhtudel varasemast eesmärgist 130/80 mm Hg veelgi madalama vererõhu eesmärkväärtuse seadmist. Kindlasti tuleb seejuures vältida sümptomaatilist hüpotensiooni.
Vaata veebilehelt www.ravijuhend.ee ajakohastatud ravijuhendi kliinilise küsimuste nr 2 TõKo ja SoKo tabelit.
| 29 |
|
Kroonilise neeruhaiguse ja diabeediga patsiendil kindlustage kroonilise neeruhaiguse progresseerumise pidurdamiseks parim võimalik diabeedi kompensatsioon, hoides võimaluse korral glükohemoglobiini väärtust alla 53 mmol/mol ehk alla 7%. [AJAKOHASTATUD 2023] Nõrk soovitus, madal tõendatuse aste |
| 30 |
|
Kroonilise neeruhaiguse ja diabeediga patsiendil arvestage ravi- eesmärkide seadmisel hüpoglükeemia suurema tekkeriskiga. [UUS 2023] Praktiline soovitus |
| 31 |
|
Kroonilise neeruhaiguse ja 2. tüüpi diabeediga patsiendil järgige ravi eesmärkväärtuste määramisel 2. tüüpi diabeedi ravijuhendi soovitusi. [UUS 2023] Praktiline soovitus |
Nii 2017. aastal koostatud algses ravijuhendis kui ka 2023. aastal ravijuhendi ajakohastamise käigus tugineti 29. soovituse koostamisel samadele suurtele juhuslikustatud kontrolluuringutele. Soovituste sisu seega ei muutunud, kuid ajakohastatava ravijuhendi koostamise metoodika pärast muutus nende tugevus. Tõendus põhineb peamiselt kolmel suuri juhuslikustatud kontrolluuringuid analüüsival süstemaatilisel ülevaatel (56–58). Kuna uuringud olid heterogeensed, nende eesmärk ei ühtinud täpselt töörühma püstitatud küsimusega ja uuringutesse olid kaasatud ka ilma KNH-ta patsiendid, on alljärgnevalt esitatud tõendus siinse ravijuhendi kontekstis kaudne. Seetõttu hinnati tõenduse kvaliteet madalaks.
Lisaks tuleb arvestada, et uuringutes peamise hinnatava parameetrina esitatud glükohemoglobiin (HbA1c) ei pruugi olla KNH ja diabeediga patsiendi puhul diabeediravi hindamiseks täpseim vahend. KNH-ga patsiendil on erütrotsüütide eluiga lühenenud ja seepärast glükohemoglobiini sisaldus tegelikkusest madalam. Samuti võivad nii rauaasendusravi kui ka erütropoetiinravi glükohemoglobiini väärtust vähendada. Tavapraktikas on seepärast tähtis iga päev glükoosi väärtusi hinnata. (1, 58–60)
Uuringutes näidati, et veresuhkru rangem kontroll (HbA1c eesmärkväärtus alla 7%) ei mõjutanud neerufunktsiooni langust (sh lõppstaadiumi neeruhaiguse kujunemist), kuid pidurdas albuminuuria teket ja süvenemist (56–58). Veresuhkru parem kontroll võib vähendada mittefataalse südameinfarkti tekkeriski, kuid mõju üld- ja kardiovaskulaarse suremuse vähenemisele ei leitud (56–58). Väga madala HbA1c eesmärgi korral (6% ja vähem) on näidatud üldsuremuse suuremat riski (55, 56).
KNH-ga patsientide puhul peab arvestama ka hüpoglükeemia suurema riskiga. Ühe metaanalüüsi alusel suurenes intensiivsemas ravirühmas raske kõrvalist abi vajava hüpoglükeemia tekkimise risk 2,5 korda (62).
Töörühm peab vajalikuks hinnata diabeediravis iga patsiendi individuaalseid riske ja leida parim ohutu ravieesmärk. Madalamatest veresuhkruväärtustest saavad enim kasu nooremad, kergema KNH, vähemate kaasnevate haiguste ja pikema oodatava elueaga patsiendid. Oluline on vältida hüpoglükeemiat.
2. tüüpi diabeedi ja KNH-ga patsientide ravis soovitab töörühm järgida Eesti
2. tüüpi diabeedi ravijuhendi soovitusi.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K11 ning ajakohastatava ravijuhendi kliinilise küsimuse nr 3 TõKo ja SoKo tabelit.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K11 ning ajakohastatava ravijuhendi kliinilise küsimuse nr 3 TõKo ja SoKo tabelit.
| 32 |
|
Kroonilise neeruhaigusega patsiendil hüperurikeemia käsitluses on vajalik puriinivaene dieet, eluviisi korrigeerimine, vajadusel diureetilise ravi vähendamine. [AJAKOHASTATUD 2023] Praktiline soovitus |
| 33 |
|
Kroonilise neeruhaigusega patsiendil kaaluge asümptomaatilise hüperurikeemia puhul ravi kusihappesisaldust alandavate ravi- mitega. [AJAKOHASTATUD 2023] Nõrk positiivne soovitus, madal tõendatuse aste |
2017. aastal koostatud algses ravijuhendis tugineti soovitusi andes järgnevale tõendusmaterjalile. Kolmes metaanalüüsis leiti tugev seos hüperurikeemia ja KNH esmashaigestumise vahel ja järeldati, et suurem kusihappesisaldus on KNH iseseisev riskitegur (63–65). Nelja süstemaatilise ülevaate tulemuste alusel seostub kusihappesisalduse vähendamine S,P-Crea madalama ja eGFR-i kõrgema väärtusega, stabiilsema neerufunktsiooni ning aeglasema KNH süvenemisega (66–69).
KNH-ga patsientidele kusihappesisaldust vähendava ravimi annustamist ja kõrvaltoimete riski on käsitletud ühes süstemaatilises ülevaates ja kahes süstemaatilises kirjanduse ülevaates. Kliinilised uuringud ei ole seoseid allopurinooli raskete kõrvaltoimete ja neerufunktsiooni vähenemise vahel üheselt kinnitanud. Kõrvaltoimed ilmnevad enam ravi alustamisel ja annuse liiga kiirel suurendamisel. Suurte säilitusannuste ja raskete ülitundlikkusreaktsioonide esinemissageduse vahel ei ole seost leitud. Näidustuse korral (nt podagra, neerukivitõbi, kusihappenefropaatia) soovitatakse hüperurikeemia ravi allopurinooliga alustada väikeses annuses. (69–71)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid KNH_EvSu_ K12; KNH_EvSu_K14_II.
KNH-ga patsientidele kusihappesisaldust vähendava ravimi annustamist ja kõrvaltoimete riski on käsitletud ühes süstemaatilises ülevaates ja kahes süstemaatilises kirjanduse ülevaates. Kliinilised uuringud ei ole seoseid allopurinooli raskete kõrvaltoimete ja neerufunktsiooni vähenemise vahel üheselt kinnitanud. Kõrvaltoimed ilmnevad enam ravi alustamisel ja annuse liiga kiirel suurendamisel. Suurte säilitusannuste ja raskete ülitundlikkusreaktsioonide esinemissageduse vahel ei ole seost leitud. Näidustuse korral (nt podagra, neerukivitõbi, kusihappenefropaatia) soovitatakse hüperurikeemia ravi allopurinooliga alustada väikeses annuses. (69–71)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid KNH_EvSu_ K12; KNH_EvSu_K14_II.
Ravijuhendi ajakohastamise käigus soovis töörühm teada saada, kas teha KNH-ga patsientide ravitulemuste parandamiseks sekundaarse hüperurikeemia ravi või mitte. Lisaks sooviti teada, kas febuksostaadil on võrreldes allopurinooliga eeliseid efektiivsuse ja ohutuse poolest.
Tõendus hüperurikeemia käsitlusest pärineb viiest metaanalüüsist, mis põhinevad juhuslikustatud (pimendatud) kontrolluuringutel. Metaanalüüsidesse kaasatud uuringutes leiti kusihappesisaldust vähendaval ravil soodne efekt kombineeritud neerusündmuste arvule (ingl composite renal events) ja eGFR-ile (71, 72). Hüperurikeemia ravi alandab vererõhku (73–75), kuid ei mõjuta üldsuremust ega suurte kardiovaskulaarsete sündmuste esinemist (71, 73, 74). Febuksostaadil pole olulisi eeliseid allopurinooli ees efektiivsuse ega ka ohutuse mõttes. Kaasatud metaanalüüsides ei märgita konkreetset kusihappesisaldust, millest alates peaks ravi alustama.
Töörühma arvates tuleks kusihappesisalduse korrigeerimiseks soovitada patsiendile esmalt eluviisimuudatusi ja piisavat vedelikutarbimist. Tähelepanu tuleb pöörata kusihappesisaldust suurendavate ravimite (nt tiasiiddiureetikumid) kasutamisele. Võimaluse korral võiks nende annust vähendada või asendada need ravimiga, mis kusihappesisaldust ei mõjuta. Nii leitud tõendusmaterjalile kui ka praktilisele kogemusele tuginedes leidis töörühm, et KNH-ga patsientidel võib asümptomaatilise hüperurikeemia korral pidurdada kusihappesisalduse vähendamine KNH süvenemist. Kuna sellekohane tõendus on madal ja puudub kindel kriteerium selle kohta, millisest kusihappe tasemest alates ravi määrata, otsustas töörühm anda nõrga soovituse.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 4 TõKo ja SoKo tabelit.
Tõendus hüperurikeemia käsitlusest pärineb viiest metaanalüüsist, mis põhinevad juhuslikustatud (pimendatud) kontrolluuringutel. Metaanalüüsidesse kaasatud uuringutes leiti kusihappesisaldust vähendaval ravil soodne efekt kombineeritud neerusündmuste arvule (ingl composite renal events) ja eGFR-ile (71, 72). Hüperurikeemia ravi alandab vererõhku (73–75), kuid ei mõjuta üldsuremust ega suurte kardiovaskulaarsete sündmuste esinemist (71, 73, 74). Febuksostaadil pole olulisi eeliseid allopurinooli ees efektiivsuse ega ka ohutuse mõttes. Kaasatud metaanalüüsides ei märgita konkreetset kusihappesisaldust, millest alates peaks ravi alustama.
Töörühma arvates tuleks kusihappesisalduse korrigeerimiseks soovitada patsiendile esmalt eluviisimuudatusi ja piisavat vedelikutarbimist. Tähelepanu tuleb pöörata kusihappesisaldust suurendavate ravimite (nt tiasiiddiureetikumid) kasutamisele. Võimaluse korral võiks nende annust vähendada või asendada need ravimiga, mis kusihappesisaldust ei mõjuta. Nii leitud tõendusmaterjalile kui ka praktilisele kogemusele tuginedes leidis töörühm, et KNH-ga patsientidel võib asümptomaatilise hüperurikeemia korral pidurdada kusihappesisalduse vähendamine KNH süvenemist. Kuna sellekohane tõendus on madal ja puudub kindel kriteerium selle kohta, millisest kusihappe tasemest alates ravi määrata, otsustas töörühm anda nõrga soovituse.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 4 TõKo ja SoKo tabelit.
| 34 |
|
Kroonilise neeruhaiguse tüsistuste õigeaegseks raviks on vajalik koostöö nefroloogiga. Tüsistuste teke sõltub kroonilise neeruhai- guse raskusastmest. Sagedasemad tüsistused on aneemia, kõrgenenud vererõhk, hüperkaleemia, hüperfosfateemia, hüpokaltseemia, sekundaarne hüperparatüreoos, metaboolne atsidoos, hüpoalbumineemia, kardiovaskulaarsed tüsistused. |
KNH tüsistuste teke (aneemia, sekundaarne hüperparatüreoos, metaboolne atsidoos jne) sõltub otseselt eGFR-i väärtusest ja albuminuuria või proteinuuria suurusest. Tähelepanu peaks pöörama tüsistuste ennetamisele, et vähendada suremust, KNH progresseerumist LSNH-ks ning teisi võimalikke kaasnevaid tüsistusi, samuti ravikulusid.
Süstemaatilises ülevaates (47 kohortuuringut) hinnati KNH-ga patsientide seerumi fosfaadi, parathormooni ja kaltsiumi väärtuste seost üldsuremuse, SVH suremuse ja surmaga mittelõppevate SVH-ga. Tulemuste alusel on selle patsientide rühma puhul seos seerumi fosfaadi kõrgenenud väärtuste ja üldsuremuse vahel. (76)
Ühes retrospektiivses kohortuuringus uuriti seerumi fosfaadi kontsentratsiooni seoseid veresoonte ja südameklappide kaltsifitseerumisega. Jõuti järeldusele, et fosfaadi suurem kontsentratsioon seerumis on mõõduka KNH-ga patsientidel seotud veresoonte ja südameklappide lubjastumisega. (77)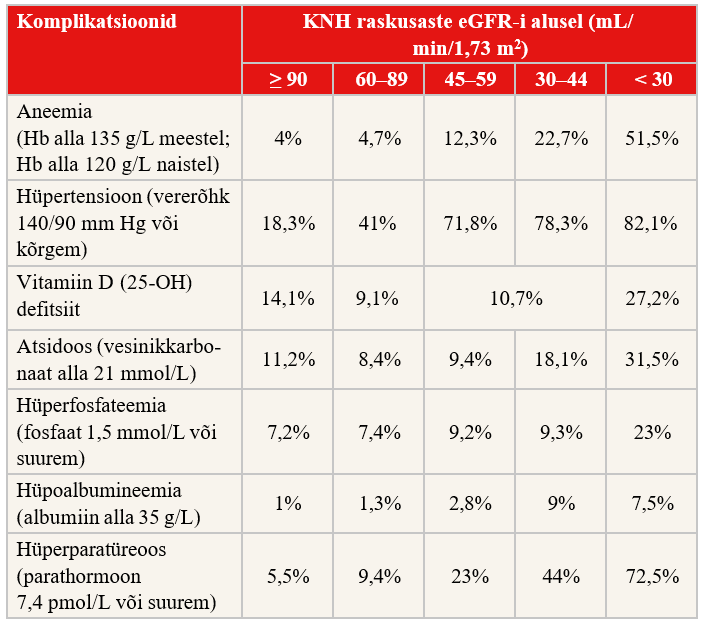
2017. aastal koostatud algses ravijuhendis tugineti soovitust andes järgnevale tõendusmaterjalile. Hemoglobiini (Hb) taseme määramise vajalikkuse ja sageduse kohta saadud andmed põhinevad kohortuuringul, milles hinnati aneemia levimust ja aneemia seost neerufunktsiooni vähenemisega. Leiti, et aneemia esinemissagedus oli KNH rühmas üldrahvastikuga võrreldes kaks korda suurem ning aneemia ja neerufunktsiooni taseme vahel oli negatiivne korrelatsioon. (79, 80)
Samu algandmeid analüüsinud teises uuringus järeldati, et suurem U-Alb/U-Crea on seotud aneemia esinemisega, sõltumata seejuures KNH raskusastmest. Ka madalama eGFR-i ja aneemia esinemissageduse kasvu vahel on seos. eGFR-i taseme ja aneemia vaheline statistiline seos on tugevam kui albuminuuria suuruse ja aneemia vaheline seos. (78)
Ravijuhendite soovituste alusel võib KNH-ga patsientidel aneemia diagnoosida, kui Hb sisaldus on meestel alla 130 g/L ja naistel alla 120 g/L (1, 81).
Renaalse aneemia jälgimiseks tuleb Hb kontsentratsiooni KNH raskusastmega G3–G5 patsientidel määrata vähemalt kord iga kolme kuu tagant (82).
Renaalne aneemia on keerulisem ja komplekssem protsess, mille põhjus ei ole ainult erütropoetiini defitsiit. Olulist rolli mängivad erütrotsüütide eluiga, raua staatus, B12-vitamiini ja folaadi tase. KNH ja aneemiaga patsientidel (sõltumata KNH raskusastmest) peab aneemia diagnoosimiseks määrama hemogrammi, retikulotsüütide arvu, seerumi ferritiini taseme, seerumi transferriini küllastatuse ning B12-vitamiini ja folaadi taseme. (1, 8, 81, 82)
Kui eGFR on 60 mL/min/1,73 m2 või suurem, on tõenäolisem, et aneemia põhjus ei ole KNH (83).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K16.
Ravijuhendi ajakohastamise käigus huvitas töörühma, kas on uut tõendusmaterjali selle kohta, milliseid markereid kasutada KNH aneemia diagnoosimiseks ja kui sageli KNH patsiente aneemia suhtes sõeluda.
Aneemia on sageli diagnoositav KNH tüsistus, mis mõjutab nii patsientide elukvaliteeti kui ka suurte kardiovaskulaarsete tüsistuste esinemist, hospi- taliseerimist, KNH progressiooni ja suremust (84). Aneemia levimus suureneb eGFR-i langusega. Kaasneva diabeedi korral tekib aneemia varem (85). Kui Hb on alla 100 g/l, suureneb üldsuremus, suurte kardiovaskulaarsete tüsistuste esinemine, hospitaliseerimise sagedus ja kiireneb KNH progresseerumine (84). Seetõttu on väga oluline diagnoosida renaalne aneemia õigel ajal ja rakendada spetsiifilist ravi. Alates 2017. aastast ei ole ilmunud uuringuid, milles käsitletaks aneemia diagnoosimiseks kasutatava Hb määramise sagedust KNH patsientidel. Piisava kvaliteediga tõendusmaterjali puudumise tõttu otsustas töörühm anda praktilise soovituse. Tugineti 2012. aasta KDIGO aneemia ravijuhendile, Euroopa Nefroloogide Seltsi 2017. aasta praktilisele ravijuhendile ja NICE-i uuendatud, 2021. aasta ravijuhendile (81, 84, 85). Aneemia varaseks avastamiseks tuleks Hb määrata vähemalt kord aastas KNH G3 staadiumi puhul ja vähemalt kaks korda aastas KNH G4–G5 staadiumis patsientidel (85). NICE-i uuendatud ravijuhendis soovitatakse mõelda aneemia põhjuse täpsustamisele ja ravile, kui Hb tase langeb alla 110 g/l või kui tekivad aneemiale iseloomulikud sümptomid (väsimus, õhupuudus, jõuetus ja südamepekslemine). Samuti soovitatakse iga kolme kuu tagant hinnata rauavarusid, määrates retikulotsüütide hemoglobiinisisalduse (RET-He, eesmärk rohkem kui 29 pg) või kombinatsioonis transferriini küllastus (rohkem kui 20%) ja ferritiin (rohkem kui 100 mcg/l). Samade analüüside põhjal saab hinnata ka vastust rauaasendusravile. Oluline on mitte määrata transferriini küllastust või ferritiini üksinda rauastaatuse täpsustamiseks KNH aneemia patsientidel, kuna kõrgenenud ferritiini tase ei välista KNH puhul rauapuudust (86). Transferriini lahustuvate retseptorite määramine rauastaatuse hindamiseks KNH-ga patsiendil ei ole piisavalt tõendatud (87). Samuti ei ole vaja KNH aneemia diagnoosimiseks rutiinselt määrata erütropoetiini taset (86).
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 8 TõKo ja SoKo tabelit.
Süstemaatilises ülevaates (47 kohortuuringut) hinnati KNH-ga patsientide seerumi fosfaadi, parathormooni ja kaltsiumi väärtuste seost üldsuremuse, SVH suremuse ja surmaga mittelõppevate SVH-ga. Tulemuste alusel on selle patsientide rühma puhul seos seerumi fosfaadi kõrgenenud väärtuste ja üldsuremuse vahel. (76)
Ühes retrospektiivses kohortuuringus uuriti seerumi fosfaadi kontsentratsiooni seoseid veresoonte ja südameklappide kaltsifitseerumisega. Jõuti järeldusele, et fosfaadi suurem kontsentratsioon seerumis on mõõduka KNH-ga patsientidel seotud veresoonte ja südameklappide lubjastumisega. (77)
Tabel 1. KNH komplikatsioonide esinemissagedus KNH raskusastme alusel (78,79)

Täiskasvanutel, kelle eGFR on alla 45 mL/min/1,73 m2 (KNH G3b–G5 raskusaste), soovitavad eksperdid KNH tüsistuste esinemise hindamiseks määrata verest kaltsiumi, fosfaadi, parathormooni ja aluselise fosfataasi väärtused. (1, 8, 14, 40, 41)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K13.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K13.
| 35 |
|
Kroonilise neeruhaigusega patsiendil määrake aneemia diagnoo- simiseks hemoglobiini kontsentratsioon järgmise sagedusega:
Praktiline soovitus |
| 36 |
|
Kroonilise neeruhaiguse ja aneemiaga patsiendil (sõltumata hai- guse raskusastmest) täpsustage aneemia põhjus ning määrake seejuures ferritiinisisaldus ja transferriini küllastatus veres. [UUS 2023] Praktiline soovitus |
2017. aastal koostatud algses ravijuhendis tugineti soovitust andes järgnevale tõendusmaterjalile. Hemoglobiini (Hb) taseme määramise vajalikkuse ja sageduse kohta saadud andmed põhinevad kohortuuringul, milles hinnati aneemia levimust ja aneemia seost neerufunktsiooni vähenemisega. Leiti, et aneemia esinemissagedus oli KNH rühmas üldrahvastikuga võrreldes kaks korda suurem ning aneemia ja neerufunktsiooni taseme vahel oli negatiivne korrelatsioon. (79, 80)
Samu algandmeid analüüsinud teises uuringus järeldati, et suurem U-Alb/U-Crea on seotud aneemia esinemisega, sõltumata seejuures KNH raskusastmest. Ka madalama eGFR-i ja aneemia esinemissageduse kasvu vahel on seos. eGFR-i taseme ja aneemia vaheline statistiline seos on tugevam kui albuminuuria suuruse ja aneemia vaheline seos. (78)
Ravijuhendite soovituste alusel võib KNH-ga patsientidel aneemia diagnoosida, kui Hb sisaldus on meestel alla 130 g/L ja naistel alla 120 g/L (1, 81).
Renaalse aneemia jälgimiseks tuleb Hb kontsentratsiooni KNH raskusastmega G3–G5 patsientidel määrata vähemalt kord iga kolme kuu tagant (82).
Renaalne aneemia on keerulisem ja komplekssem protsess, mille põhjus ei ole ainult erütropoetiini defitsiit. Olulist rolli mängivad erütrotsüütide eluiga, raua staatus, B12-vitamiini ja folaadi tase. KNH ja aneemiaga patsientidel (sõltumata KNH raskusastmest) peab aneemia diagnoosimiseks määrama hemogrammi, retikulotsüütide arvu, seerumi ferritiini taseme, seerumi transferriini küllastatuse ning B12-vitamiini ja folaadi taseme. (1, 8, 81, 82)
Kui eGFR on 60 mL/min/1,73 m2 või suurem, on tõenäolisem, et aneemia põhjus ei ole KNH (83).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K16.
Ravijuhendi ajakohastamise käigus huvitas töörühma, kas on uut tõendusmaterjali selle kohta, milliseid markereid kasutada KNH aneemia diagnoosimiseks ja kui sageli KNH patsiente aneemia suhtes sõeluda.
Aneemia on sageli diagnoositav KNH tüsistus, mis mõjutab nii patsientide elukvaliteeti kui ka suurte kardiovaskulaarsete tüsistuste esinemist, hospi- taliseerimist, KNH progressiooni ja suremust (84). Aneemia levimus suureneb eGFR-i langusega. Kaasneva diabeedi korral tekib aneemia varem (85). Kui Hb on alla 100 g/l, suureneb üldsuremus, suurte kardiovaskulaarsete tüsistuste esinemine, hospitaliseerimise sagedus ja kiireneb KNH progresseerumine (84). Seetõttu on väga oluline diagnoosida renaalne aneemia õigel ajal ja rakendada spetsiifilist ravi. Alates 2017. aastast ei ole ilmunud uuringuid, milles käsitletaks aneemia diagnoosimiseks kasutatava Hb määramise sagedust KNH patsientidel. Piisava kvaliteediga tõendusmaterjali puudumise tõttu otsustas töörühm anda praktilise soovituse. Tugineti 2012. aasta KDIGO aneemia ravijuhendile, Euroopa Nefroloogide Seltsi 2017. aasta praktilisele ravijuhendile ja NICE-i uuendatud, 2021. aasta ravijuhendile (81, 84, 85). Aneemia varaseks avastamiseks tuleks Hb määrata vähemalt kord aastas KNH G3 staadiumi puhul ja vähemalt kaks korda aastas KNH G4–G5 staadiumis patsientidel (85). NICE-i uuendatud ravijuhendis soovitatakse mõelda aneemia põhjuse täpsustamisele ja ravile, kui Hb tase langeb alla 110 g/l või kui tekivad aneemiale iseloomulikud sümptomid (väsimus, õhupuudus, jõuetus ja südamepekslemine). Samuti soovitatakse iga kolme kuu tagant hinnata rauavarusid, määrates retikulotsüütide hemoglobiinisisalduse (RET-He, eesmärk rohkem kui 29 pg) või kombinatsioonis transferriini küllastus (rohkem kui 20%) ja ferritiin (rohkem kui 100 mcg/l). Samade analüüside põhjal saab hinnata ka vastust rauaasendusravile. Oluline on mitte määrata transferriini küllastust või ferritiini üksinda rauastaatuse täpsustamiseks KNH aneemia patsientidel, kuna kõrgenenud ferritiini tase ei välista KNH puhul rauapuudust (86). Transferriini lahustuvate retseptorite määramine rauastaatuse hindamiseks KNH-ga patsiendil ei ole piisavalt tõendatud (87). Samuti ei ole vaja KNH aneemia diagnoosimiseks rutiinselt määrata erütropoetiini taset (86).
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 8 TõKo ja SoKo tabelit.
Krooniline neeruhaigus ja ravimid
Kroonilise neeruhaiguse progressiooni aeglustavad ravimid
| 37 |
|
Kroonilise neeruhaigusega patsiendil, kel esineb väljendunud albuminuuria (albumiini ja kreatiniini suhe uriinis üle 30 mg/ mmol, A3), kasutage vastunäidustuste puudumisel kroonilise neeruhaiguse progresseerumise aeglustamiseks reniini-angio- tensiini-aldosterooni süsteemi (RAAS) antagoniste. |
| 38 |
|
Diabeetilise nefropaatiaga kroonilise neeruhaigusega patsiendil, kel esineb albuminuuria (albumiini ja kreatiniini suhe uriinis üle 3 mg/mmol, A2), kasutage sõltumata kõrgvererõhktõve ole- masolust vastunäidustuste puudumisel kroonilise neeruhaiguse progresseerumise aeglustamiseks RAAS-i antagoniste. |
| 39 |
|
Kui kroonilise neeruhaigusega patsiendil alaneb pärast RAAS-i antagonistiga ravi alustamist eGFR rohkem kui 25% algväärtu- sest, on soovitatav välistada teised neerufunktsiooni vähenemise põhjused (hüpovoleemia, südamepuudulikkus, nefrotoksilised ravimid jt põhjused), vähendada RAAS-i antagonistide annust ja kontrollida kahe nädala jooksul uuesti neerufunktsiooni. |
| 40 |
|
Kui kroonilise neeruhaiguse korral alustatakse ravi RAAS-i anta- gonistidega ja/või mineralokortikoidretseptori antagonistidega, jälgige vere kaaliumisisaldust. Väljendunud hüperkaleemia tek- kimisel (kaalium üle 6 mmol/L) lõpetage ajutiselt ravimi kasuta- mine, välistage teised hüperkaleemia põhjused ja konsulteerige nefroloogiga. [AJAKOHASTATUD 2023] |
| 41 | |
Hoiduge kroonilise neeruhaigusega patsientide puhul AKEI ja ARB-i kombinatsioonravist. |
| 42 |
|
Kroonilise neeruhaigusega patsiendil kasutage kroonilise neeru- haiguse progresseerumise aeglustamiseks SGLT-2 inhibiitorit. [UUS 2023] Tugev soovitus, kõrge tõendatuse aste |
| 43 |
|
Kroonilise neeruhaiguse ja 2. tüüpi diabeediga patsiendil kaaluge lisaks standardravile kroonilise neeruhaiguse progresseerumise aeglustamiseks mittesteroidsete mineralokortikoidide retseptorite antagonistide kasutamist. [UUS 2023] Tugev soovitus, kõrge tõendatuse aste |
2017. aastal koostatud algses ravijuhendis tugineti soovitusi andes järgnevale tõendusmaterjalile. Kahes süstemaatilises ülevaates ja ühes metaanalüüsis leiti, et KNH ja/või diabeediga patsientidel, kelle raviskeemis oli angiotensiini konverteeriva ensüümi inhibiitor (AKEI) või angiotensiin I retseptorite blokaator (ARB), oli S,P-Crea kahekordistumise risk teiste vererõhuravimite rühmadega võrreldes oluliselt väiksem. Samuti täheldati AKEI ja ARB-i rühmas albuminuuria ja proteinuuria vähenemist. (88–90)
Süstemaatilises ülevaates järeldati, et RAAS-i antagonistide renoprotektiivne toime ei ole seotud ainult antihüpertensiivse efektiga, kuna eri uuringurühmades oli antihüpertensiivsete preparaatide mõju vererõhule võrdne (88).
Süstemaatilises ülevaates RAAS-i antagonistide toime ja kõrvalmõju kohta KNH-ga patsientidele toodi esile 39 uuringu tulemused, kus leiti, et AKEI või ARB-i monoteraapia suurendab hüperkaleemia riski, kusjuures risk hüper- kaleemiaks suureneb neerufunktsiooni vähenemise puhul (91).
Juhuslikustatud kontrolluuringu tulemustest selgus, et kombineeritud teraapia AKEI ja ARB-iga oli vaatamata proteinuuria vähenemisele ateroskleroosi ja diabeediga KNH-ga patsientidel seotud halvema prognoosiga (neerufunktsiooni vähenemine, dialüüsravi alustamine, surm) (92). Töörühma hinnangul ei saa tõendusmaterjali põhjal soovitada AKEI ja ARB-i kombinatsioonravi.
Kolmes süstemaatilises ülevaates käsitleti mineralokortikoidide retseptorite antagonistide (MRA) kasutamist KNH-ga patsientidel. Diabeetilise nefropaatiaga patsientide puhul leiti, et müokardi perfusioon paranes selektiivse MRA kasutajate rühmas enam kui tiasiiddiureetikumravi rühmas. Kolmes süstemaatilisse ülevaatesse kaasatud juhuslikustatud uuringus leiti MRA soodne mõju natriureetilise peptiidi tasemele. MRA lisamine AKEI-le või ARB-ile vähendas proteinuuriat, langetas süstoolset ja diastoolset vererõhku, kuid samas suurenes hüperkaleemia tekkerisk. (93–95)
Ravi alustamist RAAS-i antagonisti väiksemate annustega tuleks kaaluda juhul, kui eGFR on alla 45 mL/min/1,73 m2, samuti vanematel patsientidel ning kui raviskeemis on teisi seerumi kaaliumisisaldust suurendavaid ravimeid (nt MRA-d) (3, 13). Kaaliumisisaldust ja eGFR-i tuleks kontrollida enne ravi alustamist ning 1–2 nädalat pärast ravi algust või annuse suurendamist. Kui kahe kuu jooksul pärast RAAS-i antagonistidega ravi alustamist tõuseb S,P-Crea püsivalt üle 30%, eGFR alaneb üle 25% algväärtusest või kaaliumi tase on kõrgem kui 5,6 mmol/L ning teised neerufunktsiooni vähenemise ja hüperkaleemia põhjused on välistatud, peab annust vähendama või ravi lõpetama ning suunama patsiendi nefroloogi konsultatsioonile. (8, 14)
RAAS-i antagonistide annust pole vaja muuta, kui eGFR-i alanemine vähem kui 25% ja S,P-Crea tõuseb vähem kui 30% algväärtusest. Üldjuhul pole vaja ravi AKEI või ARB-iga lõpetada, kui eGFR-i väärtus on alla 30 mL/min/1,73 m2, kuna preparaatidel on renoprotektiivne toime. (1, 8, 14)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid KNH_EvSu_ K14_I ja KNH_ EvSu_K14_lisa_ AKEARB.
Ravijuhendi ajakohastamise käigus soovis töörühm teada saada, kas AKEI-le või ARB-ile kui standardravile SGLT-2 inhibiitori ja/või MRA lisamine parandab kroonilise neeruhaigusega patsiendi tulemusnäitajaid.
Kahe metaanalüüsi (95, 96) ja ühe juhuslikustatud kontrolluuringu (98) alusel vähendab SGLT-2 inhibiitorite kasutamine KNH progresseerumise ja ägeda neerukahjustuse tekkeriski mitte ainult suure kardiovaskulaarse riskiga 2. tüüpi diabeediga haigetel, vaid ka KNH või südamepuudulikkusega patsientidel sõltumata diabeedi staatusest, KNH algpõhjusest või neerufunktsioonist. SGLT-2 inhibiitorite kasutamine vähendab kardiovaskulaarset suremust ja hospitaliseerimisi südamepuudulikkuse süvenemise tõttu. KNH-ga patsientide seas SGLT-2 inhibiitorite kasutamine üldsuremusele mõju ei avalda. SGLT-2 inhibiitorite kasutamisel KNH-ga patsientidel pole esinenud tõsiseid kõrvaltoimeid, kuid esineb oluliselt rohkem urogenitaaltrakti infektsioone. (96–98)
Cochrane’i metaanalüüs (99) sisaldas süstemaatiliselt korrastatult 44 juhus- likustatud kontrolluuringut, milles võrreldi steroidsete MRA-de (spironolaktoon, eplerenoon) ja mittesteroidsete MRAde (finerenoon) kasutamist kroonilise neeruhaiguse ning proteinuuriaga patsientidel, kes said standardravi AKEI või ARB-iga. Võrreldes standardraviga vähendab nii steroidsete (100–102) kui ka mittesteroidsete MRA-de (103) kasutamine koos RAAS-i inhibiitoriga proteinuuriat, mis on kroonilise neeruhaiguse riskitegur.
Sarnane tulemus saadi seitsmest juhuslikustatud kontrolluuringust koosnevas metaanalüüsis (104), milles võrreldi mitteselektiivse (spironolaktoon) ja selektiivse MRA (eplerenoon) kasutamist standardraviga patsiendil. Märgiti ka väiksema hüperkaleemia riski selektiivse MRA kasutamisel.
2. tüüpi diabeedi ja KNH-ga patsientide seas tehtud juhuslikustatud kont- rolluuringud (105–107) näitasid, et finerenooni lisamine standardravile (RAASi inhibiitor üksi või kombinatsioonis SGLT-2 inhibiitoriga) vähendab kroonilise neeruhaiguse süvenemist (eGFR alla 15 mL/min/1,73 m2) ning albuminuuriat. Samuti vähenes kombinatsioonravi saavatel patsientidel kardiovaskulaarsete tüsistuste (kardiovaskulaarne surm, müokardinfarkt, insult) risk.
KDIGO 2022. aasta ravijuhendis (108) soovitatakse samuti eespool toodud uuringutele toetudes kasutada diabeedipatsientidel mittesteroidset mineral- okortikoidi retseptori antagonisti (finerenooni). Steroidne MRA (spironolaktoon, eplerenoon) soovitatakse lisada raviskeemi kroonilise südamepuudulikkuse, hüperaldosteronismi ja refraktaarse hüpertensiooni puhul, kuid võrreldes mittesteroidsete MRA-dega on neid kasutades suurem risk hüperkaleemia või günekomastia tekkeks.
Töörühm otsustas anda soovituse, sest mittesteroidse MRA lisamise korral standardravile on soovitud mõju (albuminuuria vähenemine, neerufunktsiooni halvenemise aeglustamine, optimaalse vererõhuväärtuse saavutamine) ülekaalus. Soovimatu mõjuna võimalik hüperkaleemia teke on jälgitav ja vajaduse korral saab kasutada kaaliumisidujaid, lingudiureetikume, vähendada MRA annust või lõpetada ravimi kasutamine. Kuna praegu ei ole ravim Eestis veel kättesaadav, otsustati vormistada nõrk soovitus.
RAAS-i antagonistide annust pole vaja muuta, kui eGFR-i alanemine vähem kui 25% ja S,P-Crea tõuseb vähem kui 30% algväärtusest. Üldjuhul pole vaja ravi AKEI või ARB-iga lõpetada, kui eGFR-i väärtus on alla 30 mL/min/1,73 m2, kuna preparaatidel on renoprotektiivne toime. (1, 8, 14)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid KNH_EvSu_ K14_I ja KNH_ EvSu_K14_lisa_ AKEARB.
Ravijuhendi ajakohastamise käigus soovis töörühm teada saada, kas AKEI-le või ARB-ile kui standardravile SGLT-2 inhibiitori ja/või MRA lisamine parandab kroonilise neeruhaigusega patsiendi tulemusnäitajaid.
Kahe metaanalüüsi (95, 96) ja ühe juhuslikustatud kontrolluuringu (98) alusel vähendab SGLT-2 inhibiitorite kasutamine KNH progresseerumise ja ägeda neerukahjustuse tekkeriski mitte ainult suure kardiovaskulaarse riskiga 2. tüüpi diabeediga haigetel, vaid ka KNH või südamepuudulikkusega patsientidel sõltumata diabeedi staatusest, KNH algpõhjusest või neerufunktsioonist. SGLT-2 inhibiitorite kasutamine vähendab kardiovaskulaarset suremust ja hospitaliseerimisi südamepuudulikkuse süvenemise tõttu. KNH-ga patsientide seas SGLT-2 inhibiitorite kasutamine üldsuremusele mõju ei avalda. SGLT-2 inhibiitorite kasutamisel KNH-ga patsientidel pole esinenud tõsiseid kõrvaltoimeid, kuid esineb oluliselt rohkem urogenitaaltrakti infektsioone. (96–98)
Cochrane’i metaanalüüs (99) sisaldas süstemaatiliselt korrastatult 44 juhus- likustatud kontrolluuringut, milles võrreldi steroidsete MRA-de (spironolaktoon, eplerenoon) ja mittesteroidsete MRAde (finerenoon) kasutamist kroonilise neeruhaiguse ning proteinuuriaga patsientidel, kes said standardravi AKEI või ARB-iga. Võrreldes standardraviga vähendab nii steroidsete (100–102) kui ka mittesteroidsete MRA-de (103) kasutamine koos RAAS-i inhibiitoriga proteinuuriat, mis on kroonilise neeruhaiguse riskitegur.
Sarnane tulemus saadi seitsmest juhuslikustatud kontrolluuringust koosnevas metaanalüüsis (104), milles võrreldi mitteselektiivse (spironolaktoon) ja selektiivse MRA (eplerenoon) kasutamist standardraviga patsiendil. Märgiti ka väiksema hüperkaleemia riski selektiivse MRA kasutamisel.
2. tüüpi diabeedi ja KNH-ga patsientide seas tehtud juhuslikustatud kont- rolluuringud (105–107) näitasid, et finerenooni lisamine standardravile (RAASi inhibiitor üksi või kombinatsioonis SGLT-2 inhibiitoriga) vähendab kroonilise neeruhaiguse süvenemist (eGFR alla 15 mL/min/1,73 m2) ning albuminuuriat. Samuti vähenes kombinatsioonravi saavatel patsientidel kardiovaskulaarsete tüsistuste (kardiovaskulaarne surm, müokardinfarkt, insult) risk.
KDIGO 2022. aasta ravijuhendis (108) soovitatakse samuti eespool toodud uuringutele toetudes kasutada diabeedipatsientidel mittesteroidset mineral- okortikoidi retseptori antagonisti (finerenooni). Steroidne MRA (spironolaktoon, eplerenoon) soovitatakse lisada raviskeemi kroonilise südamepuudulikkuse, hüperaldosteronismi ja refraktaarse hüpertensiooni puhul, kuid võrreldes mittesteroidsete MRA-dega on neid kasutades suurem risk hüperkaleemia või günekomastia tekkeks.
Töörühm otsustas anda soovituse, sest mittesteroidse MRA lisamise korral standardravile on soovitud mõju (albuminuuria vähenemine, neerufunktsiooni halvenemise aeglustamine, optimaalse vererõhuväärtuse saavutamine) ülekaalus. Soovimatu mõjuna võimalik hüperkaleemia teke on jälgitav ja vajaduse korral saab kasutada kaaliumisidujaid, lingudiureetikume, vähendada MRA annust või lõpetada ravimi kasutamine. Kuna praegu ei ole ravim Eestis veel kättesaadav, otsustati vormistada nõrk soovitus.
Rakenduspiirang
Ravijuhendi koostamise ajal ei olnud mittesteroidne MRA (finerenoon) Eestis veel kättesaadav, aga läbirääkimised ravimitootjaga olid lõpusirgel. Seetõttu otsustati vormistada nõrk soovitus. Kui ravim on lisatud soodusravimite loetellu, muudetakse soovitus tugevaks, sest teadusliku tõendusmaterjali põhjal on selleks piisavalt alust.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 7 TõKo ja SoKo tabelit.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 7 TõKo ja SoKo tabelit.
Statiinid
| 44 |
|
Kroonilise neeruhaiguse ja düslipideemiaga patsiendil kasutage südame-veresoonkonnahaiguste primaarses ja sekundaarses en- netuses statiinravi. [AJAKOHASTATUD 2023] Tugev soovitus, mõõdukas tõendatuse aste |
| 45 |
|
Kroonilise neeruhaigusega patsiendil kasutage statiinravi koos esetimiibiga, kui statiinravi monoteraapiaga ei ole võimalik saavutada LDL-kolesterooli sihtväärtust. [UUS 2023] Tugev soovitus, mõõdukas tõendatuse aste |
2017. aastal koostatud algses ravijuhendis tugineti soovitust andes järgnevale tõendusmaterjalile. Kõrge ja mõõduka kvaliteediga süstemaatilised ülevaated statiinravi mõju ja kõrvaltoimete kohta KNH-ga patsientidel kinnitavad statiinide soodsat mõju SVH ennetuses. Statiinravi vähendab KNH-ga patsientide üld- ja kardiovaskulaarset suremust, müokardiinfarktide esinemist ja muid tõsiseid kardiovaskulaarseid sündmusi (109–113). Uuringute tulemused statiinide mõju kohta insultide ennetamisel ei ole ühesed: kolmes uuringus on märgitud insultide vähenemine (110, 111, 113); kahes uuringus, sealhulgas Cochrane’i süstemaatilises ülevaates, ei nähta platseeboga võrreldes märkimisväärset erinevust (109, 112).
Ravijuhendid käsitlevad KNH-d kui olulist SVH riskitegurit. Risk suureneb võrdeliselt neerufunktsiooni vähenemisega, olles suurim lõppstaadiumi neeruhaigusega patsientidel. (1, 8, 12–14, 114–116)
Kohortuuringule tuginedes märgib KDIGO töörühm, et risk on suurim üle 50-aastaste KNH-ga patsientide seas. Selles patsientide rühmas on risk saada müokardiinfarkt või surra koronaarhaiguse tõttu ligilähedane varem müokardiinfarkti põdenud haigetega. (116)
Kolmes ravijuhendis esitatud hea kvaliteediga uuringute tulemuste põhjal sõnastatud soovituste alusel vähendab statiinravi KNH-ga patsientidel üld- ja kardiovaskulaarset suremust ning raskeid kardiovaskulaarseid sündmusi (müokardiinfarkt, ajuinfarkt, koronaararterite revaskulariseerimine) (12, 14, 115). NICE-i kardiovaskulaarse riski hindamise ja ennetamise juhendi raames tehtud süstemaatilise ülevaate alusel vähendavad statiinid KNH-ga patsientidel mitteletaalsete müokardiinfarktide ja ajuinsultide esinemist (mõõdukas tõenduse kvaliteet) (117).
Ravijuhendi töörühm leidis, et kuna KNH-ga patsientide SVH risk on suurem kui tavaelanikkonnal ja statiinravi on neil patsientidel näidanud soodsat mõju kardiovaskulaarsete sündmuste ning suremuse vähendamisel, on tähtis kaaluda statiinravi alustamist kõigil KNH-ga patsientidel. Kindlasti on vaja statiinravi alustada kõigil üle 50-aastastel KNH-ga patsientidel, kelle eGFR on alla 60 mL/ min/1,73 m2.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_ EvSu_K14_ statiinid.
Ravijuhendi ajakohastamise käigus soovis töörühm teada saada, kas KNH- ga patsientide düslipideemia ravis on lisaks statiinidele võimalik lipiidiprofiili parandamiseks kasutada teisi medikamentoosseid meetmeid: esetimiibi, subtilisiini- ja keksiinisarnase proproteiini konvertaasi 9 (PCSK9) inhibiitorit, fibraate või oomega3rasvhappeid.
Metaanalüüsid (117, 118) ja juhuslikustatud kontrolluuring (120) kinnitavad, et LDL-kolesterooli vähendamine kroonilise neeruhaigusega patsiendil vähendab nende kardiovaskulaarseid riske. Juhuslikustatud kontrolluuringus (121) hinnati statiin- ja esetimiibravi toimet muu hulgas ka KNH-ga patsientidel (eGFR alla 60 mL/min/1,73 m2 ja alla 45 mL/min/1,73 m2). Kombinatsioonravil olevatel KNH-ga patsientidel, kelle eGFR oli alla 60 mL/min/1,73 m2, vähenes kardiovaskulaarse suremuse suhteline risk võrreldes monoteraapia rühmaga 12%.
Ravijuhendi töörühm leidis, et statiinravi või statiini ja esetimiibi kombinatsiooni kasutamine on tõendusmaterjali põhjal soodne ning parandab võrreldes mittesekkumisega tulemusnäitajaid. Statiinravi saavatel patsientidel, kes ei saavuta soovitud ravieesmärki monoteraapiaga või kellel on kõrvaltoimed, on esetimiibi lisamine põhjendatud. Intensiivsel statiinravil ei ole eeliseid võrreldes väiksemas annuses manustatud statiini ja esetimiibi kombinatsiooniga. Statiini kombinatsioonravi kohta PCSK9 inhibiitori, fibraadi või oomega3 rasvhapetega KNH-ga patsientide seas puudub piisavalt kvaliteetne ühesuunaline tõendusmaterjal, mistõttu otsustas töörühm selle kohta soovitust mitte sõnastada.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 6 ToKo ja SoKo tabelit.
Ravijuhendid käsitlevad KNH-d kui olulist SVH riskitegurit. Risk suureneb võrdeliselt neerufunktsiooni vähenemisega, olles suurim lõppstaadiumi neeruhaigusega patsientidel. (1, 8, 12–14, 114–116)
Kohortuuringule tuginedes märgib KDIGO töörühm, et risk on suurim üle 50-aastaste KNH-ga patsientide seas. Selles patsientide rühmas on risk saada müokardiinfarkt või surra koronaarhaiguse tõttu ligilähedane varem müokardiinfarkti põdenud haigetega. (116)
Kolmes ravijuhendis esitatud hea kvaliteediga uuringute tulemuste põhjal sõnastatud soovituste alusel vähendab statiinravi KNH-ga patsientidel üld- ja kardiovaskulaarset suremust ning raskeid kardiovaskulaarseid sündmusi (müokardiinfarkt, ajuinfarkt, koronaararterite revaskulariseerimine) (12, 14, 115). NICE-i kardiovaskulaarse riski hindamise ja ennetamise juhendi raames tehtud süstemaatilise ülevaate alusel vähendavad statiinid KNH-ga patsientidel mitteletaalsete müokardiinfarktide ja ajuinsultide esinemist (mõõdukas tõenduse kvaliteet) (117).
Ravijuhendi töörühm leidis, et kuna KNH-ga patsientide SVH risk on suurem kui tavaelanikkonnal ja statiinravi on neil patsientidel näidanud soodsat mõju kardiovaskulaarsete sündmuste ning suremuse vähendamisel, on tähtis kaaluda statiinravi alustamist kõigil KNH-ga patsientidel. Kindlasti on vaja statiinravi alustada kõigil üle 50-aastastel KNH-ga patsientidel, kelle eGFR on alla 60 mL/ min/1,73 m2.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_ EvSu_K14_ statiinid.
Ravijuhendi ajakohastamise käigus soovis töörühm teada saada, kas KNH- ga patsientide düslipideemia ravis on lisaks statiinidele võimalik lipiidiprofiili parandamiseks kasutada teisi medikamentoosseid meetmeid: esetimiibi, subtilisiini- ja keksiinisarnase proproteiini konvertaasi 9 (PCSK9) inhibiitorit, fibraate või oomega3rasvhappeid.
Metaanalüüsid (117, 118) ja juhuslikustatud kontrolluuring (120) kinnitavad, et LDL-kolesterooli vähendamine kroonilise neeruhaigusega patsiendil vähendab nende kardiovaskulaarseid riske. Juhuslikustatud kontrolluuringus (121) hinnati statiin- ja esetimiibravi toimet muu hulgas ka KNH-ga patsientidel (eGFR alla 60 mL/min/1,73 m2 ja alla 45 mL/min/1,73 m2). Kombinatsioonravil olevatel KNH-ga patsientidel, kelle eGFR oli alla 60 mL/min/1,73 m2, vähenes kardiovaskulaarse suremuse suhteline risk võrreldes monoteraapia rühmaga 12%.
Ravijuhendi töörühm leidis, et statiinravi või statiini ja esetimiibi kombinatsiooni kasutamine on tõendusmaterjali põhjal soodne ning parandab võrreldes mittesekkumisega tulemusnäitajaid. Statiinravi saavatel patsientidel, kes ei saavuta soovitud ravieesmärki monoteraapiaga või kellel on kõrvaltoimed, on esetimiibi lisamine põhjendatud. Intensiivsel statiinravil ei ole eeliseid võrreldes väiksemas annuses manustatud statiini ja esetimiibi kombinatsiooniga. Statiini kombinatsioonravi kohta PCSK9 inhibiitori, fibraadi või oomega3 rasvhapetega KNH-ga patsientide seas puudub piisavalt kvaliteetne ühesuunaline tõendusmaterjal, mistõttu otsustas töörühm selle kohta soovitust mitte sõnastada.
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 6 ToKo ja SoKo tabelit.
Metformiin
| 46 |
|
Kroonilise neeruhaigusega patsiendi puhul arvestage metformiini kasutamisel ja annustamisel neerufunktsiooniga:
|
Metformiin on esmavalik 2. tüüpi diabeedi ravis. Lisaks kolesteroolisisalduse vähendamisele ja glükeemilisele kontrollile vähendab see diabeediga patsientidel SVH tekkimise riski ja üldist suremust (122). Diabeetilise nefropaatiaga pat- sientidel on metformiini kasutamine seotud laktatsidoosi suurema tekkeriskiga, mistõttu soovitatakse neerufunktsiooni vähenemise puhul metformiini annust vähendada või ravi lõpetada (2).
Kolmes süstemaatilises ülevaates, milles käsitleti metformiini toimet ja kõrvaltoimeid KNH-ga patsientidele, analüüsiti metaanalüüside, võrdlus-, vaatlus- ning juhtkontrolluuringute tulemusi. Süstemaatiliste ülevaadete tulemuste põhjal järeldati, et G1–G2 raskusastmega KNH puhul (eGFR suurem või võrdne 60 mL/ min/1,73 m2) ei suurenda metformiini kasutamine laktatsidoosi tekkimise riski. G3b raskusastmega KNH puhul (eGFR 30–44 mL/min/1,73 m2) soovitatakse metformiini annust vähendada ja G4–G5 raskusastme korral (eGFR alla 30 mL/ min/1,73 m2) ravi lõpetada. (122–124)
Samad soovitused annustamise vähendamise kohta antakse ka rahvusvahelistes ravijuhendites (1, 124).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K14_I.
Kolmes süstemaatilises ülevaates, milles käsitleti metformiini toimet ja kõrvaltoimeid KNH-ga patsientidele, analüüsiti metaanalüüside, võrdlus-, vaatlus- ning juhtkontrolluuringute tulemusi. Süstemaatiliste ülevaadete tulemuste põhjal järeldati, et G1–G2 raskusastmega KNH puhul (eGFR suurem või võrdne 60 mL/ min/1,73 m2) ei suurenda metformiini kasutamine laktatsidoosi tekkimise riski. G3b raskusastmega KNH puhul (eGFR 30–44 mL/min/1,73 m2) soovitatakse metformiini annust vähendada ja G4–G5 raskusastme korral (eGFR alla 30 mL/ min/1,73 m2) ravi lõpetada. (122–124)
Samad soovitused annustamise vähendamise kohta antakse ka rahvusvahelistes ravijuhendites (1, 124).
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K14_I.
Antiagregandid
| 47 |
|
Kui kasutate kroonilise neeruhaigusega patsiendil südame- veresoonkonnahaiguste primaarseks ennetuseks antiagregantravi, kaaluge võimaliku kardiovaskulaarse kasu ja veritsuse riski suhet. |
KNH-ga patsientidel on risk haigestuda SVH-sse märkimisväärselt suurem kui üldrahvastikul. KNH-ga patsientidel on prognoos pärast SVH sündmust oluliselt tõsisem, vaatamata optimaalsele ravile (126–128). Aspiriini kasutamise ja kõrvalmõju kohta KNH-ga patsientide seas ajakohaseid süstemaatilisi ülevaateid ega metaanalüüse ei leitud. Uuringute tulemused, mis käsitlevad KNH-ga patsientide puhul antiagregantravi kasutamist SVH primaarseks ennetamiseks, on vastuolulised.
Juhuslikustatud kontrolluuringu andmete post hoc-analüüsi tulemustest selgus, et aspiriinil oli soodne mõju SVH ennetamisele KNH (eGFR alla 45 mL/min/1,73 m2) ja kõrgvererõhktõvega patsientidel. Verejooksu risk oli aspiriini tarvitajatel suurem, kuid kasu ületas siiski riski. Uuringus osalenud G4–G5 raskusastmes KNH-ga patsientide (eGFR alla 30 mL/min/1,73 m2) väikese arvu tõttu ei olnud võimalik selle patsiendirühma tulemusi analüüsida. (126)
Retrospektiivses uuringus analüüsiti aspiriini mõju SVH tekkele KNH-ga patsientidel. Leiti, et aspiriini tarvitajate rühmas oli SVH-sse haigestumise ja neerupuudulikkusesse suremise risk märgatavalt suurem, samuti oli sagedasem S,P-Crea taseme kahekordistumine. Verejooksu oht oli mõlemas rühmas võrreldav. (127)
Ülevaateartiklis kirjeldatud mitme metaanalüüsi, juhuslikustatud kontrolluuringu ja vaatlusuuringu tulemustest selgus, et aspiriini tarvitajatel oli verejooksu risk suurem, samas olid tulemused aspiriini SVH-d ennetava toime kohta KNH-ga patsientidel vasturääkivad. Artiklis toodi esile kahe juhuslikustatud kontrolluuringu tulemused, mis pole tõestanud väikese annuse aspiriini kasutamise positiivset toimet SVH progresseerumisele diabeedihaigetel. (128)
KDIGO ravijuhendis soovitatakse SVH primaarseks ennetamiseks anti- agregantravi, kuid hoiatatakse verejooksu riski eest (2). Ameerika Südame- assotsiatsiooni ravijuhendis soovitatakse SVH primaarseks ennetamiseks kasutada aspiriini KNH-ga patsientidel, kelle eGFR-i väärtus on alla 45 mL/min/1,73 m2 (129).
Töörühma hinnangul on antiagregantravi kasutamine levinud ja seepärast sõnastati soovitus kaaluda KNH-ga patsientidel antiagregantravi kasu ja riske.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid KNH_ EvSu_ K14_I; KNH_EvSu_K14_lisa_ antiagregant.
Juhuslikustatud kontrolluuringu andmete post hoc-analüüsi tulemustest selgus, et aspiriinil oli soodne mõju SVH ennetamisele KNH (eGFR alla 45 mL/min/1,73 m2) ja kõrgvererõhktõvega patsientidel. Verejooksu risk oli aspiriini tarvitajatel suurem, kuid kasu ületas siiski riski. Uuringus osalenud G4–G5 raskusastmes KNH-ga patsientide (eGFR alla 30 mL/min/1,73 m2) väikese arvu tõttu ei olnud võimalik selle patsiendirühma tulemusi analüüsida. (126)
Retrospektiivses uuringus analüüsiti aspiriini mõju SVH tekkele KNH-ga patsientidel. Leiti, et aspiriini tarvitajate rühmas oli SVH-sse haigestumise ja neerupuudulikkusesse suremise risk märgatavalt suurem, samuti oli sagedasem S,P-Crea taseme kahekordistumine. Verejooksu oht oli mõlemas rühmas võrreldav. (127)
Ülevaateartiklis kirjeldatud mitme metaanalüüsi, juhuslikustatud kontrolluuringu ja vaatlusuuringu tulemustest selgus, et aspiriini tarvitajatel oli verejooksu risk suurem, samas olid tulemused aspiriini SVH-d ennetava toime kohta KNH-ga patsientidel vasturääkivad. Artiklis toodi esile kahe juhuslikustatud kontrolluuringu tulemused, mis pole tõestanud väikese annuse aspiriini kasutamise positiivset toimet SVH progresseerumisele diabeedihaigetel. (128)
KDIGO ravijuhendis soovitatakse SVH primaarseks ennetamiseks anti- agregantravi, kuid hoiatatakse verejooksu riski eest (2). Ameerika Südame- assotsiatsiooni ravijuhendis soovitatakse SVH primaarseks ennetamiseks kasutada aspiriini KNH-ga patsientidel, kelle eGFR-i väärtus on alla 45 mL/min/1,73 m2 (129).
Töörühma hinnangul on antiagregantravi kasutamine levinud ja seepärast sõnastati soovitus kaaluda KNH-ga patsientidel antiagregantravi kasu ja riske.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtteid KNH_ EvSu_ K14_I; KNH_EvSu_K14_lisa_ antiagregant.
Antikoagulandid
| 48 |
|
Kroonilise neeruhaigusega patsiendile antikoagulantravi määra- misel eelistage patsiendi ohutust ja kasutusmugavust silmas pida- des otsese toimega suukaudset antikoagulanti, kui ei ole kaasnevat haigust, mille puhul on näidustatud ainult varfariinravi. [UUS 2023] Nõrk soovitus, mõõdukas tõendatuse aste |
Nelja metaanalüüsi põhjal on otsese toimega suukaudsed antikoagulandid (OSAK) kroonilise neeruhaiguse ja kodade virvendusarütmiaga (KVA) patsientide seas trombemboolia riski vähendamisel vähemalt sama efektiivsed kui varfariin (130–133).
Eri näidustustel antikoagulantravi vajavatel KNH-ga patsientide puhul on eelistatud OSAK-i kasutamine, sest nende ohutusprofiil on parem. Neljas metaanalüüsis on KNH-ga patsientidel näidatud OSAK-i puhul raskete veritsuste (sh ajuhemorraagiate) väiksemat riski kui varfariinil (130–133). Samuti on OSAK- ravi saavatel KNH-ga patsientidel võrreldes varfariinravirühmaga väiksem risk ägeda neerukahjustuse tekkeks, neerufunktsiooni halvenemiseks ja lõppstaadiumi neeruhaiguse kujunemiseks (134).
Soovituse andmisel võttis töörühm lisaks leitud tõendusmaterjalile arvesse ka varfariinravi jälgimise suhtelist keerukust (regulaarne analüüside määramise vajadus, visiitide suurem arv, patsiendile seatavad dieedipiirangud). Ravi valikul tuleb kindlasti arvestada patsiendi kaasnevate haigustega. Mehaanilise klapiproteesi või hemodünaamiliselt olulise mitraalstenoosi puhul tuleb KVA-ga patsiendil sõltumata KNH esinemisest kasutada antikoagulatsiooniks K-vitamiini antagoniste (135).
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 5 TõKo ja SoKo tabelit.
Eri näidustustel antikoagulantravi vajavatel KNH-ga patsientide puhul on eelistatud OSAK-i kasutamine, sest nende ohutusprofiil on parem. Neljas metaanalüüsis on KNH-ga patsientidel näidatud OSAK-i puhul raskete veritsuste (sh ajuhemorraagiate) väiksemat riski kui varfariinil (130–133). Samuti on OSAK- ravi saavatel KNH-ga patsientidel võrreldes varfariinravirühmaga väiksem risk ägeda neerukahjustuse tekkeks, neerufunktsiooni halvenemiseks ja lõppstaadiumi neeruhaiguse kujunemiseks (134).
Soovituse andmisel võttis töörühm lisaks leitud tõendusmaterjalile arvesse ka varfariinravi jälgimise suhtelist keerukust (regulaarne analüüside määramise vajadus, visiitide suurem arv, patsiendile seatavad dieedipiirangud). Ravi valikul tuleb kindlasti arvestada patsiendi kaasnevate haigustega. Mehaanilise klapiproteesi või hemodünaamiliselt olulise mitraalstenoosi puhul tuleb KVA-ga patsiendil sõltumata KNH esinemisest kasutada antikoagulatsiooniks K-vitamiini antagoniste (135).
Vaata veebilehelt www.ravijuhend.ee ajakohastatava ravijuhendi kliinilise küsimuse nr 5 TõKo ja SoKo tabelit.
Digoksiin
| 49 |
|
Kroonilise neeruhaigusega patsiendi puhul arvestage digoksiini annustamisel neerufunktsiooni ja suurt individuaalset varieeru- vust seerumi terapeutilise kontsentratsiooni saavutamisel ning kõrvaltoimete tekkimisel. Ravimi manustamist alustage väiksemas annuses ja hoidke see- rumi terapeutiline kontsentratsioon pigem madalal tasemel. |
Leitud tõendusmaterjali kvaliteet on madal ja tugineb ühele süstemaatilisele kirjanduse ülevaatele, digoksiini farmakokineetikat analüüsivatele väikese valimiga kohortuuringutele ning ühele kolme juhuslikustatud kontrolluuringut käsitlevale ülevaateartiklile. Uuringutesse ei ole kaasatud neerufunktsiooni raske vähenemisega patsiente.
Uuringute tulemuste põhjal piiravad digoksiini kasutamist kitsas terapeutiline vahemik ja keerukas farmakokineetika, sealjuures suur individuaalne varieeruvus. Digoksiini toksiliste toimete risk on suurem vanemaealistel, vähenenud neerufunktsiooniga ja polüfarmakoteraapiat saavatel patsientidel. Toksiliste toimete vältimiseks on soovitatav kasutada väikeseid ravimiannuseid (kuni 0,125 mg päevas) ja määrata regulaarselt ravimi kontsentratsioon verest. Vähenenud neerufunktsiooniga patsientide puhul on oluline arvestada digoksiini pikenenud poolväärtusajaga. KNH-ga patsientidel saavutatakse ravimi tasakaalukontsentratsioon tavapärasest (7–10 päeva) hiljem, kuni 3–4 nädalat pärast ravi alustamist. Otstarbekas on pärast ravi alustamist kontrollida digoksiini kontsentratsiooni varases perioodis (7–10 päeva) ja eeldatava tasakaalukontsentratsiooni saavutamisel (3–4 nädalat). Digoksiini eesmärkväärtused soovitatakse hoida vahemikus 0,5–0,8 ng/mL. (136–141)
Digoksiini farmakokineetikale tuginedes peab KDIGO ravijuhendi töörühm tähtsaks korrigeerida digoksiini annust ravimi plasmakontsentratsiooni põhjal. Vähenenud neerufunktsiooniga (eGFR alla 60 mL/min/1,73 m2) patsientidel peab kaasneva ägeda haigestumise korral digoksiinravi ajutiselt katkestama. (2)
Töörühma hinnangul on digoksiin Eestis laialdaselt kasutatav ravim. Vaatamata kõrge kvaliteediga tõendusmaterjali puudumisele on vajalik soovitus digoksiini annustamise kohta, et tagada ravimi patsiendipõhine ja ohutu kasutamine.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K14_II.
Uuringute tulemuste põhjal piiravad digoksiini kasutamist kitsas terapeutiline vahemik ja keerukas farmakokineetika, sealjuures suur individuaalne varieeruvus. Digoksiini toksiliste toimete risk on suurem vanemaealistel, vähenenud neerufunktsiooniga ja polüfarmakoteraapiat saavatel patsientidel. Toksiliste toimete vältimiseks on soovitatav kasutada väikeseid ravimiannuseid (kuni 0,125 mg päevas) ja määrata regulaarselt ravimi kontsentratsioon verest. Vähenenud neerufunktsiooniga patsientide puhul on oluline arvestada digoksiini pikenenud poolväärtusajaga. KNH-ga patsientidel saavutatakse ravimi tasakaalukontsentratsioon tavapärasest (7–10 päeva) hiljem, kuni 3–4 nädalat pärast ravi alustamist. Otstarbekas on pärast ravi alustamist kontrollida digoksiini kontsentratsiooni varases perioodis (7–10 päeva) ja eeldatava tasakaalukontsentratsiooni saavutamisel (3–4 nädalat). Digoksiini eesmärkväärtused soovitatakse hoida vahemikus 0,5–0,8 ng/mL. (136–141)
Digoksiini farmakokineetikale tuginedes peab KDIGO ravijuhendi töörühm tähtsaks korrigeerida digoksiini annust ravimi plasmakontsentratsiooni põhjal. Vähenenud neerufunktsiooniga (eGFR alla 60 mL/min/1,73 m2) patsientidel peab kaasneva ägeda haigestumise korral digoksiinravi ajutiselt katkestama. (2)
Töörühma hinnangul on digoksiin Eestis laialdaselt kasutatav ravim. Vaatamata kõrge kvaliteediga tõendusmaterjali puudumisele on vajalik soovitus digoksiini annustamise kohta, et tagada ravimi patsiendipõhine ja ohutu kasutamine.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K14_II.
Mittesteroidsed põletikuvastased ained
| 50 |
|
Kroonilise neeruhaigusega patsiendil, kes kasutab pikalt mitte- steroidseid põletikuvastaseid aineid, kontrollige neerufunktsiooni. Kontrollimise sagedus sõltub neeruhaiguse progresseerumise kiirusest. |
| 51 |
|
Kroonilise neeruhaigusega patsiendil vältige mittesteroidse põle- tikuvastase aine kasutamist, kui eGFR on alla 30 mL/min/1,73 m2 (G4–G5). |
Süstemaatilises ülevaates MSPVA mõju kohta KNH progresseerumisele leiti, et nende kasutamine tavalises annuses ei soodusta neerufunktsiooni vähenemist. Puudub veenev tõendusmaterjal selle kohta, milline periood on tavaannuses MSPVA kasutamiseks ohutu. Pole ka teada, kas MSPVA kasutamine võib olla mõõduka ja raske KNH väljakujunemise põhjus. (142)
Ravijuhendid soovitavad MSPVA-sid KNH puhul kasutada ettevaatusega ja vältida nende pikaajalist tarvitamist (1, 8, 14). Soovitatav on vältida MSPVA kasutamist patsientidel, kelle eGFR on alla 30 mL/min/1,73 m2, ja mitte tarvitada MSPVA-d koos teiste nefrotoksiliste preparaatidega (liitium, RAAS-i antagonistid). MSPVA pikaajaline kasutamine ei ole näidustatud eGFR-iga alla 60 mL/min/1,73 m2. (2)
MSPVA-d regulaarselt tarvitavatel patsientidel on soovitatav kontrollida neerufunktsiooni vähemalt kord aastas. Varem teadaoleva KNH-ga patsientidel sõltub kontrollanalüüside tegemine KNH raskusastmest ja teistest riskiteguritest (vt lisa 3). (9)
Tõendusmaterjal on madala kvaliteediga, juhuslikustatud kontrolluuringuid MSPVA mõju kohta KNH progresseerumisele ei ole tehtud. Samuti ei ole andmeid, kas MSPVA-d suurendavad KNH tekkeriski. MSPVA-de laialdase kasutamise tõttu (sh KNH-ga patsientidel) pidas töörühm vajalikuks sõnastada praktilised soovitused nende kasutamise ja ravi jälgimise kohta KNH-ga patsientidel.
Ravijuhendid soovitavad MSPVA-sid KNH puhul kasutada ettevaatusega ja vältida nende pikaajalist tarvitamist (1, 8, 14). Soovitatav on vältida MSPVA kasutamist patsientidel, kelle eGFR on alla 30 mL/min/1,73 m2, ja mitte tarvitada MSPVA-d koos teiste nefrotoksiliste preparaatidega (liitium, RAAS-i antagonistid). MSPVA pikaajaline kasutamine ei ole näidustatud eGFR-iga alla 60 mL/min/1,73 m2. (2)
MSPVA-d regulaarselt tarvitavatel patsientidel on soovitatav kontrollida neerufunktsiooni vähemalt kord aastas. Varem teadaoleva KNH-ga patsientidel sõltub kontrollanalüüside tegemine KNH raskusastmest ja teistest riskiteguritest (vt lisa 3). (9)
Tõendusmaterjal on madala kvaliteediga, juhuslikustatud kontrolluuringuid MSPVA mõju kohta KNH progresseerumisele ei ole tehtud. Samuti ei ole andmeid, kas MSPVA-d suurendavad KNH tekkeriski. MSPVA-de laialdase kasutamise tõttu (sh KNH-ga patsientidel) pidas töörühm vajalikuks sõnastada praktilised soovitused nende kasutamise ja ravi jälgimise kohta KNH-ga patsientidel.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K14_I.
Aminoglükosiidid
| 52 | |
Kui kasutate kroonilise neeruhaigusega patsiendil aminoglüko- siide, annustage ravimit olenevalt seerumi kontsentratsioonist. |
Ülevaateartiklite alusel tuleb aminoglükosiidide annustamisel arvestada, et need on kitsa terapeutilise vahemikuga ja kontsentratsioonist sõltuvad bak- teritsiidsed antibiootikumid, mis erituvad peaaegu täielikult neerude kaudu. Aminoglükosiidide farmakokineetiline varieeruvus on eri inimeste puhul suur. (140, 141)
Aminoglükosiidid on potentsiaalselt nefrotoksilise toimega, kumuleerudes baaskontsentratsiooni kõrgete väärtuste korral neerutuubulitesse. Nefrotoksilise toime vähendamiseks ja kiiremaks efektiivse terapeutilise kontsentratsiooni saavutamiseks soovitatakse aminoglükosiidi kogu päevane annus manustada ühe korraga. (141, 142)
Ravimi annustamisel tuleks arvestada patsiendi neerufunktsiooni, jälgida ravimi baaskontsentratsiooni seerumis ja selle järgi ravi korrigeerida (143–146). Oluline on vältida ravi ajal teiste ototoksiliste ravimite kasutamist (näiteks furosemiid). (2)
Leitud tõenduse kvaliteet on madal, kuid soovituse sõnastamisel on töörühm arvestanud ravimi üleannustamisega kaasnevaid ohte ja täpsemast annustamisest saadavat kasu patsiendile. Kui ravi juhtimine ravimi baaskontsentratsiooni järgi ei ole võimalik (puudub analüüsi tegemise võimalus), ei soovita ravijuhendi töörühm KNH-ga patsientidele aminoglükosiide manustada.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K14_II.
Kõigi aminoglükosiidide kontsentratsioonide määramine seerumist või plastmast ei ole võimalik. Eestis on üldjuhul võimalik määrata gentamütsiini ja amikatsiini kontsentratsiooni, kuid seda mitte kõigis laborites.
Aminoglükosiidid on potentsiaalselt nefrotoksilise toimega, kumuleerudes baaskontsentratsiooni kõrgete väärtuste korral neerutuubulitesse. Nefrotoksilise toime vähendamiseks ja kiiremaks efektiivse terapeutilise kontsentratsiooni saavutamiseks soovitatakse aminoglükosiidi kogu päevane annus manustada ühe korraga. (141, 142)
Ravimi annustamisel tuleks arvestada patsiendi neerufunktsiooni, jälgida ravimi baaskontsentratsiooni seerumis ja selle järgi ravi korrigeerida (143–146). Oluline on vältida ravi ajal teiste ototoksiliste ravimite kasutamist (näiteks furosemiid). (2)
Leitud tõenduse kvaliteet on madal, kuid soovituse sõnastamisel on töörühm arvestanud ravimi üleannustamisega kaasnevaid ohte ja täpsemast annustamisest saadavat kasu patsiendile. Kui ravi juhtimine ravimi baaskontsentratsiooni järgi ei ole võimalik (puudub analüüsi tegemise võimalus), ei soovita ravijuhendi töörühm KNH-ga patsientidele aminoglükosiide manustada.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K14_II.
Kõigi aminoglükosiidide kontsentratsioonide määramine seerumist või plastmast ei ole võimalik. Eestis on üldjuhul võimalik määrata gentamütsiini ja amikatsiini kontsentratsiooni, kuid seda mitte kõigis laborites.
D-vitamiin ja krooniline neeruhaigus
| 53 | |
Kroonilise neeruhaigusega patsiendil ei ole rutiinne D-vitamiini manustamine vajalik. |
| 54 |
|
Kroonilise neeruhaigusega patsiendil on hüpovitaminoosi korral D-vitamiini manustamisel soovitatav lähtuda vitamiin D (25-OH) laboratoorselt määratud sisaldusest (sarnaselt üldrahvastikule). |
KNH-ga patsientidele D-vitamiini manustamist käsitlevad süstemaatilised ülevaated on madala kvaliteediga ja nende tulemusi ei saa üheselt kohandada kõigile KNH-ga patsientidele. D-vitamiini ja selle asendusravi kohta tehtud 169 süstemaatilise ülevaatega metaanalüüsis, milles hinnati 137 tulemusnäitajat, ei leitud veenvat tõendust D-vitamiini tegeliku mõju kohta ühelegi uuritud tulemusnäitajale (147).
Ravijuhendites ei soovitata D-vitamiini üldjuhul raviskeemi lisada, kuna seni avaldatud madala tõendusega uuringutes (sh NICE-i ravijuhendi raames koostatud süstemaatilises ülevaates) ei ole see näidanud patsiendikesksete tulemusnäitajate (suremus, kardiovaskulaarsed sündmused, KNH süvenemine, LSNH kujunemine, luumurrud) paranemist. Vitamiin D (25-OH) taseme määramist enne KNH G3 raskusastme kujunemist ei peeta vajalikuks. (1, 8, 12, 145)
D-vitamiini vaeguse diagnoosimise korral on asendusravi õigustatud (1, 8, 12, 145). Hüperparatüreoosi puhul tuleks D-vitamiini taset kontrollida ja vajaduse korral lisada D-vitamiin või mõni selle aktiivne vorm raviskeemi. Aktiivsete D-vitamiini vormide kasutamisel tuleb arvestada hüperkaltseemia riskiga. (8, 12, 145)
KNH-ga patsientidele D-vitamiini manustamist käsitlev tõendusmaterjal on ebapiisav, eeskätt Eestis laialdaselt kasutatava kolekaltsiferooli puhul. Seepärast ei soovita ravijuhendi töörühm D-vitamiini kõigile raviskeemi lisada. D-vitamiini vaeguse korral on vaja asendusravi ja sel juhul tuleb KNH-ga patsiente ravida samamoodi kui üldrahvastikku.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K17.
Ravijuhendites ei soovitata D-vitamiini üldjuhul raviskeemi lisada, kuna seni avaldatud madala tõendusega uuringutes (sh NICE-i ravijuhendi raames koostatud süstemaatilises ülevaates) ei ole see näidanud patsiendikesksete tulemusnäitajate (suremus, kardiovaskulaarsed sündmused, KNH süvenemine, LSNH kujunemine, luumurrud) paranemist. Vitamiin D (25-OH) taseme määramist enne KNH G3 raskusastme kujunemist ei peeta vajalikuks. (1, 8, 12, 145)
D-vitamiini vaeguse diagnoosimise korral on asendusravi õigustatud (1, 8, 12, 145). Hüperparatüreoosi puhul tuleks D-vitamiini taset kontrollida ja vajaduse korral lisada D-vitamiin või mõni selle aktiivne vorm raviskeemi. Aktiivsete D-vitamiini vormide kasutamisel tuleb arvestada hüperkaltseemia riskiga. (8, 12, 145)
KNH-ga patsientidele D-vitamiini manustamist käsitlev tõendusmaterjal on ebapiisav, eeskätt Eestis laialdaselt kasutatava kolekaltsiferooli puhul. Seepärast ei soovita ravijuhendi töörühm D-vitamiini kõigile raviskeemi lisada. D-vitamiini vaeguse korral on vaja asendusravi ja sel juhul tuleb KNH-ga patsiente ravida samamoodi kui üldrahvastikku.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K17.
D-vitamiin ja krooniline neeruhaigus
| 53 | |
Kroonilise neeruhaigusega patsiendil ei ole rutiinne D-vitamiini manustamine vajalik. |
| 54 |
|
Kroonilise neeruhaigusega patsiendil on hüpovitaminoosi korral D-vitamiini manustamisel soovitatav lähtuda vitamiin D (25-OH) laboratoorselt määratud sisaldusest (sarnaselt üldrahvastikule). |
KNH-ga patsientidele D-vitamiini manustamist käsitlevad süstemaatilised ülevaated on madala kvaliteediga ja nende tulemusi ei saa üheselt kohandada kõigile KNH-ga patsientidele. D-vitamiini ja selle asendusravi kohta tehtud 169 süstemaatilise ülevaatega metaanalüüsis, milles hinnati 137 tulemusnäitajat, ei leitud veenvat tõendust D-vitamiini tegeliku mõju kohta ühelegi uuritud tulemusnäitajale (147).
Ravijuhendites ei soovitata D-vitamiini üldjuhul raviskeemi lisada, kuna seni avaldatud madala tõendusega uuringutes (sh NICE-i ravijuhendi raames koostatud süstemaatilises ülevaates) ei ole see näidanud patsiendikesksete tulemusnäitajate (suremus, kardiovaskulaarsed sündmused, KNH süvenemine, LSNH kujunemine, luumurrud) paranemist. Vitamiin D (25-OH) taseme määramist enne KNH G3 raskusastme kujunemist ei peeta vajalikuks. (1, 8, 12, 145)
D-vitamiini vaeguse diagnoosimise korral on asendusravi õigustatud (1, 8, 12, 145). Hüperparatüreoosi puhul tuleks D-vitamiini taset kontrollida ja vajaduse korral lisada D-vitamiin või mõni selle aktiivne vorm raviskeemi. Aktiivsete D-vitamiini vormide kasutamisel tuleb arvestada hüperkaltseemia riskiga. (8, 12, 145)
KNH-ga patsientidele D-vitamiini manustamist käsitlev tõendusmaterjal on ebapiisav, eeskätt Eestis laialdaselt kasutatava kolekaltsiferooli puhul. Seepärast ei soovita ravijuhendi töörühm D-vitamiini kõigile raviskeemi lisada. D-vitamiini vaeguse korral on vaja asendusravi ja sel juhul tuleb KNH-ga patsiente ravida samamoodi kui üldrahvastikku.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K17.
D-vitamiini vaeguse diagnoosimise korral on asendusravi õigustatud (1, 8, 12, 145). Hüperparatüreoosi puhul tuleks D-vitamiini taset kontrollida ja vajaduse korral lisada D-vitamiin või mõni selle aktiivne vorm raviskeemi. Aktiivsete D-vitamiini vormide kasutamisel tuleb arvestada hüperkaltseemia riskiga. (8, 12, 145)
KNH-ga patsientidele D-vitamiini manustamist käsitlev tõendusmaterjal on ebapiisav, eeskätt Eestis laialdaselt kasutatava kolekaltsiferooli puhul. Seepärast ei soovita ravijuhendi töörühm D-vitamiini kõigile raviskeemi lisada. D-vitamiini vaeguse korral on vaja asendusravi ja sel juhul tuleb KNH-ga patsiente ravida samamoodi kui üldrahvastikku.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K17.
Radioloogilised uuringud kroonilise neeruhaigusega patsientidel
| 55 |
|
Kroonilise neeruhaigusega patsiendil hinnake enne intravasku- laarse kontrastainega uuringu tegemist ägeda neerukahjustuse tekkimise riski. |
| 56 |
|
Kui kroonilise neeruhaigusega patsiendile, kelle eGFR on alla 60 mL/min/1,73 m2 (G3a–G5), on vaja teha intravaskulaarse kont- rastainega uuring, siis
|
| 57 |
|
Vältige gadoliiniumi sisaldusega kontrastainet kroonilise neeru- haigusega patsientidel, kellel on neerukahjutuse tõttu suurenenud risk nefrogeense süsteemse fibroosi tekkeks (eGFR alla 30 mL/ min/1,73 m2, G4–G5). |
Kontrastaine (KA) kasutamine võib põhjustada ägedat neerukahjustust. Ühe süstemaatilise ülevaate alusel seostub KA nefropaatia suurema suremuse, sagedasemate kardiovaskulaarsete sündmuste, LSNH esinemise ja pikema haiglaraviga. (149)
Metaanalüüsis leiti, et KA nefropaatia esmashaigestumus oli üldrahvastikus 6,4%, kuid KNH-ga patsientidel 2,26 ja diabeediga patsientidel 3,1 korda suurem. (150)
Retrospektiivse vaatlusuuringu andmetel on joodi sisaldava intravaskulaarse KA kasutamisel oht nefropaatia tekkeks suurem patsientidel, kelle eGFR on alla 45 mL/min/1,73 m2 hoolimata uuringueelsest piisavast vedelikumanustamisest ja teistest kaasnevatest riskiteguritest (151).
Oluliste patsiendipoolsete riskiteguritena nimetatakse uuringutes ja ravijuhendites veel eksikoosi, ägedat ning kroonilist südamepuudulikkust, hiljutist müokar- diinfarkti, vererõhu langust uuringu tegemise ajal või pikemaaegset hüpotensiooni, aneemiat, vanust ja nefrotoksiliste ravimite manustamist. Risk on suurem KA arterisisesel ja suure osmolaarsusega või suurtes annustes manustamisel, samuti korduvate järjestikuste uuringute tegemisel. (1, 2, 14, 146, 148–154)
Metaanalüüsis leiti, et KA nefropaatia esmashaigestumus oli üldrahvastikus 6,4%, kuid KNH-ga patsientidel 2,26 ja diabeediga patsientidel 3,1 korda suurem. (150)
Retrospektiivse vaatlusuuringu andmetel on joodi sisaldava intravaskulaarse KA kasutamisel oht nefropaatia tekkeks suurem patsientidel, kelle eGFR on alla 45 mL/min/1,73 m2 hoolimata uuringueelsest piisavast vedelikumanustamisest ja teistest kaasnevatest riskiteguritest (151).
Oluliste patsiendipoolsete riskiteguritena nimetatakse uuringutes ja ravijuhendites veel eksikoosi, ägedat ning kroonilist südamepuudulikkust, hiljutist müokar- diinfarkti, vererõhu langust uuringu tegemise ajal või pikemaaegset hüpotensiooni, aneemiat, vanust ja nefrotoksiliste ravimite manustamist. Risk on suurem KA arterisisesel ja suure osmolaarsusega või suurtes annustes manustamisel, samuti korduvate järjestikuste uuringute tegemisel. (1, 2, 14, 146, 148–154)
KA nefropaatia tekke vältimiseks tuleks alternatiivina kaaluda KA-vaba uuringumeetodit (ultraheliuuring, KAta nn natiivkompuutertomograafia või magnetresonantstomograafia) (1, 2, 14, 146, 148–154). Kui KAga uuring on hädavajalik, soovitatakse kasutada võimalikult väikest KA kogust ja valida vähem nefrotoksiline KA (väiksema osmolaarsusega või isoosmolaarne) (1, 2, 14, 149, 150, 153, 154).
Enne ja pärast kontrastainega uuringut tuleb võimaluse korral ajutiselt katkestada kõigi nefrotoksiliste ravimite manustamine. Uuringu eel, kestel ja järel tuleb tagada piisav vedelikumanustamine, kasutades veenisiseselt isotoonilist soolalahust või vesinikbikarbonaati ilma või koos N-atsetüültsüsteiiniga. (1, 2, 14, 146, 148–154)
S,P-Crea ja eGFR-i peaks määrama nii enne KA kasutamist kui ka 48–96 tunni jooksul pärast uuringut (1, 2, 149, 152, 154).
Gadoliiniumoksiidi sisaldavat KA-d, mis on kasutusel magnetresonants- tomograafiliste uuringute tegemisel, tuleks vältida patsientidel, kellel on kroonilise neeruhaiguse tõttu suurem risk nefrogeense süsteemse fibroosi tekkeks (eGFR on alla 15 mL/min/1,73 m2) (1, 2, 14). Arstid peavad olema teadlikud riski-kasu suhtest enne gadoliiniumi sisaldava KA kasutamist KNH-ga patsientidel, kelle eGFR on 15–29 mL/min/1,73 m2 (1, 2, 14). Hemodialüüsravi saavale patsiendile tuleks pärast gadoliiniumiga uuringut teha dialüüsiprotseduur (1, 2).
Ravijuhendite soovitused on kooskõlas nii Euroopa Ravimiameti (EMA) kui ka Ameerika Ühendriikide Toidu- ja Ravimiameti (FDA) hoiatustega gadoliiniumi sisaldavate KA-de kasutamise kohta vähenenud neerufunktsiooniga patsientidel.
Kuigi tõendus gadoliiniumoksiidi kasutamise piiramise vajalikkuse kohta KNH-ga patsientidel on mõõdukas, lähtus ravijuhendi töörühm selles küsimuses eelkõige patsiendi ohutusest ja sõnastas tugeva soovituse.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K15.
Patsiendi suunamine erialaspetsialisti vastuvõtule
| 58 |
|
Kroonilise neeruhaigusega patsient suunake nefroloogi konsul- tatsioonile, kui
|
| 59 |
|
Kroonilise neeruhaiguse patsient vajab nefroloogi konsultatsiooni, kui esmakordse neerukahjustuse avastamisel
Kuseteede obstruktsiooni välistamiseks tuleb enne konsultatsiooni teha kõhuõõne ja vaagna ultraheliuuring.
|
Nefroloogi konsultatsiooni vajavad patsiendid, kellel on äge neerukahjustus või järsk püsiv eGFR-i alanemine, eGFR alla 30 mL/min/1,73 m2 (KNH G4–G5), püsiv väljendunud albuminuuria (U-Alb/U-Crea üle 30 mg/mmol), KNH ja selle süvenemine, raviresistentne kõrgvererõhktõbi, ebaselge põhjusega hematuuria (erütrotsüütide silindrid, uriini sademe mikroskoopial rohkem kui 20 erütrotsüüti vaateväljas või voolutsütomeetial erütrotsüüte rohkem kui 140 x106/L), püsivad nihked seerumi kaaliumisisalduses, korduv või ulatuslik neerukivitõbi, pärilik neeruhaigus või neeruarteri stenoosi kahtlus (1, 8, 12, 14).
Varane nefroloogi vastuvõtule suunamine (aasta enne dialüüsravi) toob prospektiivse kohortuuringu alusel kaasa väiksemaid dialüüsieelseid ja ka dialüüsi alustamisega seonduvaid tervishoiukulusid (158).
Arvestades, et õigeaegse suunamise kaugem eesmärk on NAR-i planeerimine süveneva KNH-ga patsientidel, on ravijuhendi töörühm olemasoleva tõenduspõhise andmestiku ja ravijuhendite soovituste alusel koostanud soovitused nefroloogi vastuvõtule või konsultatsioonile suunamiseks.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K21_K22.
Varane nefroloogi vastuvõtule suunamine (aasta enne dialüüsravi) toob prospektiivse kohortuuringu alusel kaasa väiksemaid dialüüsieelseid ja ka dialüüsi alustamisega seonduvaid tervishoiukulusid (158).
Arvestades, et õigeaegse suunamise kaugem eesmärk on NAR-i planeerimine süveneva KNH-ga patsientidel, on ravijuhendi töörühm olemasoleva tõenduspõhise andmestiku ja ravijuhendite soovituste alusel koostanud soovitused nefroloogi vastuvõtule või konsultatsioonile suunamiseks.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K21_K22.
| 60 |
|
Kroonilise neeruhaigusega patsient suunake kuseteede kasvaja või uudismoodustise kahtluse korral uroloogi e-konsultatsioonile. [UUS 2023] Praktiline soovitus |
| 61 |
|
Kroonilise neeruhaigusega patsient suunake neerupealise kasvaja kahtlusel endokrinoloogi e-konsultatsioonile. [UUS 2023] Praktiline soovitus |
Töörühm arutas patsiendi edasist käsitlust neeru- või neerupealise uudismoodustise leidmisel. Neeru uudismoodustise korral otsustab lisauuringute vajaduse, ravi ja edasise jälgimistaktika üle uroloog. Neerupealise uudismoodustise puhul määrab vajaduse korral lisauuringud ja analüüsid ning jälgimis- ja ravi- taktika endokrinoloog. Erialaspetsialistiga soovitab töörühm konsulteerida e-konsultatsiooni vahendusel.
| 62 |
|
Kroonilise neeruhaigusega patsiendi nõustamiseks on soovitat- av kroonilise neeruhaiguse alase koolitusega õe konsultatsioon neerukeskuses. |
Ühe juhuslikustatud kontrolluuringu ja selle jätku-uuringute alusel parandab KNH-ga patsiendi jälgimine ning ravi KNH-le spetsialiseerunud õe kaasabil KNH-ga seotud riskitegurite käsitlust (vähenesid vererõhuväärtused, LDL- kolesterool, proteinuuria; suurenes hemoglobiinisisaldus), võib parandada ravisoostumust (paranes kõrgvererõhktõve ravimite, statiinide, aktiivse D-vitamiini ja aspiriini kasutus) ja pidurdada KNH progresseerumist (aeglasem eGFR-i alanemine, vähesem S,P-Crea suurenemine) (158–162). Samas ei leitud selget efekti müokardiinfarktide ja insultide esinemissageduses ega üld- ja kardiovaskulaarse suremuse vähenemises (160).
Ravijuhendi töörühm leidis, et uuringute tulemused kinnitavad õe iseseisva vastuvõtu kasulikkust ja vajalikkust patsiendi ravitulemuste parandamiseks ning KNH progresseerumise ennetamiseks. KNH-ga patsiendi nõustamisel on oluline õe spetsiaalne ettevalmistus. Erialast riiklikku koolitust praegu KNH- ga patsientidega tegelevatele õdedele ei ole. Töörühm jäi arvamusele, et kõik patsiendid ei pea enne õe vastuvõttu ilmtingimata minema nefroloogi vastuvõtule: õde suunab vajaduse korral patsiendi eriarsti (nefroloogi) vastuvõtule.
Ravijuhendi töörühm leidis, et uuringute tulemused kinnitavad õe iseseisva vastuvõtu kasulikkust ja vajalikkust patsiendi ravitulemuste parandamiseks ning KNH progresseerumise ennetamiseks. KNH-ga patsiendi nõustamisel on oluline õe spetsiaalne ettevalmistus. Erialast riiklikku koolitust praegu KNH- ga patsientidega tegelevatele õdedele ei ole. Töörühm jäi arvamusele, et kõik patsiendid ei pea enne õe vastuvõttu ilmtingimata minema nefroloogi vastuvõtule: õde suunab vajaduse korral patsiendi eriarsti (nefroloogi) vastuvõtule.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K23.
Kroonilise neeruhaigusega patsientide predialüüsi käsitlus
|
|
Kroonilise neeruhaigusega patsient, kelle eGFR on alla 30 mL/ min/1,73 m2 (G4–G5), kaasake neerukeskuse predialüüsi programmi. |
27 kohortuuringu tulemustel põhinevas süstemaatilises ülevaates hinnati KNH prognoosi, hospitaliseerimise pikkust ja biokeemilisi parameetreid nii varakult kui ka hilja nefroloogi juurde suunatud patsiendirühmade puhul. Enamikus kaasatud uuringutes mõeldi hilise suunamise all nefroloogile suunamist vähem kui kolm kuud enne NAR-i algust. Varakult suunatud patsientide rühmas oli väiksem suremus nii kolm kuud kui ka viis aastat pärast NAR-i alustamist ja hospitaliseerimise pikkus oli selles rühmas 8,8 päeva võrra lühem. Rühma iseloomustas Hb suurem sisaldus, sagedasem erütropoeesi stimuleerivate ainete kasutamine ja S,P-Crea madalam tase dialüüsi alustamise ajal. Varakult suunatud patsientide rühmas oli peritoneaaldialüüsravi patsientide arv suurem ja ajutisi dialüüsikateetreid kasutati harvem. (163)
Metaanalüüsi (22 uuringut) andmete põhjal iseloomustas hilja ehk vähem kui kolm kuud enne NAR-i alustamist nefroloogi vastuvõtule suunatud patsiente märgatavalt suurem suremuse risk, pikem haiglas viibimise aeg ja madalamad albumiini ning hematokriti väärtused NAR-i alustamise ajal (164). Prospektiivses kohortuuringus leiti, et diabeedipatsientide ja eakate (vanus üle 70 aasta) hulgas oli hilja suunatud patsientide rühmas üldine suremus esimesel dialüüsravi aastal suurem (165). Varajase suunamise eelised on nimetatud kolmes ravijuhendis (vt tabel 2) (1, 8, 14).
Metaanalüüsi (22 uuringut) andmete põhjal iseloomustas hilja ehk vähem kui kolm kuud enne NAR-i alustamist nefroloogi vastuvõtule suunatud patsiente märgatavalt suurem suremuse risk, pikem haiglas viibimise aeg ja madalamad albumiini ning hematokriti väärtused NAR-i alustamise ajal (164). Prospektiivses kohortuuringus leiti, et diabeedipatsientide ja eakate (vanus üle 70 aasta) hulgas oli hilja suunatud patsientide rühmas üldine suremus esimesel dialüüsravi aastal suurem (165). Varajase suunamise eelised on nimetatud kolmes ravijuhendis (vt tabel 2) (1, 8, 14).
Tabel 2. Varajane vs. hiline suunamine: eelised ja tagajärjed
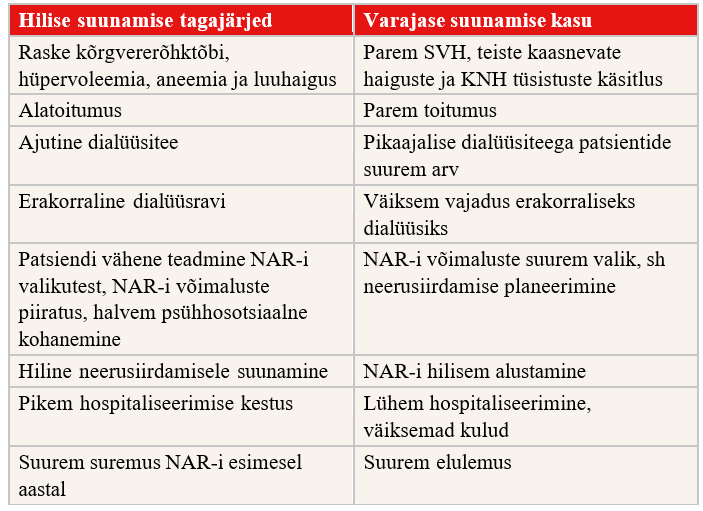
Tabelit 2 on kohandatud KDIGO 2012. aasta ravijuhendi põhjal (2).
Nefroloogi jälgimisele hilise suunamise riskid ja varajase suunamise eelised on selgelt kirjeldatud kõikides leitud allikates, kuid hilise suunamise definitsioon ei ole üheselt selge. Paljudes allikates on see vähem kui kolm kuud enne NARi alustamist. See definitsioon ei ole selle ravijuhendi töörühma arvates täpne ja on otsustatud kasutada eGFR-i väärtusest tulenevat piiri (eGFR alla 30 mL/min/1,73 m2), mida kasutatakse ka NICE-i 2014. aasta ravijuhendis. Soovitus on sõnastatud eesmärgiga kaasata KNH-ga patsiendid õigel ajal pre- dialüüsi programmi: see tähendab, et patsientidega tegelevad neerukeskuses erialaspetsialistid ning patsient saab vajalikku infot, nõustamist ja ravi.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K18.
| 64 | |
Kroonilise neeruhaigusega patsiendil rakendage paremate ravi- tulemuste saavutamiseks predialüüsi käsitluses multidistsipli- naarset lähenemist. |
Süstemaatilises ülevaates (neli juhuslikustatud kontrolluuringut, 14 kohort- uuringut), milles uuriti multidistsiplinaarse käsitluse (MDK) efektiivsust KNH-ga patsientide rühmas, leiti, et MDK seostub väiksema üldsuremuse ja väiksema riskiga dialüüsi alustamiseks, ka ajutise dialüüsikateetri kaudu (166).
Nelja kohortuuringu tulemuste alusel ilmnes MDK rühmas väiksem ajutise dialüüsitee kaudu alustatud dialüüside arv, erakorralise dialüüsi alustamise risk vähenes 49% (167–170). MDK rühma patsientidel oli NAR-i alustamise ajal parem metaboolne staatus ja esines vähem ureemilisi sümptomeid (170). MDK puhul täheldati hospitaliseerimiste arvu vähenemist ja lühemat ravipäevade kestust (168– 170). Samuti oli MDK rühmas kardiovaskulaarsete sündmuste ja infektsioonide arv väiksem kui tavakäsitluse rühmas: risk infektsioonide tekkeks oli kuni 56% väiksem ja risk hospitaliseerimiseks raske infektsiooni tõttu 40% väiksem (168– 170). KNH (G4–G5) progresseerumine oli MDK rühmas aeglasem (164, 166).
MDK programmi hinnati uuringutes kulutõhusaks: väheneb hospitaliseerimise vajadus, selle kestus, erakorraliselt alustatud dialüüside arv ja NAR-i vajavate patsientide hulk (1, 8, 165, 166).
Ravijuhendite soovitused põhinevad ekspertide konsensusel: ollakse arvamusel, et süveneva KNH-ga patsiente peaks jälgima ja käsitlema MDK kriteeriumite alusel. MDK programm peab võimaldama toitumisalase nõustamise või koolitamise, NAR-meetodite koolituse, tagama püsiva dialüüsitee rajamise ja neerusiirdamise võimalikkuse ning kindlustama psühholoogilise ja vaimse toetuse ning sotsiaalse nõustamise kättesaadavuse (vt tabel 3) (1, 8).
Nelja kohortuuringu tulemuste alusel ilmnes MDK rühmas väiksem ajutise dialüüsitee kaudu alustatud dialüüside arv, erakorralise dialüüsi alustamise risk vähenes 49% (167–170). MDK rühma patsientidel oli NAR-i alustamise ajal parem metaboolne staatus ja esines vähem ureemilisi sümptomeid (170). MDK puhul täheldati hospitaliseerimiste arvu vähenemist ja lühemat ravipäevade kestust (168– 170). Samuti oli MDK rühmas kardiovaskulaarsete sündmuste ja infektsioonide arv väiksem kui tavakäsitluse rühmas: risk infektsioonide tekkeks oli kuni 56% väiksem ja risk hospitaliseerimiseks raske infektsiooni tõttu 40% väiksem (168– 170). KNH (G4–G5) progresseerumine oli MDK rühmas aeglasem (164, 166).
MDK programmi hinnati uuringutes kulutõhusaks: väheneb hospitaliseerimise vajadus, selle kestus, erakorraliselt alustatud dialüüside arv ja NAR-i vajavate patsientide hulk (1, 8, 165, 166).
Ravijuhendite soovitused põhinevad ekspertide konsensusel: ollakse arvamusel, et süveneva KNH-ga patsiente peaks jälgima ja käsitlema MDK kriteeriumite alusel. MDK programm peab võimaldama toitumisalase nõustamise või koolitamise, NAR-meetodite koolituse, tagama püsiva dialüüsitee rajamise ja neerusiirdamise võimalikkuse ning kindlustama psühholoogilise ja vaimse toetuse ning sotsiaalse nõustamise kättesaadavuse (vt tabel 3) (1, 8).
Tabel 3. KNH multidistsiplinaarse käsitlusprogrammi komponendid

Tabelit 3 on kohandatud KDIGO 2012. aasta ravijuhendi põhjal (2).
Ravijuhendi töörühma hinnangul on vaatamata tõendusmaterjali vähesusele ja mõõdukale kvaliteedile kõikide uuringute tulemused ühesuunalised. Uuringutes on selgelt näidatud MDK kasulikkust patsiendi elukvaliteedile ja ravitulemustele, seega oli alust koostada selle tõendusmaterjali põhjal tugev soovitus.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K19.
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K19.
| 65 |
|
Kroonilise neeruhaigusega patsiendil hinnake lõppstaadiumi neeruhaiguse ravimeetodi (neeruasendusravi vs. konservatiivne ravi) valikul patsiendi seisundit, kaasnevaid haigusi ja arvestage tema soove. |
Kuigi tõendusmaterjali on vähe ja see on madala kvaliteediga, leiab ravijuhendi töörühm, et teema on tähtis. Patsiendi raviarst peab hindama patsiendi tervislikku seisundit, et ennustada NAR-i kasu ja patsiendi prognoosi. Patsiendil peab olema võimalus rääkida kaasa neerupuudulikkuse ravimeetodi valikul ja teha teadlik otsus.
Süstemaatilise ülevaate alusel oli konservatiivsel ravil olevate KNH-ga patsientide keskmine elulemus kuus kuud (6–23 kuud), dialüüsravil olevate patsientide elulemust mõjutas oluliselt kaasnevate haiguste, eriti südame isheemiatõve esinemine. Ureemiast tingitud sümptomite esinemine konservatiivset ravi saavate patsientide seas oli sage, kuid elukvaliteedis olulist erinevust dialüüsipatsientidega ei leitud. (171)
Kahes süstemaatilises ülevaates ja metaanalüüsis võrreldi dialüüs- ja konservatiivsel ravil olevate KNH-ga patsientide elulemust. Leiti, et dialüüsravi patsientide elulemus on suurem, kuid see sõltus oluliselt kaasnevate haiguste olemasolust. (169, 170)
Euroopas tehtud läbilõike- ja kohortuuringutel põhinevas ülevaates järeldati, et KNH sümptomite esinemine oli sarnane nii dialüüs- kui ka konservatiivse ravi korral, kuid elukvaliteet oli parem dialüüsravi saavatel patsientidel (174).
Ravijuhendite alusel on konservatiivne ravi üks aktsepteeritav ravivõimalus, mida peab toetama kompleksne programm. Ravi valik (dialüüsravi vs. konservatiivne ravi) peaks olema patsiendi või tema hooldaja ja raviarsti ühine otsus. Valiku tegemiseks on vaja patsienti KNH ja ravivõimaluste kohta piisavalt informeerida. Peamine dialüüsravi alustamise eesmärk on oodatav patsiendi elulemuse pikenemine ja tema elukvaliteedi paranemine. Halvem füüsiline ja vaimne tervis ennustavad dialüüsravi patsientidel kehvemat elukvaliteeti. Vanus üksi ei ole halvemat prognoosi ennustav tegur. Toetav ravi on LSNH puhul tunnustatud meetod ja kui patsient või tema hooldaja ei soovi dialüüsraviga alustada, peab tagama võimaluse jätkata toetava raviga. KNH õppeprogramm peab sisaldama NAR-i planeerimist ning olema KNH-ga patsientidele ja nende perekonnaliikmetele kättesaadav (kas esmatasandi tervishoiu või spetsialisti tasemel). (1, 8, 172–174)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K20.
Süstemaatilise ülevaate alusel oli konservatiivsel ravil olevate KNH-ga patsientide keskmine elulemus kuus kuud (6–23 kuud), dialüüsravil olevate patsientide elulemust mõjutas oluliselt kaasnevate haiguste, eriti südame isheemiatõve esinemine. Ureemiast tingitud sümptomite esinemine konservatiivset ravi saavate patsientide seas oli sage, kuid elukvaliteedis olulist erinevust dialüüsipatsientidega ei leitud. (171)
Kahes süstemaatilises ülevaates ja metaanalüüsis võrreldi dialüüs- ja konservatiivsel ravil olevate KNH-ga patsientide elulemust. Leiti, et dialüüsravi patsientide elulemus on suurem, kuid see sõltus oluliselt kaasnevate haiguste olemasolust. (169, 170)
Euroopas tehtud läbilõike- ja kohortuuringutel põhinevas ülevaates järeldati, et KNH sümptomite esinemine oli sarnane nii dialüüs- kui ka konservatiivse ravi korral, kuid elukvaliteet oli parem dialüüsravi saavatel patsientidel (174).
Ravijuhendite alusel on konservatiivne ravi üks aktsepteeritav ravivõimalus, mida peab toetama kompleksne programm. Ravi valik (dialüüsravi vs. konservatiivne ravi) peaks olema patsiendi või tema hooldaja ja raviarsti ühine otsus. Valiku tegemiseks on vaja patsienti KNH ja ravivõimaluste kohta piisavalt informeerida. Peamine dialüüsravi alustamise eesmärk on oodatav patsiendi elulemuse pikenemine ja tema elukvaliteedi paranemine. Halvem füüsiline ja vaimne tervis ennustavad dialüüsravi patsientidel kehvemat elukvaliteeti. Vanus üksi ei ole halvemat prognoosi ennustav tegur. Toetav ravi on LSNH puhul tunnustatud meetod ja kui patsient või tema hooldaja ei soovi dialüüsraviga alustada, peab tagama võimaluse jätkata toetava raviga. KNH õppeprogramm peab sisaldama NAR-i planeerimist ning olema KNH-ga patsientidele ja nende perekonnaliikmetele kättesaadav (kas esmatasandi tervishoiu või spetsialisti tasemel). (1, 8, 172–174)
Vaata veebilehelt www.ravijuhend.ee 2017. aastal koostatud algse ravijuhendi tõendusmaterjali kokkuvõtet KNH_EvSu_K20.
Lisad
Lisa 1. Kroonilise neeruhaiguse suhtes sõelumine ja selle diagnoosimine
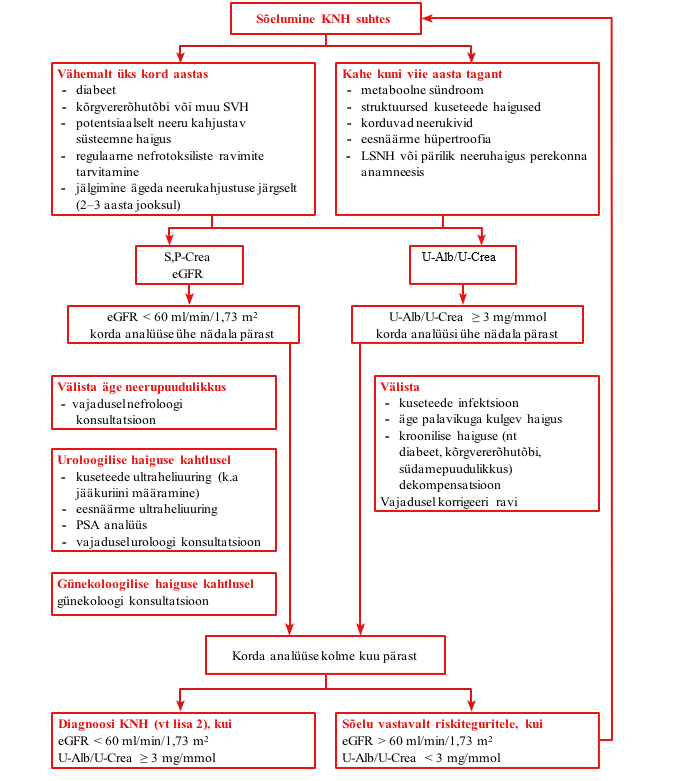
Lisa 2. Kroonilise neeruhaiguse klassifikatsioon
Kohandatud KDIGO 2012. aasta ravijuhendist (2)
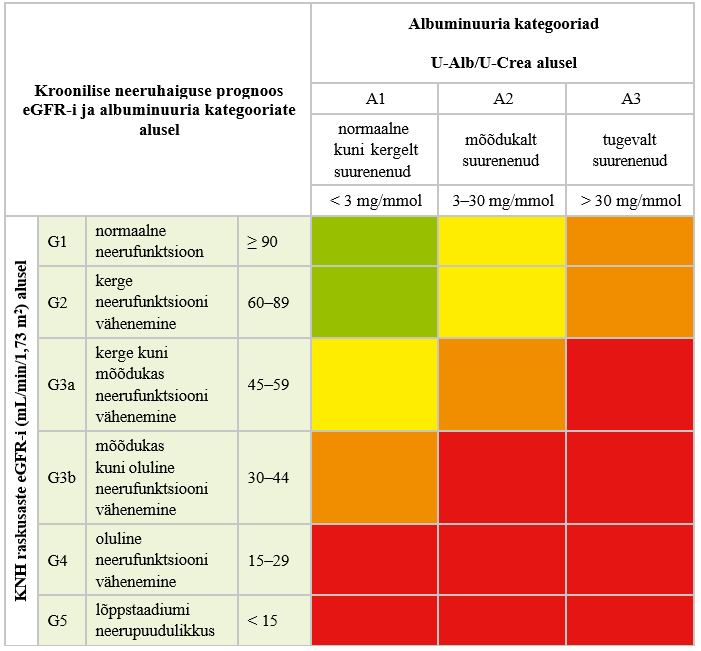 Roheline – väike risk (puuduvad neeruhaigusele viitavad tunnused, KNH-d ei ole) Kollane – mõõdukalt suurenenud risk
Roheline – väike risk (puuduvad neeruhaigusele viitavad tunnused, KNH-d ei ole) Kollane – mõõdukalt suurenenud riskOranž – suur risk
Punane – väga suur risk
1 mg/mmol = 1 g/mol = 10 mg/g
Lisa 3. Kroonilise neeruhaiguse progresseerumine eGFR-i ja albuminuuria alusel
Kohandatud KDIGO 2012. aasta ravijuhendist (2)
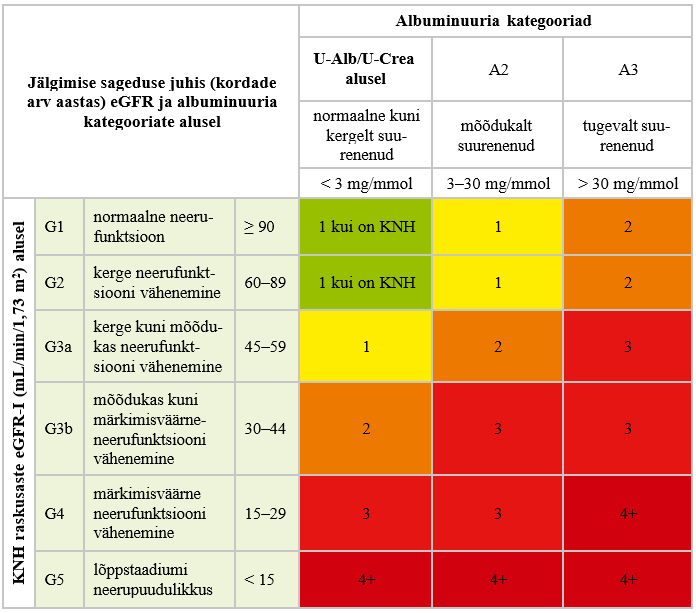
Tabelis on märgitud KNH progresseerumise risk sõltuvalt selle raskusastmest. Ruutudes olevad numbrid tähendavad jälgimise sagedust aastas. Roheline tähistab haiguse stabiilset kulgu, mille puhul tuleb KNH esinemisel analüüse teha kord aastas. Kollane tähistab suuremat riski: analüüsid tuleks teha vähemalt kord aastas. Oranži tähistuse korral on vaja analüüse teha kaks korda, punase puhul kolm korda ja tumepunase korral neljal või rohkemal korral aastas (vähemalt iga 1–3 kuu järel). Need on üldised parameetrid, mis tuginevad ekspertide arvamusele. Arvestada tuleb iga üksiku patsiendi kaasnevaid haigusi ja üldseisundit, sh mõju patsiendi edasisele käsitlusele.
Lisa 4. Kroonilise neeruhaigusega patsiendi suunamine nefroloogi vastuvõtule
Kohandatud KDIGO 2012. aasta ravijuhendist (2)

Kasutatud kirjandus
- Alkoholitarvitamise häirega patsiendi käsitlus, RJ-F/7.2-2020. Ravijuhend. Eesti Haigekassa. 2021.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter. 2013;3:1–150.
- Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter. 2012;2:1–138.
- Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl (2011). 2022;12(1):7.
- Rhee CM, Kovesdy CP. Spotlight on CKD deaths—increasing mortality worldwide. Nat Rev Nephrol. 2015 Apr;11(4):199–200.
- Vanholder R, Annemans L, Brown E, et al. Reducing the costs of chronic kidney disease while delivering quality health care: a call to action. Nat Rev Nephrol. 2017;13(7):393–409.
- Astley ME, Boenink R, ElHafeez SA, et al. The ERA Registry Annual Report 2020: a summary. Clin Kidney J. 2023;10:37.
- Estonian Health Insurance Fund. Estonian Handbook for Guidelines Development 2020. 2021.
- National Clinical Guideline Centre; National Institute for Health and Care Excellence. Chronic Kidney Disease (Partial Update). Early identification and management of chronic kidney disease in adults in primary and secondary care. National Clinical Guideline Centre. 2014;1–447.
- Wu HY, Huang JW, Peng Y Sen, et al. Microalbuminuria screening for detecting chronic kidney disease in the general population: a systematic review. Ren Fail. 2013;35(5):607–14.
- Komenda P, Ferguson TW, Macdonald K, et al. Costeffectiveness of primary screening for CKD: a systematic review. Am J Kidney Dis. 2014;63(5):789–97.
- Thomas G, Sehgal AR, Kashyap SR, et al. Metabolic syndrome and kidney disease: a systematic review and meta-analysis. Clin J Am Soc Nephrol. 2011;6(10):2364–73.
- Johnson DW, Atai E, Chan M, et al. KHA-CARI guideline: Early chronic kidney disease: detection, prevention and management. Nephrology (Carlton). 2013;18(5):340–50.
- Scottish Intercollegiate Guidelines Network: Diagnosis and management of chronic kidney disease. A national clinical guideline 103. 2008.
- Academy of Medicine of Malaysia. Management of Chronic Kidney Disease. 2011.
- Hillege HL, Fidler V, Diercks GFH, et al. Urinary albumin excretion predicts cardiovascular and noncardiovascular mortality in general population. Circulation. 2002;106(14):1777–82.
- Asselbergs FW, Diercks GFH, Hillege HL, et al. Effects of fosinopril and pravastatin on cardiovascular events in subjects with microalbuminuria. Circulation. 2004;110(18):2809–16.
- Hui X, Matsushita K, Sang Y, et al. CKD and cardiovascular disease in the Atherosclerosis Risk in Communities (ARIC) study: interactions with age, sex, and race. Am J Kidney Dis. 2013;62(4):691–702.
- Quinn MP, Cardwell CR, Kee F, et al. The finding of reduced estimated glomerular filtration rate is associated with increased mortality in a large UK population. Nephrol Dial Transplant. 2011;26(3):875–80.
- Viswanathan G, Sarnak MJ, Tighiouart H, et al. The association of chronic kidney disease complications by albuminuria and glomerular filtration rate: a cross-sectional analysis. Clin Nephrol. 2013;80(1):29.
- Kondo M, Yamagata K, Hoshi SL, et al. Costeffectiveness of chronic kidney disease mass screening test in Japan. Clin Exp Nephrol. 2012;16(2):279–91.
- van Pottelbergh G, van Heden L, Matheï C, et al. Methods to evaluate renal function in elderly patients: a systematic literature review. Age Ageing. 2010;39(5):542–8.
- Soveri I, Berg UB, Björk J, et al. Measuring GFR: a systematic review. Am J Kidney Dis. 2014;64(3):411–24.
- Zou LX, Sun L, Nicholas SB, et al. Comparison of bias and accuracy using cystatin C and creatinine in CKD-EPI equations for GFR estimation. Eur J Intern Med. 2020;80:29–34.
- Li J, Xu X, Luo J, et al. Choosing an appropriate glomerular filtration rate estimating equation: role of body mass index. BMC Nephrol [Internet]. 2021;22(1).
- Björk J, Grubb A, Gudnason V, et al. Comparison of glomerular filtration rate estimating equations derived from creatinine and cystatin C: validation in the Age, Gene/Environment Susceptibility-Reykjavik elderly cohort. Nephrology Dialysis Transplantation. 2018;33(8):1380.
- Fabian J, Kalyesubula R, Mkandawire J, et al. Measurement of kidney function in Malawi, South Africa, and Uganda: a multicentre cohort study. Lancet Glob Health. 2022;10(8):e1159–69.
- Delanaye P, Schaeffner E, Cozzolino M, et al. The new, racefree, Chronic Kidney Disease Epidemiology Consortium (CKD-EPI) equation to estimate glomerular filtration rate: is it applicable in Europe? A position statement by the European Federation of Clinical Chemistry and Laboratory Medicine (EFLM). Clin Chem Lab Med. 2022;61(1):44–7.
- Kiortsis DN, Christou MA. Management of Obesity-Induced Kidney Disease: A Critical Review of the Literature. Obes Facts [Internet]. 2012;5(6):821–32.
- Van Huffel L, Tomson CRV, Ruige J, et al. Dietary Restriction and Exercise for Diabetic Patients with Chronic Kidney Disease: A Systematic Review. PLoS One. 2014 Nov 25;9(11):e113667.
- McMahon EJ, Bauer JD, Hawley CM, et al. A randomized trial of dietary sodium restriction in CKD. J Am Soc Nephrol. 2013;24(12):2096–103.
- Ash S, Campbell KL, Bogard J, et al. Nutrition Prescription to Achieve Positive Outcomes in Chronic Kidney Disease: A Systematic Review. Nutrients. 2014;6(1):416.
- Ricardo AC, Madero M, Yang W, et al. Adherence to a healthy lifestyle and all-cause mortality in CKD. Clin J Am Soc Nephrol. 2013;8(4):602–9.
- Tubaka- või nikotiinitoodetest loobumise nõustamine, RJ-Z/56.1-2021. Ravijuhendite nõukoda. 2021.
- Matsushita K, van der Velde M, Astor BC, et la. Association of estimated glomerular filtration rate and albuminuria with allcause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010;375(9731):2073–81.
- Gallagher H, De Lusignan S, Harris K, et al. Quality-improvement strategies for the management of hypertension in chronic kidney disease in primary care: a systematic review. The British Journal of General Practice. 2010;60(575):e258.
- Landray MJ, Emberson JR, Blackwell L, et al. Prediction of ESRD and death among people with CKD: the Chronic Renal Impairment in Birmingham (CRIB) prospective cohort study. Am J Kidney Dis. 2010;56(6):1082–94.
- Muntner P, Judd SE, Gao L, et al. Cardiovascular risk factors in CKD associate with both ESRD and mortality. Journal of the American Society of Nephrology. 2013;24(7):1159–65.
- Visseren FLJ, MacH F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42(34):3227–337.
- Roett M, Liegl S, Jabbarpour Y. Diabetic nephropathy--the family physician’s role. Am Fam Physician. 2012.
- Rocco MV, Berns JS. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 Update. Am J Kidney Dis. 2012;60(5):850–86.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for Glomerulonephritis. Kidney inter. 2012;2:137–274.
- Lv J, Ehteshami P, Sarnak MJ, et al. Effects of intensive blood pressure lowering on the progression of chronic kidney disease: A systematic review and meta-analysis. CMAJ Canadian Medical Association Journal. 2013;185(11):949–57.
- Cheung AK, Chang TI, Cushman WC, et al. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021;99(3S):S1–87.
- Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertensionThe Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH). Eur Heart J. 2018;39(33):3021–104.
- Cheung AK, Rahman M, Reboussin DM, et al. Effects of Intensive BP Control in CKD. J Am Soc Nephrol. 2017;28(9):2812–23.
- Beddhu S, Rocco M V, Toto R, et al. Effects of Intensive Systolic Blood Pressure Control on Kidney and Cardiovascular Outcomes in Persons Without Kidney Disease: A Secondary Analysis of a Randomized Trial. Ann Intern Med. 2017;167(6):375–83.
- Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 7. Effects of more vs. less intensive blood pressure lowering and different achieved blood pressure levels — updated overview and meta-analyses of randomized trials. J Hypertens. 2016;34(4):613–22.
- ACCORD Study Group; Cushman WC, Evans GW, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010;362(17):1575–85.
- SPRINT Research Group; Wright JT Jr, Williamson JD, et al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015;373(22):2103–16.
- Gerstein HC, Mann JFE, Yi Q, et al. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA. 2001;286(4):421–6.
- Brenner BM, Cooper ME, de Zeeuw D, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med. 2001;345(12):861–9.
- Chowdhury EK, Langham RG, Ademi Z, et al. Rate of change in renal function and mortality in elderly treated hypertensive patients. Clin J Am Soc Nephrol. 2015;10(7):1154–61.
- Clase CM, Barzilay J, Gao P, et al. Acute change in glomerular filtration rate with inhibition of the renin-angiotensin system does not predict subsequent renal and cardiovascular outcomes. Kidney Int. 2017;91(3):683–90.
- Matsushita K, Selvin E, Bash LD, et al. Change in estimated GFR associates with coronary heart disease and mortality. J Am Soc Nephrol. 2009;20(12):2617–24.
- Ruospo M, Saglimbene VM, Palmer SC, De Cosmo S, Pacilli A, Lamacchia O, et al. Glucose targets for preventing diabetic kidney disease and its progression. Cochrane Database Syst Rev. 2017;6(6).
- KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2020;98(4S):S1–115.
- Mottl AK, Buse JB, Ismail-Beigi F, Sigal RJ, Pedley CF, Papademetriou V, et al. LongTerm Effects of Intensive Glycemic and Blood Pressure Control and Fenofibrate Use on Kidney Outcomes. Clin J Am Soc Nephrol. 2018;13(11):1693–702.
- National Institute for Health and Care Excellence. Diagnosis and management of type 1 diabetes in children, young people and adults | Guidance. NICE. 2015.
- National Institute for Health and Care Excellence (NICE). Type 1 Diabetes in Adults: Diagnosis and Management. Type 1 Diabetes in Adults: Diagnosis and Management. 2015;1–89.
- The Kidney Health Australia – Caring for Australians with Renal Impairment (KHA-CARI ) Guideline. Type 2 Diabetes: Kidney Disease. 2010
- Slinin Y, Ishani A, Rector T, Fitzgerald P, MacDonald R, Tacklind J, et al. Management of Hyperglycemia, Dyslipidemia, and Albuminuria in Patients With Diabetes and CKD: A Systematic Review for a KDOQI Clinical Practice Guideline. American Journal of Kidney Diseases. 2012;60(5):747–69.
- Li L, Yang C, Zhao Y, Zeng X, Liu F, Fu P. Is hyperuricemia an independent risk factor for newonset chronic kidney disease?: A systematic review and meta-analysis based on observational cohort studies. BMC Nephrol. 2014;15(1).
- Zhu P, Liu Y, Han L, Xu G, Ran JM. Serum uric acid is associated with incident chronic kidney disease in middle-aged populations: a meta-analysis of 15 cohort studies. PLoS One. 2014;9(6).
- Sedaghat S, Hoorn EJ, Van Rooij FJA, Hofman A, Franco OH, Witteman JCM, et al. Serum uric acid and chronic kidney disease: the role of hypertension. PLoS One. 2013;8(11).
- Kanji T, Gandhi M, Clase CM, Yang R. Urate lowering therapy to improve renal outcomes in patients with chronic kidney disease: systematic review and meta-analysis. BMC Nephrol. 2015;16(1).
- Zhang YF, He F, Ding HH, Dai W, Zhang Q, Luan H, et al. Effect of uricacid lowering therapy on progression of chronic kidney disease: a meta-analysis. Journal of Huazhong University of Science and Technology - Medical Science. 2014;34(4):476–81.
- Bose B, Badve SV, Hiremath SS, Boudville N, Brown FG, Cass A, et al. Effects of uric acidlowering therapy on renal outcomes: a systematic review and meta-analysis. Nephrol Dial Transplant. 2014;29(2):406–13.
- Fleeman N, Pilkington G, Dundar Y, Dwan K, Boland A, Dickson R, et al. Allopurinol for the treatment of chronic kidney disease: a systematic review. Health Technol Assess (Rockv). 2014;18(40).
- Thurston MM, Phillips BB, Bourg CA. Safety and efficacy of allopurinol in chronic kidney disease. Ann Pharmacother. 2013;47(11):1507–16.
- Curiel R V., Guzman NJ. Challenges associated with the management of gouty arthritis in patients with chronic kidney disease: a systematic review. Semin Arthritis Rheum. 2012;42(2):166–78.
- Sapankaew T, Thadanipon K, Ruenroengbun N, Chaiyakittisopon K, Ingsathit A, Numthavaj P, et al. Efficacy and safety of uratelowering agents in asymptomatic hyperuricemia: systematic review and network meta-analysis of randomized controlled trials. BMC Nephrol. 2022;23(1):1–10.
- Chewcharat A, Chen Y, Thongprayoon C, Harrison AM, Mao MA, Cheungpasitporn W. Febuxostat as a renoprotective agent for treatment of hyperuricaemia: a meta-analysis of randomised controlled trials. Intern Med J. 2021;51(5):752–62.
- Chen Q, Wang Z, Zhou J, Chen Z, Li Y, Li S, et al. Effect of uratelowering therapy on cardiovascular and kidney outcomes: A systematic review and meta-analysis. Clinical Journal of the American Society of Nephrology. 2020;15(11):1576–86.
- Zhang L, An K, Mou X, Zhang M, Su Q, Li S. Effect of UrateLowering Therapy on the Progression of Kidney Function in Patients With Asymptomatic Hyperuricemia: A Systematic Review and Meta-Analysis. Front Pharmacol. 2022;12.
- Palmer SC, Hayen A, Macaskill P, Pellegrini F, Craig JC, Elder GJ, et al. Serum levels of phosphorus, parathyroid hormone, and calcium and risks of death and cardiovascular disease in individuals with chronic kidney disease: a systematic review and meta-analysis. JAMA. 2011;305(11):1119–27.
- Adeney KL, Siscovick DS, Ix JH, Seliger SL, Shlipak MG, Jenny NS, et al. Association of serum phosphate with vascular and valvular calcification in moderate CKD. J Am Soc Nephrol. 2009;20(2):381–7.
- Inker LA, Coresh J, Levey AS, Tonelli M, Muntner P. Estimated GFR, albuminuria, and complications of chronic kidney disease. J Am Soc Nephrol. 2011;22(12):2322–31.
- Levin A, Bakris GL, Molitch M, Smulders M, Tian J, Williams LA, et al. Prevalence of abnormal serum vitamin D, PTH, calcium, and phosphorus in patients with chronic kidney disease: results of the study to evaluate early kidney disease. Kidney Int. 2007;71(1):31–8.
- NHANES. The Third National Health and Nutrition Examination Survey. 1994.
- Stauffer ME, Fan T. Prevalence of anemia in chronic kidney disease in the United States. PLoS One. 2014;9(1).
- Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney inter. 2012;2:279–335.
- National Clinical Guideline Centre; National Institute for Health and Care Excellence. Anaemia Management in Chronic Kidney Disease. Anaemia Management in Chronic Kidney Disease: Partial Update 2015. 2015.
- Palaka E, Grandy S, Van Haalen H, McEwan P, Darlington O. The Impact of CKD Anaemia on Patients: Incidence, Risk Factors, and Clinical Outcomes-A Systematic Literature Review. Int J Nephrol. 2020.
- Mikhail A, Brown C, Williams JA, Mathrani V, Shrivastava R, Evans J, et al. Renal association clinical practice guideline on Anaemia of Chronic Kidney Disease. BMC Nephrol. 2017;18(1).
- Excellence Care and Health for Institute National. Chronic kidney disease: assessment and management. Chronic kidney disease: assessment and management. 2021;203:1–72.
- Batchelor EK, Kapitsinou P, Pergola PE, Kovesdy CP, Jalal DI. Iron Deficiency in Chronic Kidney Disease: Updates on Pathophysiology, Diagnosis, and Treatment. J Am Soc Nephrol. 2020;31(3):456–68.
- Vejakama P, Thakkinstian A, Lertrattananon D, Ingsathit A, Ngarmukos C, Attia J. Renoprotective effects of renin–angiotensin system blockade in type 2 diabetic patients: a systematic review and network meta-analysis. Diabetologia. 2012;55(3):566.
- Wühl E, Schaefer F. Managing kidney disease with blood-pressure control. Nat Rev Nephrol. 2011;7(8):434–44.
- Palmer SC, Mavridis D, Navarese E, Craig JC, Tonelli M, Salanti G, et al. Comparative efficacy and safety of blood pressurelowering agents in adults with diabetes and kidney disease: a network meta-analysis. Lancet. 2015;385(9982):2047–56.
- Weir MR, Rolfe M. Potassium homeostasis and renin-angiotensin-aldosterone system inhibitors. Clin J Am Soc Nephrol. 2010;5(3):531–48.
- Mann JF, Schmieder RE, McQueen M, Dyal L, Schumacher H, Pogue J, et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double- blind, controlled trial. Lancet. 2008;372(9638):547–53.
- Maione A, Navaneethan SD, Graziano G, Mitchell R, Johnson D, Mann JFE, et al. Angiotensin-converting enzyme inhibitors, angiotensin receptor blockers and combined therapy in patients with micro- and macroalbuminuria and other cardiovascular risk factors: a systematic review of randomized controlled trials. Nephrol Dial Transplant. 2011;26(9):2827–47
- Ng KP, Arnold J, Sharif A, Gill P, Townend JN, Ferro CJ. Cardiovascular actions of mineralocorticoid receptor antagonists in patients with chronic kidney disease: A systematic review and meta-analysis of randomized trials. J Renin Angiotensin Aldosterone Syst. 2015;16(3):599–613.
- Mavrakanas TA, Gariani K, Martin PY. Mineralocorticoid receptor blockade in addition to angiotensin converting enzyme inhibitor or angiotensin II receptor blocker treatment: an emerging paradigm in diabetic nephropathy: a systematic review. Eur J Intern Med. 2014;25(2):173–6.
- Baigent C, Emberson JR, Haynes R, Herrington WG, Judge P, Landray MJ, et al. Impact of diabetes on the effects of sodium glucose cotransporter2 inhibitors on kidney outcomes: collaborative meta-analysis of large placebo- controlled trials. Lancet. 2022;400(10365):1788–801.
- Tsai WC, Hsu SP, Chiu YL, Yang JY, Pai MF, Ko MJ, et al. Cardiovascular and renal efficacy and safety of sodiumglucose cotransporter2 inhibitors in patients without diabetes: a systematic review and meta-analysis of randomised placebo-controlled trials. BMJ Open. 2022;12(10).
- The EMPA-KIDNEY Collaborative Group; Herrington WG, Staplin N, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2023;388(2):117–27.
- Chung EYM, Ruospo M, Natale P, et al. Aldosterone antagonists in addition to renin angiotensin system antagonists for preventing the progression of chronic kidney disease. Cochrane Database Syst Rev. 2020;10(10).
- Mehdi UF, Adams-Huet B, Raskin P, et al. Addition of angiotensin receptor blockade or mineralocorticoid antagonism to maximal angiotensin- converting enzyme inhibition in diabetic nephropathy. J Am Soc Nephrol. 2009;20(12):2641–50.
- Guney I, Selcuk NY, Altintepe L, et al. Antifibrotic effects of aldosterone receptor blocker (spironolactone) in patients with chronic kidney disease. Ren Fail. 2009;31(9):779–84.
- Ogawa S, Takeuchi K, Mori T, et al. Spironolactone further reduces urinary albumin excretion and plasma B-type natriuretic peptide levels in hypertensive type II diabetes treated with angiotensin-converting enzyme inhibitor. Clin Exp Pharmacol Physiol. 2006;33(5–6):477–9.
- Fogari R, Derosa G, Zoppi A, et al. Comparative effect of canrenone or hydrochlorothiazide addition to valsartan/amlodipine combination on urinary albumin excretion in well-controlled type 2 diabetic hypertensive patients with microalbuminuria. Expert Opin Pharmacother. 2014;15(4):453–9.
- Navaneethan SD, Nigwekar SU, Sehgal AR, et al. Aldosterone antagonists for preventing the progression of chronic kidney disease: a systematic review and meta-analysis. Clin J Am Soc Nephrol. 2009;4(3):542–51.
- Bakris GL, Agarwal R, Anker SD, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med. 2020;383(23):2219–29.
- Pitt B, Filippatos G, Agarwal R, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. New England Journal of Medicine. 2021;385(24):2252–63.
- Agrawal L, Azad N, Bahn GD, et al. Long-term follow-up of intensive glycaemic control on renal outcomes in the Veterans Affairs Diabetes Trial (VADT). Diabetologia. 2018;61(2):295–9.
- KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2022;102(5S):S1–127.
- Palmer SC, Craig JC, Navaneethan SD, et al. Benefits and harms of statin therapy for persons with chronic kidney disease: a systematic review and meta-analysis. Ann Intern Med [Internet]. 2012;157(4):263–75.
- Hou W, Lv JA, Perkovic V, et al. Effect of statin therapy on cardiovascular and renal outcomes in patients with chronic kidney disease: a systematic review and meta-analysis. Eur Heart J. 2013;34(24).
- Barylski M, Nikfar S, Mikhailidis DP, et al. Statins decrease all-cause mortality only in CKD patients not requiring dialysis therapy — a meta- analysis of 11 randomized controlled trials involving 21,295 participants. Pharmacol Res. 2013;72:35–44.
- Zhang X, Xiang C, Zhou YH, et al. Effect of statins on cardiovascular events in patients with mild to moderate chronic kidney disease: A systematic review and meta-analysis of randomized clinical trials. BMC Cardiovasc Disord. 2014;14(1):1–12.
- Palmer SC, Navaneethan SD, Craig JC, et al. HMG CoA reductase inhibitors (statins) for people with chronic kidney disease not requiring dialysis. Cochrane Database Syst Rev. 2014;2014(5).
- Yan YL, Qiu B, Wang J, et al. High-intensity statin therapy in patients with chronic kidney disease: a systematic review and meta-analysis. BMJ Open. 2015;5(5).
- Piepoli MF, Hoes AW, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts)Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur Heart J. 2016;37(29):2315–81.
- Wanner C, Tonelli M. KDIGO Clinical Practice Guideline for Lipid Management in CKD: summary of recommendation statements and clinical approach to the patient. Kidney Int. 2014;85(6):1303–9.
- National Institute for Health and Clinical Excellence. Lipid Modification. Cardiovascular Risk Assessment and the Modification of Blood Lipids for the Primary and Secondary Prevention of Cardiovascular Disease. NICE clinical guideline 181. 2014;12(July):231–54.
- Hwang SD, Kim K, Kim YJ, et al. Effect of statins on cardiovascular complications in chronic kidney disease patients: A network meta-analysis. Medicine. 2020 May 29 [cited 2023 Jun 4];99(22):e20061.
- Navarese EP, Robinson JG, Kowalewski M, et al. Association Between Baseline LDL-C Level and Total and Cardiovascular Mortality After LDL-C Lowering: A Systematic Review and Meta-analysis. JAMA. 2018;319(15):1566–79.
- Baigent C, Landray MJ, Reith C, Emberson J, Wheeler DC, Tomson C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet. 2011;377(9784):2181–92.
- Stanifer JW, Charytan DM, White J, Lokhnygina Y, Cannon CP, Roe MT, et al. Benefit of ezetimibe added to simvastatin in reduced kidney function. Journal of the American Society of Nephrology. 2017;28(10):3034–43.
- Lu WR, Defilippi J, Braun A. Unleash metformin: reconsideration of the contraindication in patients with renal impairment. Ann Pharmacother. 2013;47(11):1488–97.
- Nye HJ, Herrington WG. Metformin: the safest hypoglycaemic agent in chronic kidney disease? Nephron Clin Pract. 2011;118(4).
- Inzucchi SE, Lipska KJ, Mayo H, et al. Metformin in patients with type 2 diabetes and kidney disease: a systematic review. JAMA. 2014;312(24):2668– 75.
- National Collaborating Centre for Chronic Conditions (UK). Type 2 Diabetes. Type 2 Diabetes: National Clinical Guideline for Management in Primary and Secondary Care (Update). 2008.
- Jardine MJ, Ninomiya T, Perkovic V, et al. Aspirin is beneficial in hypertensive patients with chronic kidney disease: a post-hoc subgroup analysis of a randomized controlled trial. J Am Coll Cardiol. 2010;56(12):956–65.
- Kim AJ, Lim HJ, Ro H, et al. Low-dose aspirin for prevention of cardiovascular disease in patients with chronic kidney disease. PLoS One. 2014;9(8).
- Wali RK. Aspirin and the Prevention of Cardiovascular Disease in Chronic Kidney Disease. J Am Coll Cardiol. 2010;56(12):966–8.
- Ovbiagele B, Goldstein LB, Higashida RT, et al. Forecasting the future of stroke in the United States: a policy statement from the American Heart Association and American Stroke Association. Stroke. 2013 ;44(8):2361–75.
- Kimachi M, Furukawa TA, Kimachi K, Goto Y, Fukuma S, Fukuhara S. Direct oral anticoagulants versus warfarin for preventing stroke and systemic embolic events among atrial fibrillation patients with chronic kidney disease. Cochrane Database Syst Rev. 2017 Nov 6;11(11).
- Parker K, Hartemink J, Saha A, et al. A systematic review of the efficacy and safety of anticoagulants in advanced chronic kidney disease. J Nephrol. 2022;35(8):2015–33.
- Malhotra K, Ishfaq MF, Goyal N, Katsanos AH, Parissis J, Alexandrov AW, et al. Oral anticoagulation in patients with chronic kidney disease: A systematic review and meta-analysis. Neurology. 2019;92(21):e2421–31.
- Rhee TM, Lee SR, Choi EK, Oh S, Lip GYH. Efficacy and Safety of Oral Anticoagulants for Atrial Fibrillation Patients With Chronic Kidney Disease: A Systematic Review and Meta-Analysis. Front Cardiovasc Med. 2022;9.
- Sitticharoenchai P, Takkavatakarn K, Boonyaratavej S, Praditpornsilpa K, Eiam-Ong S, Susantitaphong P. Non-Vitamin K Antagonist Oral Anticoagulants Provide Less Adverse Renal Outcomes Than Warfarin In Non-Valvular Atrial Fibrillation: A Systematic Review and MetaAnalysis. J Am Heart Assoc. 2021;10(7).
- Kodade virvendusarütmia ravi- ja käsitlusjuhend. RJ I/27.1 2018. []. Ravijuhendite nõukoda. 2018.
- Adams KF, Ghali JK, Herbert Patterson J, et al. A perspective on re-evaluating digoxin’s role in the current management of patients with chronic systolic heart failure: targeting serum concentration to reduce hospitalization and improve safety profile. Eur J Heart Fail. 2014;16(5):483–93.
- Segall L, Nistor I, Covic A. Heart failure in patients with chronic kidney disease: a systematic integrative review. Biomed Res Int. 2014;2014.
- Chen R, Zou SL, Wang ML, et al. Population pharmacokinetics of digoxin in elderly patients. Eur J Drug Metab Pharmacokinet. 2013;38(2):115–21.
- Yukawa M, Yukawa E, Suematsu F, Takiguchi T, Ikeda H, Aki H, et al. Determination of digoxin clearance in Japanese elderly patients for optimization of drug therapy: a population pharmacokinetics analysis using nonlinear mixedeffects modelling. Drugs Aging. 2011;28(10):831–41.
- Kroonilise südamepuudulikkusega täiskasvanud patsiendi käsitlus esmatasandil. Ravijuhend. RJ-I/52.1-2021. Eesti Haigekassa. 2021.
- McDonagh TA, Metra M, Adamo M, Baumbach A, Böhm M, Burri H, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599–726.
- Nderitu P, Doos L, Jones PW, et al. Nonsteroidal antiinflammatory drugs and chronic kidney disease progression: a systematic review. Fam Pract. 2013;30(3):247–55.
- Pai MP, Rodvold KA. Aminoglycoside dosing in patients by kidney function and area under the curve: the Sawchuk-Zaske dosing method revisited in the era of obesity. Diagn Microbiol Infect Dis. 2014;78(2):178–87.
- Pagkalis S, Mantadakis E, Mavros MN, et al. Pharmacological considerations for the proper clinical use of aminoglycosides. Drugs. 2011;71(17):2277–94.
- Boyer A, Gruson D, Bouchet S, et al. Aminoglycosides in septic shock: an overview, with specific consideration given to their nephrotoxic risk. Drug Saf. 2013;36(4):217–30.
- Gálvez R, Luengo C, Cornejo R, et al. Higher than recommended amikacin loading doses achieve pharmacokinetic targets without associated toxicity. Int J Antimicrob Agents. 2011;38(2):146–51.
- Theodoratou E, Tzoulaki I, Zgaga L, Ioannidis JPA. Vitamin D and multiple health outcomes: umbrella review of systematic reviews and meta-analyses of observational studies and randomised trials. BMJ. 2014;348.
- Cusumano AM. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl. 2009;31(113):49–55.
- James MT, Samuel SM, Manning MA, et al. Contrast-induced acute kidney injury and risk of adverse clinical outcomes after coronary angiography: a systematic review and meta-analysis. Circ Cardiovasc Interv. 2013;6(1):37–43.
- Kooiman J, Pasha SM, Zondag W, et al. Meta-analysis: serum creatinine changes following contrast enhanced CT imaging. Eur J Radiol. 2012;81(10):2554–61.
- Kroneberger C, Enzweiler CN, Schmidt-Lucke A, et al. Contrast-induced nephropathy in patients with chronic kidney disease and peripheral arterial disease. Acta Radiol Open. 2015;4(6):205846011558303.
- Susantitaphong P, Eiam-Ong S. Nonpharmacological Strategies to Prevent Contrast-Induced Acute Kidney Injury. Biomed Res Int. 2014.
- Keaney JJ, Hannon CM, Murray PT. Contrast-induced acute kidney injury: how much contrast is safe? Nephrol Dial Transplant. 2013;28(6):1376–83.
- Lee J, Cho JY, Lee HJ, et al. Contrast-induced nephropathy in patients undergoing intravenous contrast-enhanced computed tomography in Korea: a multi-institutional study in 101487 patients. Korean J Radiol. 2014;15(4): 456–63.
- Andò G, De Gregorio C, Morabito G, et al. Renal function-adjusted contrast volume redefines the baseline estimation of contrastinduced acute kidney injury risk in patients undergoing primary percutaneous coronary intervention. Circ Cardiovasc Interv. 2014;7(4):465–72.
- Andreucci M, Faga T, Pisani A, et al. Acute kidney injury by radiographic contrast media: pathogenesis and prevention. Biomed Res Int. 2014.
- Andreucci M, Solomon R, Tasanarong A. Side effects of radiographic contrast media: pathogenesis, risk factors, and prevention. Biomed Res Int. 2014
- Lee J, Lee JP, Park JI, et al. Early nephrology referral reduces the economic costs among patients who start renal replacement therapy: a prospective cohort study in Korea. PLoS One. 2014;9(6).
- Yanay NB, Scherbakov L, Sachs D, et al. Effect of early nephrology referral on the mortality of dialysis patients in Israel - PubMed. Isr Med Assoc J. 2014;16(8):479–82.
- Van Zuilen AD, Bots ML, Dulger A, et al. Multifactorial intervention with nurse practitioners does not change cardiovascular outcomes in patients with chronic kidney disease. Kidney Int. 2012;82(6):710–7.
- van Zuilen A, Blankestijn P, van Buren M, et al. Nurse practitioners improve quality of care in chronic kidney disease: Two-year results of a randomised study. Neth J Med. 2011 Nov 1;69(11):517–26.
- Peeters MJ, Van Zuilen AD, Van Den Brand JAJG, et al. Nurse practitioner care improves renal outcome in patients with CKD. J Am Soc Nephrol. 2014;25(2):390–8.
- Smart NA, Titus TT. Outcomes of early versus late nephrology referral in chronic kidney disease: a systematic review. Am J Med. 2011;124(11): 1073–80.
- Chan MR, Dall AT, Fletcher KE, et al. Outcomes in patients with chronic kidney disease referred late to nephrologists: a meta-analysis. Am J Med. 2007;120(12).
- De Jager DJ, Voormolen N, Krediet RT, et al. Association between time of referral and survival in the first year of dialysis in diabetics and the elderly. Nephrol Dial Transplant. 2011;26(2):652–8.
- Wang SM, Hsiao LC, Ting IW, et al. Multidisciplinary care in patients with chronic kidney disease: A systematic review and meta-analysis. Eur J Intern Med. 2015;26(8):640–5.
- Chen YR, Yang Y, Wang SC, et al. Multidisciplinary care improves clinical outcome and reduces medical costs for pre-end-stage renal disease in Taiwan. Nephrology (Carlton) [Internet]. 2014;19(11):699–707.
- Chen YR, Yang Y, Wang SC, et al. Effectiveness of multidisciplinary care for chronic kidney disease in Taiwan: a 3-year prospective cohort study. Nephrol Dial Transplant. 2013;28(3):671–82.
- Chen PM, Lai TS, Chen PY, Lai CF, Yang SY, Wu VC, et al. Multidisciplinary care program for advanced chronic kidney disease: reduces renal replacement and medical costs. Am J Med. 2015;128(1):68–76.
- Cho EJ, Park HC, Yoon HB, et al. Effect of multidisciplinary predialysis education in advanced chronic kidney disease: Propensity score matched cohort analysis. Nephrology (Carlton). 2012;17(5):472–9.
- O’Connor NR, Kumar P. Conservative management of end-stage renal disease without dialysis: a systematic review. J Palliat Med. 2012;15(2):228–35.
- Pacilio M, Minutolo R, Garofalo C, et al. Stage 5-CKD under nephrology care: to dialyze or not to dialyze, that is the question. J Nephrol. 2016;29(2):153–61.
- Foote C, Kotwal S, Gallagher M, et al. Survival outcomes of supportive care versus dialysis therapies for elderly patients with end-stage kidney disease: A systematic review and meta-analysis. Nephrology (Carlton). 2016;21(3): 241–53.
- Song MK. Quality of Life of Patients with Advanced Chronic Kidney Disease Receiving Conservative Care without Dialysis. Semin Dial. 2016;29(2):165–9.
- The Kidney Health Australia – Caring for Australians with Renal Impairment (KHA-CARI) Guideline. Acceptance onto Dialysis Guidelines, Quality of life. 2010.
- The Kidney Health Australia – Caring for Australians withRenal Impairment (KHA-CARI) Guideline. Acceptance onto Dialysis Guidelines, Ethical considerations. 2010.
- The Kidney Health Australia – Caring for Australians with Renal Impairment (KHA-CARI) Guideline. Acceptance onto Dialysis Guidelines, Predialysis education. 2005.