Põletikulise liigeshaigusega patsiendi käsitlus esmatasandil
Ravijuhendi koostajad
Ravijuhendi töörühma liikmed
| Karin Laas | Reumatoloog, Ida-Tallinna Keskhaigla, Eesti Reumatoloogia Selts |
| Eve-Kai Raussi | Reumatoloog, Põhja-Eesti Regonaalhaigla, Eesti Reumatoloogia Selts |
| Chris Pruunsild | Vanemarst-õppejõud, Tartu Ülikooli Kliinikum, lastekliinik Lastehaiguste dotsent, Tartu Ülikool, meditsiiniteaduste valdkond, kliinilise meditsiini instituut, lastekliinik Eesti Reumatoloogia Selts, Eesti Lastearstide Selts |
| Külvi Peterson | Perearst, OÜ Perearst Külvi Peterson, Eesti Perearstide Selts |
| Anneli Virks | Perearst, perearstikeskus Jürgenson, Eesti Perearstide Selts |
| Eve Sooba | Taastusarst, Ida-Tallinna Keskhaigla, Eesti Taastusarstide Selts |
| Katti Kõrve | Reumatoloogiakeskuse õendusjuht, Ida-Tallinna Keskhaigla |
| Irina Tohus | Terviseõde, OÜ Meditiim, Eesti Õdede Liit |
| Annika Põder | Ravimite ja meditsiiniseadmete osakonna Spetsialist, Eesti Haigekassa |
| Lembe Kullamaa | Patsientide esindaja, Eesti Reumaliit |
Ravijuhendi sekretariaadi liikmed
| Liisi Sarapuu | Arst-resident reumatoloogia erialal, Eesti Reumatoloogia Selts |
| Cärolin Metusala | Arst-resident peremeditsiini erialal, Eesti Noored Perearstid |
| Siiri Paiste | Arst-resident peremeditsiini erialal, Eesti Noored Perearstid |
| Anna Tisler-Sala | Doktorant, Tartu Ülikooli peremeditsiini ja rahvatervishoiu instituut Laborispetsialist, Ida-Viru Keskhaigl |
Ravijuhendi metoodiline tugi
| Kaja-Triin Laisaar | Metoodikakonsultant, Tartu Ülikooli meditsiiniteaduste valdkonna ravijuhendite püsisekretariaat Epidemioloogia teadur, Tartu Ülikooli peremeditsiini ja rahvatervoshoiu instituut |
| Minni Saapar | Metoodikanõunik, Tartu Ülikooli meditsiiniteaduste valdkonna ravijuhendite püsisekretariaat |
| Kadi Kallavus | Metoodikanõunik, Tartu Ülikooli meditsiiniteaduste valdkonna ravijuhendite püsisekretariaat |
Lühendid ja mõisted
Lühendid
| CCP IgG | Tsüklilise tsitrulleeritud peptiidi vastase IgG hulk |
| ALAT | Alaniini aminotransferaas |
| ANA | Tuumavastased antikehad |
| AS | Anküloseeriv spondüliit |
| bHMR | Bioloogiline haigust modifitseeriv ravim ehk bioloogiline ravim |
| CRP | C-reaktiivne valk |
| DMARD | Disease modifying antirheumatic drug, haigust modifitseeriv antireumaatiline ravim (HMR) |
| ESR | Erütrotsüütide settekiirus |
| GKS | Glükokortikosteroid jub |
| HLA | Human leukocyte antigen, inimese leukotsüüdi antigeen |
| HMR | Haigust modifitseeriv antireumaatiline ravim |
| JIA | Juveniilne idiopaatiline artriit |
| MSPR | Mittesteroidne põletikuvastane ravim, nonsteroidal anti-inflammatory drug (NSAID) |
| PsA | Psoriaatiline artriit |
| RA | Reumatoidartriit |
| RF | Reumatoidfaktor |
| SpA | Spondüloartriit |
Mõisted
| Abivahend | Toode või vahend, mille abil on võimalik vähendada inimese vaevusi (nt valu) ja mis ennetab või pidurdab tervisekahjustuse süvenemist, aidates säilitada tegevus- ja töövõimet. |
| Bioloogiline ravim |
Ravim, mis sisaldab toimeainena elusorganismi toodetud või sellest saadud ainet ja mille tootmiseks on kasutatud biotehnoloogilisi meetodeid. Reumaatiliste haiguste ravis kasutatakse rekombinantse DNA-tehnoloogiaga saadud monoklonaalseid antikehi ja teisi rekombinantseid valke, mis blokeerivad haiguse mõne patogeneetilise lüli (tsütokiin või selle retseptor) ja sel viisil vähendavad organismis põletikku. |
| Esmane põletikuline liigesehaigus |
Esmane artriit, esimest korda diagnoositud põletikuline liigesehaigus. Käesolevas juhendis kuuluvad siia ka need patsiendid, kellel reumatoloog ei ole veel haiguse diagnoosi kinnitanud, kuid perearst kahtlustab põletikulist liigesehaigust. Põletikuliste liigesehaiguste hulka kuuluvad reumatoidartriit, spondüloartriidi rühma haigused (anküloseeriv spondüliit, psoriaatiline artriit, põletikulise soolehaigusega seostuv artriit, reaktiivne artriit), juveniilne idiopaatiline artriit. |
| Füsioteraapia |
Taastusravi osa, mis koosneb peamiselt terapeutilistest harjutustest (liikumisravist). Füsioteraapia eesmärk on täielikult või osaliselt taastada tugiaparaadi või organisüsteemi funktsionaalne võimekus. Füsioteraapiat korraldab füsioterapeut, kes nõustab patsienti abivahendite asjus ja õpetab neid kasutama. |
| Haigust modifitseeriv antireumaatiline ravim (HMR) |
HMR ehk disease-modifying anti-rheumatic drug (DMARD) on rühm ravimeid, mis toimivad immuunsüsteemi vahendusel, pärssides liigestes autoimmuunset põletikku. Ravi eesmärgiks on patsiendi kaebuste leevenemine ja liigesekahjustuse tekkimise vältimine. |
| Krooniline põletikuline liigesehaigus |
Reumatoloogi diagnoositud põletikuline liigesehaigus. Põletikuliste liigesehaiguste hulka kuuluvad reumatoidartriit, spondüloartriidi rühma haigused (anküloseeriv spondüliit, psoriaatiline artriit, põletikulise soolehaigusega seostuv artriit, reaktiivne artriit), juveniilne idiopaatiline artriit. |
| Monoartriit | Üht liigest haarav liigesepõletik |
| Oligoartriit | Kaht kuni nelja liigest haarav liigesepõletik |
| Polüartriit | Viit või rohkemat liigest haarav liigesepõletik |
| Seronegatiivne artriit | Liigesepõletik, mille puhul ei ole veres tuvastatav(ad) reumatoidfaktor (RF) ja/või tsüklilise tsitrulleeritud peptiidi antikehad (CCP IgG). |
| Seropositiivne artriit | Liigesepõletik, mille puhul on veres tuvastatav(ad) reumatoidfaktor (RF) ja/või tsüklilise tsitrulleeritud peptiidi antikehad (CCP IgG). |
| Spondüloartriidid | Põletikuliste liigesehaiguste rühm, kuhu kuuluvad anküloseeriv spondüliit (AS), psoriaatiline artriit (PsA), reaktiivne artriit ja põletikulise soolehaigusega seostuv artriit ning millele on iseloomulik perifeerne artriit ja/või sakroiliit koos spondüliidiga või ilma. |
| Taastusravi | Aktiivne raviliik, mis on suunatud häirunud funktsioonide optimaalsele taastamisele ja säilitamisele või puudega kohanemisele. Taastusravi planeerib ja koordineerib taastusarst. |
Tegevusteraapia |
Taastusravi osa, mis on suunatud tegevuspiirangutega inimeste iseseisvuse suurendamisele ja toimetuleku parandamisele. Tegevusteraapiat korraldab tegevusterapeut, kes nõustab patsiente abivahendite, kodukeskkonna kohanduste ja ergonoomika osas. Tegevusterapeut teeb ka käeteraapiat, nõustab käe- ja sõrmeortooside puhul ja valmistab vajaduse korral individuaalse(d) ortoosi(d). |
Sissejuhatus
Juhendi koostamise vajadus
Põletikulised liigesehaigused on rühm haiguseid, mida iseloomustab autoimmuunse põletiku esinemine liigestes ning mõnikord ka teistes kudedes ja organites. Põletikuliste liigesehaiguste hulka kuuluvatest haigustest esinevad kõige sagedamini reumatoidartriit (RA), juveniilne idiopaatiline artriit (JIA) ja spondüloartriit (SpA). Spondüloartriidid on rühm põletikulisi haiguseid, kuhu kuuluvad anküloseeriv spondüliit (AS), psoriaatiline artriit (PsA), reaktiivne artriit ja põletikulise soolehaigusega seostuv artriit. Selle rühma haigustele on iseloomulik perifeerne artriit ja/või sakroiliit koos spondüliidiga või ilma.
Kõige sagedasem põletikuline liigesehaigus Eestis on RA, mis avaldub tüüpiliselt sümmeetrilise polüartriidina. RA levimus Eestis on 0,46% (1). Kõige enam haigestuvad 55–74-aastased inimesed, naised kuni kolm korda sagedamini kui mehed (2).
JIA on lapseeas algav põletikuline liigesehaigus. Tavaliselt kulgeb JIA oligoartriidina, mõnevõrra harvem mono- või polüartriidina. Aastatel 1998–2000 Eestis tehtud JIA esmasjuhtude uuringu andmetel oli esmashaigestumus 21,7 juhtu 100 000 0–15-aastase lapse kohta (3). Kõige sagedamini haigestutakse väikelapse- või murdeeas.
Spondüloartriitidest kulgevad perifeerse artriidiga põhiliselt PsA, reaktiivne artriit ja põletikulise soolehaigusega seostuv artriit. AS haarab tüüpiliselt sakroiliakaalliigesed ja lülisamba, mõnikord ka perifeersed liigesed. Spondüloartriidid avalduvad tavaliselt oligoartriidina, PsA võib aga sageli kulgeda ka polüartriidina ja olla esialgu RA-st raskesti eristatav.
Kõikidele eelnimetatud põletikulistele liigesehaigustele on iseloomulik, et liigesepõletik võib viia liigesekahjustuste tekkeni ning sellest tulenevalt liigeste funktsioonihäireni ja haigestunute elukvaliteedi languseni. Liigesepõletikuga seonduv valu ja väljakujunenud liigesedeformatsioonid vähendavad oluliselt haigestunute töövõimet, muutes nad haiguse arenedes üha enam sõltuvaks kõrvalisest abist ja sotsiaalsüsteemist. Haiguse prognoos on viimaste aastakümnete jooksul siiski oluliselt paranenud tänu varasemale diagnoosimisele, uutele ravimitele ning arusaamale, et varane intensiivne ravi parandab prognoosi märgatavalt. Õigeaegse ravi korral jätkab patsient oma tavapärast elu ning säilitab töövõime ja iseseisva toimetuleku paljudeks aastateks.
Eestis on põletikuliste liigesehaiguste esmane diagnostika ja ravi jälgimine esmatasandi arstiabis kohati erinev, samuti ei ole patsiendi liikumine erinevate erialade esindajate vahel alati optimaalne.
Käesoleva juhendi eesmärk on ühtlustada tervishoiutöötajate teadmisi põletikuliste liigesehaiguste diagnostika ja ravi kohta, et soodustada haiguse kiiremat äratundmist. Samuti loodetakse käesoleva juhendiga tõhustada perearstide ja teiste erialade koostööd põletikuliste liigesehaigustega patsientide käsitlemisel ning kroonilise haiguse kontrolli all hoidmisel.
Kõige sagedasem põletikuline liigesehaigus Eestis on RA, mis avaldub tüüpiliselt sümmeetrilise polüartriidina. RA levimus Eestis on 0,46% (1). Kõige enam haigestuvad 55–74-aastased inimesed, naised kuni kolm korda sagedamini kui mehed (2).
JIA on lapseeas algav põletikuline liigesehaigus. Tavaliselt kulgeb JIA oligoartriidina, mõnevõrra harvem mono- või polüartriidina. Aastatel 1998–2000 Eestis tehtud JIA esmasjuhtude uuringu andmetel oli esmashaigestumus 21,7 juhtu 100 000 0–15-aastase lapse kohta (3). Kõige sagedamini haigestutakse väikelapse- või murdeeas.
Spondüloartriitidest kulgevad perifeerse artriidiga põhiliselt PsA, reaktiivne artriit ja põletikulise soolehaigusega seostuv artriit. AS haarab tüüpiliselt sakroiliakaalliigesed ja lülisamba, mõnikord ka perifeersed liigesed. Spondüloartriidid avalduvad tavaliselt oligoartriidina, PsA võib aga sageli kulgeda ka polüartriidina ja olla esialgu RA-st raskesti eristatav.
Kõikidele eelnimetatud põletikulistele liigesehaigustele on iseloomulik, et liigesepõletik võib viia liigesekahjustuste tekkeni ning sellest tulenevalt liigeste funktsioonihäireni ja haigestunute elukvaliteedi languseni. Liigesepõletikuga seonduv valu ja väljakujunenud liigesedeformatsioonid vähendavad oluliselt haigestunute töövõimet, muutes nad haiguse arenedes üha enam sõltuvaks kõrvalisest abist ja sotsiaalsüsteemist. Haiguse prognoos on viimaste aastakümnete jooksul siiski oluliselt paranenud tänu varasemale diagnoosimisele, uutele ravimitele ning arusaamale, et varane intensiivne ravi parandab prognoosi märgatavalt. Õigeaegse ravi korral jätkab patsient oma tavapärast elu ning säilitab töövõime ja iseseisva toimetuleku paljudeks aastateks.
Eestis on põletikuliste liigesehaiguste esmane diagnostika ja ravi jälgimine esmatasandi arstiabis kohati erinev, samuti ei ole patsiendi liikumine erinevate erialade esindajate vahel alati optimaalne.
Käesoleva juhendi eesmärk on ühtlustada tervishoiutöötajate teadmisi põletikuliste liigesehaiguste diagnostika ja ravi kohta, et soodustada haiguse kiiremat äratundmist. Samuti loodetakse käesoleva juhendiga tõhustada perearstide ja teiste erialade koostööd põletikuliste liigesehaigustega patsientide käsitlemisel ning kroonilise haiguse kontrolli all hoidmisel.
Ravijuhendi käsitlusala
Käesolev juhend keskendub põletikulistele liigesehaigustele nii 0–18-aastaste (k.a) laste kui ka täiskasvanute seas. Lapsed on käsitluse eripäradest tulenevalt jagatud kahte vanuserühma: kuni 7-aastased (k.a) ja 8–18-aastased. Põletikuliste liigesehaiguste all mõeldakse kõige sagedamini esinevaid kroonilisi artriite: reumatoidartriiti, laste puhul juveniilset idiopaatilist artriiti ning perifeerse artriidiga esinevaid spondüloartriidi SpA-rühma haigusi. Kõrvale on jäetud aksiaalse haaratusega SpA-vormid, erinevate sidekoehaigustega seostuvad artriidid ja metaboolsed artropaatiad (podagra, pseudopodagra, diabeetiline artropaatia).
Käesolev juhend on suunatud eelkõige esmatasandi tervishoiutöötajatele: perearstidele ja -õdedele ning erakorralise meditsiini osakonna arstidele. Juhend võib olla abiks ka teiste erialade esindajatele, kes oma igapäevatöös põletikulise liigesehaigusega patsientidega kokku puutuvad.
Juhendi esimene osa keskendub esmase põletikulise liigesehaiguse äratundmisele, esialgsele uuringuplaanile ja ravile ning patsiendi suunamisele teis(t)e eriala(de) spetsialisti(de) juurde. Eestis hetkel kehtiva korra järgi paneb põletikulise liigesehaiguse diagnoosi ning määrab haigusspetsiifilise ravi reumatoloog. Käesolevas juhendis ei käsitleta põletikuliste liigesehaiguste diagnoosimist ja ravi reumatoloogi juures. Juhendi teine osa käsitleb reumatoloogi diagnoositud kroonilise põletikulise liigesehaigusega patsiendi jälgimist esmatasandil.
Käesolev juhend on suunatud eelkõige esmatasandi tervishoiutöötajatele: perearstidele ja -õdedele ning erakorralise meditsiini osakonna arstidele. Juhend võib olla abiks ka teiste erialade esindajatele, kes oma igapäevatöös põletikulise liigesehaigusega patsientidega kokku puutuvad.
Juhendi esimene osa keskendub esmase põletikulise liigesehaiguse äratundmisele, esialgsele uuringuplaanile ja ravile ning patsiendi suunamisele teis(t)e eriala(de) spetsialisti(de) juurde. Eestis hetkel kehtiva korra järgi paneb põletikulise liigesehaiguse diagnoosi ning määrab haigusspetsiifilise ravi reumatoloog. Käesolevas juhendis ei käsitleta põletikuliste liigesehaiguste diagnoosimist ja ravi reumatoloogi juures. Juhendi teine osa käsitleb reumatoloogi diagnoositud kroonilise põletikulise liigesehaigusega patsiendi jälgimist esmatasandil.
Ravijuhendi koostamine
Ravijuhendi koostamine
Ravijuhendi koostamine algas 2018. aastal, mil teemaks oli reumatoidartriit ja selle ravi. Eesti Reumatoloogia Seltsiga arutades selgus aga, et eelkõige oleks Eestis vaja juhendit reumatoidartriidiga patsiendi käsitluse kohta esmatasandil. Mitme põletikulise liigesehaiguse esmased tunnused on sarnased ja täpse diagnoosi paneb reumatoloog. Seetõttu keskenduti juhendis põletikulise liigesehaiguse kahtlusega patsiendi käsitlusele esmatasandil enne reumatoloogi juurde saatmist. Samuti keskenduti kroonilise põletikulise liigesehaigusega patsiendi käsitlusele pärast seda, kui reumatoloog on patsiendil diagnoosinud reumatoidartriidi, juveniilse idiopaatilise artriidi või muu põletikulise liigesehaiguse ja määranud talle haigust modifitseeriva antireumaatilise ravi, millega on saavutatud haiguse remissioon ja patsient on taas perearsti juurde (jälgimisele) suunatud.
Juhendi koostamiseks moodustati töörühm ja sekretariaat, mille liikmed on esitatud ravijuhendi alguses. Liikmeteks olid asjakohaste kutsealade, patsientide ja Eesti Haigekassa esindajad.
Juhendi koostamist koordineeris Tartu Ülikooli meditsiiniteaduste valdkonna ravijuhendite püsisekretariaat. Püsisekretariaadi eestvõttel kogunesid juhendi koostajad esimest korda 7. veebruaril 2019. Ravijuhendite püsisekretariaadist nõustasid juhendi koostajaid metoodiliselt Kadi Kallavus, Minni Saapar ja Kaja-Triin Laisaar.
Tartu Ülikooli meditsiiniteaduste valdkonna ravijuhendite nõukoda kinnitas juhendi käsitlusala lõpliku versiooni 28. mail 2019. Käsitlusala sisaldas nelja PICO-formaadis kliinilist küsimust ja kümmet tervishoiukorralduslikku küsimust. Ravijuhendi käsitlusala, täisversioon, tõendusmaterjali kokkuvõtted, juhendi rakenduskava, koosolekute protokollid ja ravijuhendi koostajate huvide deklaratsioonide kokkuvõte on kättesaadavad veebiaadressil www.ravijuhend.ee.
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2017) põhimõtetest. Kliiniliste küsimuste arutamiseks, soovituste sõnastamiseks, tervishoiukorralduslikele küsimustele vastamiseks ja juhendi muude materjalide koostamiseks (patsientide suunamise algoritmid, patsientide jälgimise tabelid, juhendi rakenduskava) pidas töörühm kokku kaheksa koosolekut. Lisaks toimusid arutelud töörühma liikmetega elektroonselt.
Iga töörühma koosoleku alguses vaadati läbi töörühma ja sekretariaadi liikmete võimalike huvide konfliktide deklaratsioonid ja veenduti otsustajate kallutamatuses. Koosolek oli otsustusvõimeline, kui kohal oli vähemalt 2/3 töörühma liikmetest. Koosolekute otsused olid konsensuslikud.
Kliiniliste küsimuste kohta koostas sekretariaat töörühma koosolekuks tõendusmaterjali kokkuvõtte programmiga GRADEpro. Selleks analüüsiti olemasolevate ravijuhendite soovitusi ja nende aluseks olevat tõendusmaterjali, vajaduse korral ka juurde otsitud teadusuuringute tulemusi. Soovituste koostamisel arvestati lisaks teadusliku tõendusmaterjali tugevusele ka sekkumise kasu tervisele (sh potentsiaalse kasu ja kahju vahekorda), patsientide eelistusi ja väärtushinnanguid ja soovitusega kaasneda võivat patsientide ebavõrdsesse olukorda jätmist. Samuti arvestati võimalusi ja ressursse soovitatava tegevuse rakendamiseks Eesti kontekstis.
Tervishoiukorralduslikele küsimustele vastamiseks tegi sekretariaat kokkuvõtte teemakohasest infost juhendi koostamisel sõelale jäänud rahvusvahelistes ravijuhendites. Veel arvestati Eesti tervishoiusüsteemi eripärasid ja kehtivat kliinilist tava.
Ravijuhendit uuendatakse viis aastat pärast selle kinnitamist või uute oluliste teadusandmete lisandumise korral.
Töörühma otsusel ei koostatud ravijuhendiga koos infomaterjali patsiendile, sest enne reumatoloogi juurde suunamist on patsiendil vaid põletikulise liigesehaiguse kahtlus, mistõttu ei saa talle veel konkreetse haiguse ja sellega toimetulemise kohta juhiseid anda. Eestis on kõige sagedamini diagnoositud põletikuline liigesehaigus reumatoidartriit. Sellisel juhul sobib patsiendile 2008. aastal koostatud „Reumatoidartriit. Juhendmaterjal patsientidele“ (Tuvik 2008), mille ajakohastamist alustati 2019. aastal. Pärast valmimist tehakse ajakohastatud juhendmaterjal Eesti Reumatoloogia Seltsi kodulehel patsientidele kättesaadavaks.
Juhendi koostamiseks moodustati töörühm ja sekretariaat, mille liikmed on esitatud ravijuhendi alguses. Liikmeteks olid asjakohaste kutsealade, patsientide ja Eesti Haigekassa esindajad.
Juhendi koostamist koordineeris Tartu Ülikooli meditsiiniteaduste valdkonna ravijuhendite püsisekretariaat. Püsisekretariaadi eestvõttel kogunesid juhendi koostajad esimest korda 7. veebruaril 2019. Ravijuhendite püsisekretariaadist nõustasid juhendi koostajaid metoodiliselt Kadi Kallavus, Minni Saapar ja Kaja-Triin Laisaar.
Tartu Ülikooli meditsiiniteaduste valdkonna ravijuhendite nõukoda kinnitas juhendi käsitlusala lõpliku versiooni 28. mail 2019. Käsitlusala sisaldas nelja PICO-formaadis kliinilist küsimust ja kümmet tervishoiukorralduslikku küsimust. Ravijuhendi käsitlusala, täisversioon, tõendusmaterjali kokkuvõtted, juhendi rakenduskava, koosolekute protokollid ja ravijuhendi koostajate huvide deklaratsioonide kokkuvõte on kättesaadavad veebiaadressil www.ravijuhend.ee.
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2017) põhimõtetest. Kliiniliste küsimuste arutamiseks, soovituste sõnastamiseks, tervishoiukorralduslikele küsimustele vastamiseks ja juhendi muude materjalide koostamiseks (patsientide suunamise algoritmid, patsientide jälgimise tabelid, juhendi rakenduskava) pidas töörühm kokku kaheksa koosolekut. Lisaks toimusid arutelud töörühma liikmetega elektroonselt.
Iga töörühma koosoleku alguses vaadati läbi töörühma ja sekretariaadi liikmete võimalike huvide konfliktide deklaratsioonid ja veenduti otsustajate kallutamatuses. Koosolek oli otsustusvõimeline, kui kohal oli vähemalt 2/3 töörühma liikmetest. Koosolekute otsused olid konsensuslikud.
Kliiniliste küsimuste kohta koostas sekretariaat töörühma koosolekuks tõendusmaterjali kokkuvõtte programmiga GRADEpro. Selleks analüüsiti olemasolevate ravijuhendite soovitusi ja nende aluseks olevat tõendusmaterjali, vajaduse korral ka juurde otsitud teadusuuringute tulemusi. Soovituste koostamisel arvestati lisaks teadusliku tõendusmaterjali tugevusele ka sekkumise kasu tervisele (sh potentsiaalse kasu ja kahju vahekorda), patsientide eelistusi ja väärtushinnanguid ja soovitusega kaasneda võivat patsientide ebavõrdsesse olukorda jätmist. Samuti arvestati võimalusi ja ressursse soovitatava tegevuse rakendamiseks Eesti kontekstis.
Tervishoiukorralduslikele küsimustele vastamiseks tegi sekretariaat kokkuvõtte teemakohasest infost juhendi koostamisel sõelale jäänud rahvusvahelistes ravijuhendites. Veel arvestati Eesti tervishoiusüsteemi eripärasid ja kehtivat kliinilist tava.
Ravijuhendit uuendatakse viis aastat pärast selle kinnitamist või uute oluliste teadusandmete lisandumise korral.
Töörühma otsusel ei koostatud ravijuhendiga koos infomaterjali patsiendile, sest enne reumatoloogi juurde suunamist on patsiendil vaid põletikulise liigesehaiguse kahtlus, mistõttu ei saa talle veel konkreetse haiguse ja sellega toimetulemise kohta juhiseid anda. Eestis on kõige sagedamini diagnoositud põletikuline liigesehaigus reumatoidartriit. Sellisel juhul sobib patsiendile 2008. aastal koostatud „Reumatoidartriit. Juhendmaterjal patsientidele“ (Tuvik 2008), mille ajakohastamist alustati 2019. aastal. Pärast valmimist tehakse ajakohastatud juhendmaterjal Eesti Reumatoloogia Seltsi kodulehel patsientidele kättesaadavaks.
Tõendusmaterjali otsimine ja hindamine
Ravijuhendi koostamiseks otsiti tõendusmaterjali Eesti ravijuhendite käsiraamatu juhiste järgi. Esmalt otsiti alaseljavalu käsitlevaid tõenduspõhiseid ravijuhendeid. Ravijuhendite süstemaatilise otsingu tegi ravijuhendite püsisekretariaadi infokorralduse spetsialist. Läbi vaadati spetsiaalsed ravijuhendite andmebaasid, nt National Institute for Health and Care Excellence (http://www.nice.org.uk) ja Eesti ravijuhendite andmebaas (https://www.ravijuhend.ee/). Eelkõige otsiti arstiabi esmatasandile suunatud põletikulisi liigesehaiguseid käsitlevaid tõenduspõhiseid ravijuhendeid. Leitud asjakohaste ravijuhendite kvaliteeti hinnati tööriistaga AGREE II ja iga juhendit hindas teineteisest sõltumatult kaks sekretariaadi liiget.
Hinnangutes olulisi lahknevusi ei esinenud. Piisavalt kvaliteetseks hinnati 12 rahvusvahelist ravijuhendit.
Hinnangutes olulisi lahknevusi ei esinenud. Piisavalt kvaliteetseks hinnati 12 rahvusvahelist ravijuhendit.
- Van der Heijde D, Ramiro S, Landewé R, et al. 2016. Update of the ASAS-EULAR management recommendations for axial spondyloarthritis (van der Heijde 2017).
- Smolen JS, Landewé R, Bijlsma J, et al. 2016 update of the EULAR recommendations for the management of early arthritis (Smolen 2017).
- Rohekar S, Chan J, Tse SM, et al. 2014 update of the Canadian Rheumatology Association/Spondyloarthritis Research Consortium of Canada Treatment Recommendations for the Management of Spondyloarthritis. Part II: Specific Management Recommendations (Rohekar 2015).
- SIGN (Scottish Intercollegiate Guidelines Network). Diagnosis and management of psoriasis and psoriatic arthritis in adults [SIGN121] (SIGN 2010).
- ESPOGUIA (Sociedad Española de Reumatologia). Clinical guidelines for patients with spondyloarthritis. Sociedad Española de Reumatologia (ESPOGUIA 2015).
- SIGN. Management of early rheumatoid arthritis [SIGN123] (SIGN 2011).
- NICE (National Institute for Health and Clinical Excellence). Psoriasis assessment and management [CG153] (NICE 2012).
- NHMRC (National Health and Medical Research Council). Clinical guideline for the diagnosis and management of early rheumatoid arthritis (NHMRC 2009).
- Ward MM, Deodhar A, Akl EA, et al. American College of Rheumatology/ Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 recommendations for the treatment of ankylosing spondylitis and nonradiographic axial spondyloarthritis (Ward 2015).
- GPAC (Guidelines and Protocols and Advisory Committee). Guidelines and Protocols and Advisory Committee. Rheumatoid Arthritis: Diagnosis, Management and Monitoring (GPAC 2012).
- NICE. Rheumatoid arthritis in adults: management [NG100] (NICE 2018).
- NICE. Spondyloarthritis in over 16s: diagnosis and management [NG65] (NICE 2017).
Kaasatud juhendeis vaadati läbi koostatava juhendi käsitlusalaga haakuvad soovitused, nende aluseks olnud teaduslik tõendusmaterjal ning muud soovituse suunda ja tugevust mõjutanud kriteeriumid.
Vajaduse korral otsiti konkreetse kliinilise küsimusega seoses teaduskirjanduse e-andmebaasist PubMed süstemaatilisi ülevaateid ja metaanalüüse ning üksikuuringuid. Algselt ei piiratud otsingul uuringukavandit, kuid eelistati juhuslikustatud võrdlusrühmaga uuringuid. Leitud kirjete teemakohasust hinnati kõigepealt kirje pealkirja ja teeside alusel. Teemakohaseks peetud kirjete kohta võeti välja (artiklite) täistekstid.
Sekretariaat koostas iga kliinilise küsimuse kohta tõendusmaterjali kokkuvõtte tabeli, milles esitati asjakohaste teadusuuringute tulemused ja kvaliteedihinnang. Tõendusmaterjali kokkuvõtte tabelid (nr 1–3) on kättesaadavad ravijuhendite veebilehelt (www.ravijuhend.ee). Neis failides on esitatud ka tõendusmaterjali otsingu ja valiku ülevaade.
Soovitused sõnastas töörühm konsensuslikult nii teadusliku tõendusmaterjali kui ka teiste eespool nimetatud kriteeriumite põhjal. Iga soovituse põhjendus on kokkuvõtlikult kirjas juhendi tekstis soovituse järel.
Vajaduse korral otsiti konkreetse kliinilise küsimusega seoses teaduskirjanduse e-andmebaasist PubMed süstemaatilisi ülevaateid ja metaanalüüse ning üksikuuringuid. Algselt ei piiratud otsingul uuringukavandit, kuid eelistati juhuslikustatud võrdlusrühmaga uuringuid. Leitud kirjete teemakohasust hinnati kõigepealt kirje pealkirja ja teeside alusel. Teemakohaseks peetud kirjete kohta võeti välja (artiklite) täistekstid.
Sekretariaat koostas iga kliinilise küsimuse kohta tõendusmaterjali kokkuvõtte tabeli, milles esitati asjakohaste teadusuuringute tulemused ja kvaliteedihinnang. Tõendusmaterjali kokkuvõtte tabelid (nr 1–3) on kättesaadavad ravijuhendite veebilehelt (www.ravijuhend.ee). Neis failides on esitatud ka tõendusmaterjali otsingu ja valiku ülevaade.
Soovitused sõnastas töörühm konsensuslikult nii teadusliku tõendusmaterjali kui ka teiste eespool nimetatud kriteeriumite põhjal. Iga soovituse põhjendus on kokkuvõtlikult kirjas juhendi tekstis soovituse järel.
Ravijuhendi soovitused
| 1 | Põletikulise liigesehaiguse kahtlusega patsiendi esmasel visiidil võtke ja dokumenteerige põhjalik anamnees. Praktiline soovitus |
|
| 2 | Põletikulise liigesehaiguse kahtlusega patsiendi esmasel visiidil tehke ja dokumenteerige põhjalik objektiivne läbivaatus. Praktiline soovitus |
|
| 3 | Põletikulise liigesehaiguse kahtlusega täiskasvanud patsiendi esmasel visiidil tehke järgmised laboratoorsed uuringud: hemogramm 5-osalise leukogrammiga, settekiirus, CRP, ALAT, kreatiniin, reumatoidfaktor, CCP IgG ja uriini ribaanalüüs. Praktiline soovitus |
|
| 4 | Põletikulise liigesehaiguse kahtlusega 8–18-aastase lapse esmasel visiidil tehke järgmised laboratoorsed uuringud: hemogramm 5-osalise leukogrammiga, settekiirus, CRP ja uriini ribaanalüüs. Praktiline soovitus |
|
| 5 | Septilise artriidi kahtlusel suunake patsient kohe erakorralise meditsiini osakonda. Praktiline soovitus |
|
| 6 | Põletikulise liigesehaiguse kahtlusega täiskasvanud patsiendi puhul, kel on turses ja valusad labakäte ja/või labajalgade liigesed, võite esmasel visiidil teha röntgeniülesvõtted mõlemast labakäest ja/või labajalast suunaga eest taha. Praktiline soovitus |
|
| 7 | Põletikulise liigesehaiguse kahtlusega täiskasvanu ja 8–18-aastane laps, kel on turses ja valusad viis või enam liigest (polüartriit), suunake pärast esmasel visiidil tehtud analüüside tulemuste selgumist reumatoloogi või lastereumatoloogi e-konsultatsioonile. Tugev positiivne soovitus, madal tõendatuse aste |
|
| 8 | Põletikulise liigesehaiguse kahtlusega täiskasvanud patsient, kel on turses ja valusad üks kuni neli liigest (mono- või oligoartriit) ning kel on vereanalüüsis reumatoidfaktor positiivne (ja tsitrulliinivastased antikehad positiivsed), suunake pärast esmasel visiidil tehtud analüüside tulemuste selgumist reumatoloogi e-konsultatsioonile. Tugev positiivne soovitus, madal tõendatuse aste |
|
| 9 | Põletikulise liigesehaiguse kahtlusega 8–18-aastane laps, kel on turses ja valusad üks kuni neli liigest (mono- või oligoartriit), suunake pärast esmasel visiidil tehtud analüüside tulemuste selgumist lastereumatoloogi e-konsultatsioonile. Tugev positiivne soovitus, madal tõendatuse aste |
|
| 10 | |
Põletikulise liigesehaiguse kahtlusega kuni 7-aastane (k.a) laps suunake esmasel visiidil kohe lastereumatoloogi e-konsultatsioonile. Tugev soovitus, madal tõendatuse aste |
| 11 | Põletikulise liigesehaiguse kahtlusega patsiendi puhul alustage MSPR-iga põletiku- ja valuvastast ravi maksimaalses lubatud ööpäevases annuses. Praktiline soovitus |
|
| 12 | Põletikulise liigesehaiguse kahtlusega patsiendi esmasel visiidil ehk enne reumatoloogi või lastereumatoloogi e-konsultatsioonile suunamist ärge alustage süsteemset glükokortikosteroidravi. Praktiline soovitus |
|
| 13 | Põletikulise liigesehaiguse kahtlusega patsient, kel vaatamata esmasele adekvaatsele põletiku- ja valuvastasele ravile püsib valu ja/või funktsioonihäire üle ühe kuu, suunake taastusarsti e-konsultatsioonile, kus otsustatakse füsio- ja tegevusteraapia vajadus. Tugev positiivne soovitus, mõõdukas tõendatuse aste |
|
| 14 | Põletikulise liigesehaiguse kahtlusega patsiendile võite valu vähendamiseks soovitada abivahendeid. Nõrk positiivne soovitus, madal tõendatuse aste |
15 |
Kroonilise põletikulise liigesehaigusega täiskasvanud patsiendi puhul, kes saab HMR-ravi (sh bioloogilist ravi) ja kelle haigus on remissioonis, tehke kontrollanalüüsid iga kolme kuu järel, kui reumatoloog ei ole määranud teisiti. Praktiline soovitus |
|
| 16 |
Kroonilise põletikulise liigesehaigusega lapse puhul, kes saab HMR-ravi (sh bioloogilist ravi) ning kelle haigus on remissioonis, tehke kontrollanalüüsid üks kord kahe lastereumatoloogi vastuvõtu vahelisel perioodil ja mitte harvem kui iga 2–3 kuu järel, kui reumatoloog ei ole määranud teisiti. Praktiline soovitus |
|
| 17 |
Kroonilise põletikulise liigesehaigusega täiskasvanud patsiendil hinnake kardiovaskulaarseid riskitegureid üks kord aastas. Praktiline soovitus |
|
| 18 |
Kroonilise põletikulise liigesehaigusega täiskasvanud patsiendi puhul, kes vajab infektsiooni tõttu antibiootilist, antimükootilist või antiviraalset ravi, katkestage selle ajaks HMR-ravi (sh bioloogiline ravi). Praktiline soovitus |
|
| 19 |
Kroonilise põletikulise liigesehaigusega lapse puhul katkestage HMR-ravi (sh bioloogiline ravi) mistahes infektsiooni esmaste tunnuste ilmnemisel, ravi taasalustab lastereumatoloog. Praktiline soovitus |
|
| 20 |
Kroonilise põletikulise liigesehaigusega patsiendi infektsiooni korral MSPR-, glükokortikosteriod- ja valuravis muudatusi ärge tehke. Praktiline soovitus |
|
| 21 |
Kroonilise põletikulise liigesehaigusega patsiendi puhul, kes läheb plaanilisele operatsioonile, jätkake glükokortikosteroidravi. Praktiline soovitus |
| 22 |
Kroonilise põletikulise liigesehaigusega patsient, kes läheb plaanilisele liigese endoproteesimise või muule luu(de) või liiges(t)e operatsioonile, suunake aegsasti (vähemalt kaks kuud) enne operatsiooni taastusarsti e-konsultatsioonile. Praktiline soovitus |
|
| 23 |
Kroonilise põletikulise liigesehaigusega patsiendi puhul kontrollige, kas ta on ühe aasta jooksul pärast haiguse diagnoosimist jõudnud taastusarsti vastuvõtule. Kui ei, suunake patsient taastusarsti e-konsultatsioonile. Praktiline soovitus |
|
| 24 |
Kroonilise põletikulise liigesehaigusega patsiendi vaktsineerimisel järgige Eesti riiklikku immuniseerimiskava ja reumatoloogide soovitusi. Praktiline soovitus |
Põletikulise liigesehaiguse kahtlusega patsient
Ravijuhendi töörühm leidis, et esmalt on vaja põletikulist liigesehaigust eristada mittepõletikulistest liigesehaigustest (nt osteoartroosist). Selleks tuleb eelkõige kindlaks teha, kas patsiendi liigesekaebused piirduvad valuga või esineb lisaks valule ka liiges(t)e turse või hommikune jäikus. Samuti tuleb uurida, kas valu teket saab seostada koormusega ning kas objektiivsed näitajad viitavad põletikulisele (liigese)protsessile.
Põletikulisele liigesehaigusele viitavate kaebustega patsiendi esmakordsel esmatasandi arstile pöördumisel oluliseks peetavatest anamneesi ja objektiivse läbivaatuse osadest, analüüsidest ja uuringutest ülevaate saamiseks kasutas sekretariaat käesoleva juhendi koostamisel sõelale jäänud 12 ravijuhendit (juhendite loetelu vt juhendi ptk „Tõendusmaterjali otsimine ja hindamine“). Töörühm vaatas nende juhendite põhjal koostatud loetelud läbi ning jõudis arutelude käigus põletikulise liigesehaiguse kahtlusega patsiendi esmavisiidil tehtavate tegevuste asjus järgnevalt soovitustes 1–4 ja 6 esitatud järeldustele.
Põletikulisele liigesehaigusele viitavate kaebustega patsiendi esmakordsel esmatasandi arstile pöördumisel oluliseks peetavatest anamneesi ja objektiivse läbivaatuse osadest, analüüsidest ja uuringutest ülevaate saamiseks kasutas sekretariaat käesoleva juhendi koostamisel sõelale jäänud 12 ravijuhendit (juhendite loetelu vt juhendi ptk „Tõendusmaterjali otsimine ja hindamine“). Töörühm vaatas nende juhendite põhjal koostatud loetelud läbi ning jõudis arutelude käigus põletikulise liigesehaiguse kahtlusega patsiendi esmavisiidil tehtavate tegevuste asjus järgnevalt soovitustes 1–4 ja 6 esitatud järeldustele.
| 1 | Põletikulise liigesehaiguse kahtlusega patsiendi esmasel visiidil võtke ja dokumenteerige põhjalik anamnees. Praktiline soovitus |
Põletikulise liigesehaiguse kahtlusega patsiendilt anamneesi võttes peab esitama järgmised küsimused:
- millised liigesed valutavad (paluge loetleda);
- millised liigesed on turses (paluge loetleda);
- kas esineb hommikust liigesejäikust ning kui jah, siis kui kaua see kestab (minutites);
- kui kaua on liigesevaevused kestnud;
- kui tugev on valu 10-pallisel skaalal, kus 0 tähendab valu puudumist ja 10 talumatut valu;
- kas liigesevalule eelnes mingi provotseeriv tegevus/tegur, nt trauma, füüsiline koormus (töö, treeningud jne), äge infektsioon (sh kõhulahtisus), reis (kuhu);
- kas valu esineb rahuolekus (sh öösel) või on seotud mingi koormusega (paluge täpsustada);
- kas ja kuivõrd on häiritud igapäevased tegevused (nt ei saa asju haarata, nööpe kinni panna, juukseid kammida, arvutiga töötada, riietuda, jalale toetuda, trepist käia vm);
- kas patsient on liigesevalu tõttu kasutanud mingeid ravimeid ning kui jah, siis milline on olnud nende mõju;
- kas patsiendil on esinenud seljavalu ja/või on ta põdenud nahavõi suguhaigust, soolehaigust, silmapõletikku
- kas patsient on samade vaevustega ka varem arsti juures käinud ja/või on talle nende tõttu mingeid uuringuid tehtud (nt vereanalüüs, radioloogiline uuring);
- kas patsiendi lähisugulastel on olnud liigesehaigusi (paluge täpsustada) või psoriaasi;
- milliseid kroonilisi haiguseid patsient põeb (kõrgvererõhktõbi, diabeet, isheemiline südamehaigus, pahaloomuline kasvaja, neerupuudulikkus vm);
- milliseid ravimeid patsient igapäevaselt tarvitab (paluge loetleda)?
Samuti leidis töörühm, et patsiendi vastused kõigile eelnimetatud küsimustele (sh eitavad vastused) peab haigusloos dokumenteerima. Kui patsient suunatakse reumatoloogi juurde, peab kogu info olema kirjas ka e-konsultatsiooni vormis. Et juhendi koostamise ajal (2019. aasta lõpus) kasutatavas vormis ei ole kirjapandav info piisavalt täpselt määratletud, võeti juhendi rakenduskavva ühe rakendustegevusena reumatoloogi e-konsultatsiooni vormi korrigeerimine.
| 2 | Põletikulise liigesehaiguse kahtlusega patsiendi esmasel visiidil tehke ja dokumenteerige põhjalik objektiivne läbivaatus. Praktiline soovitus |
Töörühm leidis, et lisaks patsiendi kaebuste täpsustamisele on oluline tema seisundit ka objektiivselt hinnata. Leiti, et põletikulise liigesehaiguse kahtlusel on tavapärasele objektiivsele läbivaatusele (organsüsteemide kaupa) lisaks väga oluline kirjeldada patsiendi liigeste staatust.
Objektiivselt peab uurima ja dokumenteerima vähemalt need liigesed, mille valu, turse ja/või funktsioonihäire üle patsient kaebab. Kuni nelja liigese haaratuse puhul loetlege need, rohkemate liigeste haaratuse korral võib piirduda liigesepiirkondade nimetamisega.
Objektiivsel läbivaatusel tuleb hinnata liiges(t)e turselisust, välist muutust (nahavärvi muutus, deformatsioon), liikumisvõimet, palpatoorset valu ning lokaalset temperatuuri. Mitme liigese haaratuse korral peab kindlaks tegema, kas liigesed on haaratud sümmeetriliselt.
Samuti on oluline kirjeldada patsiendi limaskestade, naha ja küünte seisundit. Näiteks on haavandid suus ja/või tüüpiline lööve näol iseloomulikud süsteemsele luupusele, samas aitavad naha ja küünte muutused diagnoosida psoriaatilist artriiti (PsA-d).
Patsiendi objektiivse läbivaatuse tulemused (sh normile vastavad tulemused) peab haigusloos dokumenteerima. Kui patsient suunatakse reumatoloogi juurde, peab kogu info olema kirjas ka e-konsultatsiooni vormis.
Objektiivselt peab uurima ja dokumenteerima vähemalt need liigesed, mille valu, turse ja/või funktsioonihäire üle patsient kaebab. Kuni nelja liigese haaratuse puhul loetlege need, rohkemate liigeste haaratuse korral võib piirduda liigesepiirkondade nimetamisega.
Objektiivsel läbivaatusel tuleb hinnata liiges(t)e turselisust, välist muutust (nahavärvi muutus, deformatsioon), liikumisvõimet, palpatoorset valu ning lokaalset temperatuuri. Mitme liigese haaratuse korral peab kindlaks tegema, kas liigesed on haaratud sümmeetriliselt.
Samuti on oluline kirjeldada patsiendi limaskestade, naha ja küünte seisundit. Näiteks on haavandid suus ja/või tüüpiline lööve näol iseloomulikud süsteemsele luupusele, samas aitavad naha ja küünte muutused diagnoosida psoriaatilist artriiti (PsA-d).
Patsiendi objektiivse läbivaatuse tulemused (sh normile vastavad tulemused) peab haigusloos dokumenteerima. Kui patsient suunatakse reumatoloogi juurde, peab kogu info olema kirjas ka e-konsultatsiooni vormis.
| 3 | Põletikulise liigesehaiguse kahtlusega täiskasvanud patsiendi esmasel visiidil tehke järgmised laboratoorsed uuringud: hemogramm 5-osalise leukogrammiga, settekiirus, CRP, ALAT, kreatiniin, reumatoidfaktor, CCP IgG ja uriini ribaanalüüs. Praktiline soovitus |
|
| 4 | Põletikulise liigesehaiguse kahtlusega 8–18-aastase lapse esmasel visiidil tehke järgmised laboratoorsed uuringud: hemogramm 5-osalise leukogrammiga, settekiirus, CRP ja uriini ribaanalüüs. Praktiline soovitus |
Põletikulise liigesehaiguse kahtlusega täiskasvanud patsiendi puhul tuleb teha järgmised analüüsid:
- hemogramm 5-osalise leukogrammiga (nn kliiniline veri);
- settekiirus (ESR);
- CRP;
- RF (ja võimalusel ka CCP IgG);
- ALAT;
- kreatiniin;
- uriini ribaanalüüs.
Patsiendi seropositiivsuse määramisel soovitatakse lisaks RF-ile võimaluse korral määrata ka CCP IgG, sest osal RF-negatiivsetest patsientidest on positiivne ainult CCP IgG ning see võimaldab varasemat RA diagnoosimist. Kui patsiendil on varem RF määratud ja ta on osutunud seropositiivseks, ei ole kordusanalüüsi vaja teha, sest positiivne tulemus aja jooksul ei muutu. Küll aga on vaja analüüs teha juhul, kui patsient on varem osutunud seronegatiivseks, kuid analüüsi tegemisest on möödas kaks aastat või enam.
Lisaks põletikulisele (liigese)haigusele viitavatele näitajatele tuleb veres määrata ka ALAT ja kreatiniini tase, et enne ravi (esmatasandil MSPR-ravi) alustamist hinnata patsiendi maksa- ja neerufunktsiooni.
Diferentsiaaldiagnostiliselt on täiskasvanud patsiendil anamneesi ja objektiivse leiu põhjal tekkinud podagra kahtluse korral näidustatud ka kusihappe sisalduse määramine veres.
Põletikulise liigesehaiguse kahtlusega lapse puhul ei ole RF ja CCP IgG määramine näidustatud, sest JIA puhul on need väga harva positiivsed ja nende analüüside tulemus (positiivne/negatiivne) patsiendi edasist käsitlust ei mõjuta.
Käesolevas juhendis on lapsed jagatud kahte vanuserühma vastavalt Eestis välja kujunenud põletikulise liigesehaiguse kahtlusega patsientide käsitlusele lastereumatoloogi juures.
Lisaks põletikulisele (liigese)haigusele viitavatele näitajatele tuleb veres määrata ka ALAT ja kreatiniini tase, et enne ravi (esmatasandil MSPR-ravi) alustamist hinnata patsiendi maksa- ja neerufunktsiooni.
Diferentsiaaldiagnostiliselt on täiskasvanud patsiendil anamneesi ja objektiivse leiu põhjal tekkinud podagra kahtluse korral näidustatud ka kusihappe sisalduse määramine veres.
Põletikulise liigesehaiguse kahtlusega lapse puhul ei ole RF ja CCP IgG määramine näidustatud, sest JIA puhul on need väga harva positiivsed ja nende analüüside tulemus (positiivne/negatiivne) patsiendi edasist käsitlust ei mõjuta.
Käesolevas juhendis on lapsed jagatud kahte vanuserühma vastavalt Eestis välja kujunenud põletikulise liigesehaiguse kahtlusega patsientide käsitlusele lastereumatoloogi juures.
- Põletikulise liigesehaiguse kahtlusega 8–18-aastase lapse puhul tuleb esmatasandil teha hemogramm 5-osalise leukogrammiga, määrata ESR, CRP ning teha uriini ribaanalüüs. Haigusspetsiifiliste analüüside, sh maksa- ja neerufunktsiooni hindavate analüüside tegemise võib jätta lastereumatoloogile.
- Kuni 7-aastase (k.a) lapse puhul, kes põletikulise liigesehaiguse kahtlusel niikuinii kohe reumatoloogi juurde (e-konsultatsioonile) tuleb suunata (vt soovitust nr 10), soovitatakse kõigi analüüside tegemine jätta lastereumatoloogile, et vältida lühikese ajavahega korduvat proovide võtmist.
Esmatasandil ei ole esmase põletikulise liigesehaiguse kahtlusega patsiendi (ei täiskasvanu ega lapse) puhul põhjust teha ANA, HLA B27 alleeli ning nakkushaiguste (nt puukborrelioos) seroloogilisi uuringuid. Need diferentsiaaldiagnostiliselt olulised analüüsid teeb vajadusel reumatoloog.
Praegu (2019. aastal) Eestis kehtiva korra järgi kinnitab põletikulise liigesehaiguse diagnoosi reumatoloog. Septiline artriit on aga raske põletikuline liigesehaigus, mis vajab erakorralist abi.
Praegu (2019. aastal) Eestis kehtiva korra järgi kinnitab põletikulise liigesehaiguse diagnoosi reumatoloog. Septiline artriit on aga raske põletikuline liigesehaigus, mis vajab erakorralist abi.
| 5 |
|
Septilise artriidi kahtlusel suunake patsient kohe erakorralise meditsiini osakonda. Praktiline soovitus |
Septilisele artriidile viitavad sümptomid on järgmised:
- tavaliselt haaratud üks liiges (monoartriit);
- kiiresti tekkinud tugev liigesevalu ja -turse;
- liigese piirkonnas kuumav ja punetav nahk;
- põletikunäitajate (ESR, CRP) oluline tõus;
- võib esineda palavik.
Töörühm pidas vajalikuks rõhutada, et septilise artriidi korral on vaja esimesel võimalusel kindlaks teha haigustekitaja, et püsivate liigesekahjustuste ennetamiseks võimalikult vara tekitajaspetsiifilise antibiootikumiraviga alustada.
Kui patsient viibib erakorralise meditsiini või mõnes teises osakonnas, kus personalil on liigesepunktsiooniks vajalikud oskused ja vahendid, tuleb septilise artriidi kahtlusel liigest aseptika reegleid järgides punkteerida ning liigesepunktaat kohe analüüsideks (tsütoos ja tsütogramm ning mikrobioloogiline uuring) laborisse saata. Haigustekitaja leidmiseks on soovitatav patsiendilt võtta ka verekülv.
Lapse puhul soovitavad lastekirurgid esimeses liigesepunktaadis piisava vedelikuhulga olemasolul määrata ka glükoosisisalduse, mille suur erinevus glükoosisisaldusest veres on enamasti SA-diagnoosi aluseks. Kui liigese punkteerimisel saadakse mäda või hägune liigesevedelik, soovitatakse liiges kohe ka füsioloogilise lahusega loputada (kuni vedelik jääb selgeks).
Põletikulise liigesehaiguse kahtlusega patsiendi edasisuunamise info on kokkuvõtlikult esitatud juhendi lisas (vt lisa 1).
Kui esmatasandi arstil ei tekkinud kahtlust, et patsiendil võib olla septiline artriit, võib ta kaaluda radioloogilise uuringu tegemist. Seni on Eestis esmatasandi arstiabis põletikulise liigesehaiguse kahtlusega patsientide puhul radioloogiliste uuringute tegemine varieerunud.
Kui patsient viibib erakorralise meditsiini või mõnes teises osakonnas, kus personalil on liigesepunktsiooniks vajalikud oskused ja vahendid, tuleb septilise artriidi kahtlusel liigest aseptika reegleid järgides punkteerida ning liigesepunktaat kohe analüüsideks (tsütoos ja tsütogramm ning mikrobioloogiline uuring) laborisse saata. Haigustekitaja leidmiseks on soovitatav patsiendilt võtta ka verekülv.
Lapse puhul soovitavad lastekirurgid esimeses liigesepunktaadis piisava vedelikuhulga olemasolul määrata ka glükoosisisalduse, mille suur erinevus glükoosisisaldusest veres on enamasti SA-diagnoosi aluseks. Kui liigese punkteerimisel saadakse mäda või hägune liigesevedelik, soovitatakse liiges kohe ka füsioloogilise lahusega loputada (kuni vedelik jääb selgeks).
Põletikulise liigesehaiguse kahtlusega patsiendi edasisuunamise info on kokkuvõtlikult esitatud juhendi lisas (vt lisa 1).
Kui esmatasandi arstil ei tekkinud kahtlust, et patsiendil võib olla septiline artriit, võib ta kaaluda radioloogilise uuringu tegemist. Seni on Eestis esmatasandi arstiabis põletikulise liigesehaiguse kahtlusega patsientide puhul radioloogiliste uuringute tegemine varieerunud.
| 6 |
|
Põletikulise liigesehaiguse kahtlusega täiskasvanud patsiendi puhul, kel on turses ja valusad labakäte ja/või labajalgade liigesed, võite esmasel visiidil teha röntgeniülesvõtted mõlemast labakäest ja/või labajalast suunaga eest taha. Praktiline soovitus |
Kui põletikuline liigesehaigus kestab pikalt, kujunevad liigestes välja luulised muutused. Nii ei pruugi põletikulise liigesehaiguse kahtlusega patsiendil, kes esmakordselt arsti poole pöördub, röntgeniülesvõttel mingeid muutusi esineda ning selle tegemine ei ole näidustatud.
Kui tegemist on artriidiga labakätes ja/või -jalgades, on täiskasvanud patsiendile edaspidi (reumatoloogi juures) liigesemuutuste ja nende dünaamika hindamiseks radioloogilised uuringud näidustatud. Kõige sagedamini esineb liigestes erosiivseid muutusi juba haiguse alguses polüartriidi korral. Nii ei ole põhjust sellise patsiendi puhul keelata esimese radioloogilise uuringu tegemist juba esmatasandil, kui arst on harjunud seda tegema ning teeb seda õigesti. Õigesti tegemine tähendab seda, et röntgeniülesvõtted tehakse suunal eest taha mõlemast labakäest ja/või jalast (kogu ulatuses), sest põletikuliste liigesehaiguste puhul ei korreleeru kliiniline leid sageli radioloogilise leiuga ja liigesemuutusi on oluline võrdlevalt hinnata. Esmatasandil tehtud röntgeniülesvõtet või -ülesvõtteid saab reumatoloog hiljem haiguse progresseerumise hindamisel kasutada, kui põletikulise liigesehaiguse diagnoos kinnitatakse.
Magnetresonantstomograafia (MRT) ei ole tunduvalt kallima radioloogilise uuringuna labakäsi ja/või -jalgu haarava artriidi korral esmatasandil põhjendatud.
Lapsel, kelle puhul soovitatakse juhendis eespool jätta kas kõik või haigusspetsiifilised analüüsid lastereumatoloogi teha, ei ole esmatasandil põhjust ka röntgeniuuringut tegema hakata.
Kõigile liigesepõletikele ehk artriitidele on iseloomulikud liiges(t)e turse, valu, kangustunne ja funktsioonihäire. Põletikunäitajad veres võivad olla mõõdukalt tõusnud, samas ei välista normväärtused artriidi võimalust. RF (ja CCP IgG) võivad olla nii negatiivsed kui ka positiivsed: tegemist on seronegatiivse või -positiivse artriidiga. Kuigi seropositiivset ja -negatiivset RA-d ravitakse samade ravimitega, on seropositiivsel RA-l halvem prognoos, mistõttu peab ravitaktika olema agressiivsem.
Käesolevas juhendis on artriidid vastavalt liigeste haaratusele jagatud kolme rühma: mono-, oligo- või polüartriit. Monoartriidi korral on haaratud üks liiges, oligoartriidi korral kaks kuni neli liigest ning polüartriidi korral viis või enam liigest, eelkõige labakäte ja/või labajalgade väikesed liigesed.
Kui tegemist on artriidiga labakätes ja/või -jalgades, on täiskasvanud patsiendile edaspidi (reumatoloogi juures) liigesemuutuste ja nende dünaamika hindamiseks radioloogilised uuringud näidustatud. Kõige sagedamini esineb liigestes erosiivseid muutusi juba haiguse alguses polüartriidi korral. Nii ei ole põhjust sellise patsiendi puhul keelata esimese radioloogilise uuringu tegemist juba esmatasandil, kui arst on harjunud seda tegema ning teeb seda õigesti. Õigesti tegemine tähendab seda, et röntgeniülesvõtted tehakse suunal eest taha mõlemast labakäest ja/või jalast (kogu ulatuses), sest põletikuliste liigesehaiguste puhul ei korreleeru kliiniline leid sageli radioloogilise leiuga ja liigesemuutusi on oluline võrdlevalt hinnata. Esmatasandil tehtud röntgeniülesvõtet või -ülesvõtteid saab reumatoloog hiljem haiguse progresseerumise hindamisel kasutada, kui põletikulise liigesehaiguse diagnoos kinnitatakse.
Magnetresonantstomograafia (MRT) ei ole tunduvalt kallima radioloogilise uuringuna labakäsi ja/või -jalgu haarava artriidi korral esmatasandil põhjendatud.
Lapsel, kelle puhul soovitatakse juhendis eespool jätta kas kõik või haigusspetsiifilised analüüsid lastereumatoloogi teha, ei ole esmatasandil põhjust ka röntgeniuuringut tegema hakata.
Kõigile liigesepõletikele ehk artriitidele on iseloomulikud liiges(t)e turse, valu, kangustunne ja funktsioonihäire. Põletikunäitajad veres võivad olla mõõdukalt tõusnud, samas ei välista normväärtused artriidi võimalust. RF (ja CCP IgG) võivad olla nii negatiivsed kui ka positiivsed: tegemist on seronegatiivse või -positiivse artriidiga. Kuigi seropositiivset ja -negatiivset RA-d ravitakse samade ravimitega, on seropositiivsel RA-l halvem prognoos, mistõttu peab ravitaktika olema agressiivsem.
Käesolevas juhendis on artriidid vastavalt liigeste haaratusele jagatud kolme rühma: mono-, oligo- või polüartriit. Monoartriidi korral on haaratud üks liiges, oligoartriidi korral kaks kuni neli liigest ning polüartriidi korral viis või enam liigest, eelkõige labakäte ja/või labajalgade väikesed liigesed.
| 7 | Põletikulise liigesehaiguse kahtlusega täiskasvanu ja 8–18-aastane laps, kel on turses ja valusad viis või enam liigest (polüartriit), suunake pärast esmasel visiidil tehtud analüüside tulemuste selgumist reumatoloogi või lastereumatoloogi e-konsultatsioonile. Tugev positiivne soovitus, madal tõendatuse aste |
|
| 8 |
|
Põletikulise liigesehaiguse kahtlusega täiskasvanud patsient, kel on turses ja valusad üks kuni neli liigest (mono- või oligoartriit) ning kel on vereanalüüsis reumatoidfaktor positiivne (ja tsitrulliinivastased antikehad positiivsed), suunake pärast esmasel visiidil tehtud analüüside tulemuste selgumist reumatoloogi e-konsultatsioonile. Tugev positiivne soovitus, madal tõendatuse aste |
| 9 |
|
Põletikulise liigesehaiguse kahtlusega 8–18-aastane laps, kel on turses ja valusad üks kuni neli liigest (mono- või oligoartriit), suunake pärast esmasel visiidil tehtud analüüside tulemuste selgumist lastereumatoloogi e-konsultatsioonile. Tugev positiivne soovitus, madal tõendatuse aste |
| 10 | Põletikulise liigesehaiguse kahtlusega kuni 7-aastane (k.a) laps suunake esmasel visiidil kohe lastereumatoloogi e-konsultatsioonile. Tugev soovitus, madal tõendatuse aste |
Juhendit koostama asudes soovis töörühm täpsustada, millised põletikulise liigesehaiguse kahtlusega patsiendid tuleb suunata reumatoloogi juurde ning kui kiiresti (esimese 2 kuu jooksul või hiljem) seda teha. Vastuse saamiseks töötati läbi käesoleva juhendi koostamisel sõelale jäänud 12 ravijuhendit (loetelu vt juhendi ptk “Tõendusmaterjali otsimine ja hindamine”), kuid selgus, et neis ei ole reumatoloogi juurde suunamise kiiruse küsimust käsitletud. Asjakohaseid teadusuuringuid ei leitud ka lisaks elektroonses teaduskirjanduse andmebaasis PubMed tehtud süstemaatiliste ülevaadete ja metaanalüüside ning randomiseeritud kontrollitud uuringute otsingus.
Seejärel täpsustas töörühm, miks kiire suunamine reumatoloogi juurde oluline on: kui põletikulise liigesehaiguse (nt RA) diagnoos kinnitatakse, on haiguse progresseerumise pidurdamise seisukohast tähtis, kui ruttu alustatakse haigust modifitseeriva antireumaatilise raviga. Nüüd võeti vaatluse alla reumatoloogidele mõeldud põletikuliste liigesehaiguste spetsiifilist ravi käsitlevad juhendid. Töörühma ettepanekul piirduti kahe kõige värskema Euroopas ja Ameerika Ühendriikides välja töötatud juhendiga (Singh jt 2016, Smolen jt 2017).
Eelnimetatud juhendeist leiti neli teemakohast RA patsientide seas tehtud vaatlusuuringut, milles hinnati haigust modifitseeriva antireumaatilise ravi mõju haiguse progresseerumisele radioloogiliselt (Kyburz 2011, van Aken 2004, Nell 2004), haiguse aktiivsuse skoori alusel (Nell 2004) või liigese endoproteesimise (ehk tõsise liigesekahjustuse tekke) alusel (Moura 2015). Konkreetset aega, mil haigust modifitseeriva antireumaatilise raviga peaks alustama (näiteks kas kahe kuu jooksul või hiljem), neist uuringuist ei selgunud. Küll aga ilmnes, et RA progresseerumine on seda aeglasem, mida varem ravi alustatakse. Nimetatud nelja uuringu tulemuste ja kvaliteedihinnangute kokkuvõte on esitatud tõendusmaterjali kokkuvõttes nr 1.
Tõendusmaterjalina olid leitud vaatlusuuringud mõõduka kuni väga madala kvaliteediga. Siiski leidis töörühm, et juhul, kui esmavisiidil võetud anamneesi, objektiivse läbivaatuse ning juhendis eespool soovitatud analüüside tulemuste põhjal kahtlustab esmatasandi arst põletikulist liigesehaigust, ei ole ühtki põhjust täiskasvanud patsiendi reumatoloogi juurde suunamisega viivitada. Nii antigi kohese reumatoloogi juurde suunamise kohta tugevad soovitused. Lapse puhul tuleb otsustada, kas oodata analoogselt täiskasvanutega enne edasisuunamist ära asjakohaste analüüside tulemused (8–18-aastastel lastel) või mitte (kuni 7-aastastel (k.a) lastel).
Põletikulise liigesehaiguse kahtlusega patsiendi edasisuunamise info on kokkuvõtlikult esitatud juhendi lisas 1.
Et juhendi koostamise ajal (2019. a) on patsient võimalik suunata reumatoloogi e-konsultatsioonile, soovitas töörühm kasutada just seda võimalust, sest tavalise digisaatekirjaga võib esmase põletikulise liigesehaiguse kahtlusega patsient oodata reumatoloogi vastuvõtu järjekorras kuni kolm kuud. E-konsultatsiooni kaudu on tal võimalik jõuda reumatoloogi juurde juba 1–2 nädala jooksul. E-konsultatsiooni saatekirja saab arst täita pärast patsiendi visiiti (elektroonselt), mistõttu soovitati oodata ära ka analüüside tulemused (v.a kuni 7-aastaste (k.a) laste puhul) ja needki reumatoloogile esitatava info hulka lisada.
Töörühm jõudis aga järeldusele, et juhendi valmimise ajal (2019. a lõpus) Eestis kasutusel olev reumatoloogi e-konsultatsiooni saatekirja vorm vajab korrigeerimist ja täpsustamist ning see kirjutati juhendi rakenduskavva.
| 11 |
|
Põletikulise liigesehaiguse kahtlusega patsiendi puhul alustage MSPR-iga põletiku- ja valuvastast ravi maksimaalses lubatud ööpäevases annuses. Praktiline soovitus |
Kaebuste leevendamiseks on kõigil põletikulise liigesehaiguse kahtlusega patsientidel näidustatud põletiku- ja valuvastane ravi. Kliinilises praktikas on neil näidustustel esmavalikuna tulemuslikult kasutusel suukaudsed MSPR-id (mittesteroidsed põletikuvastased ravimid, ingl nonsteroidal anti-inflammatory drugs NSAID). Et soovitus alustada farmakoteraapiat MSPR-iga haakub Eestis värskelt valminud ravijuhendis „Alaseljavalu diagnostika ja ravi esmatasandil (RJ-M/38.1-2019)“ antud soovitustega (Eesti Haigekassa 2019), ei esitatud käesolevas juhendis põletikulise liigesehaiguse kahtlusega patsiendi sümptomaatilise ravi kohta eraldi kliinilist küsimust ja piirduti praktilise soovitusega.
Konkreetse ravimi (toimeaine) valimisel soovitab töörühm tugineda ravimi tooteomaduste kokkuvõttele ja patsiendi varasemale kogemusele MSPR-idega ning võtta arvesse kaasuvaid haigusi ja ravimi võimalikke (sh varem ilmnenud) kõrvaltoimeid. Samas võib kõige sagedamini esinevate kõrvaltoimete (seedetrakti kõrvaltoimete) ennetamiseks patsiendile kohe määrata lisaravi prootonpumba inhibiitoriga.
Töörühma hinnangul tuleb kliinilises praktikas suhteliselt sageli ette, et MSPR-i võetakse alalävises annuses. Seetõttu on raske eristada, kas mitterahuldav ravitulemus on tingitud ravimi ebapiisavast annusest või ravimi toimeaine sobimatusest. Viimasel juhul tuleks ravimit (toimeainet) vahetada. Igal juhul soovitab töörühm valitud MSPR-i määrata maksimaalses ööpäevases annuses.
MSPR-ravi tulemust soovitab töörühm nii täiskasvanul kui 8–18-aastasel lapsel (kui ta selleks ajaks veel lastereumatoloogi juurde jõudnud ei ole) hinnata 2 nädala pärast, sest mõningate artriitide puhul on see aeg piisav kaebuste täielikuks taandumiseks. Kui kahe nädala möödudes on MSPR-i ravitulemus mitterahuldav, soovitab töörühm MSPR-i (toimeainet) vahetada ja kahe nädala pärast tulemust uuesti hinnata. Kui ravi MSPR-i(de)ga ei ole nelja nädala jooksul soovitud tulemust andnud, soovitab töörühm põletikulise liigesehaiguse kahtlusega patsiendi suunata reumatoloogi e-konsultatsioonile.
Kui patsiendi kaebused MSPR-ravi ajal ägenevad või lisandub uusi kaebusi, võib ta juba varem, enne nelja nädala möödumist (laste)reumatoloogi e-konsultatsioonile suunata. MSPR-ide absoluutsete vastunäidustuste (nt neerupuudulikkuse) korral soovitab töörühm määrata patsiendile ainult valuravi ja suunata ta koheselt reumatoloogi e-konsultatsioonile.
Kuni 7-aastase (k.a) lapse puhul, kes esmasel visiidil vastavalt juhendis eespool antud soovitusele kohe lastereumatoloogi juurde (e-konsultatsioonile) on suunatud (vt soovitus nr 10), tuleb kaebuste leevendamiseks samuti määrata MSPR-ravi. Selle jälgimise ja tulemuse hindamise võtab esimesel võimalusel üle lastereumatoloog, reeglina vähem kui kahe nädala jooksul.
Patsiendile (nii täiskasvanule kui ka lapsele) tuleks aga kindlasti öelda, et ta MSPR-ravi omaalgatuslikult ei katkestaks, vaid jätkaks seda kuni reumatoloogi vastuvõtuni.
Kui täiskasvanul püsib vaatamata adekvaatsele MSPR-ravile tugev valusündroom, võib MSPR-ile lisada nõrga opioidi (nt kodeiini, tramadooli) koos paratsetamooliga või ilma. Selle n-ö astmelise lähenemise põletiku ja valu farmakoteraapiale võttis töörühm üle värskelt valminud alaseljavalu ravi käsitlevast juhendist (Eesti Haigekassa 2019). Laps, kelle valusündroom püsib ja/või lisandub uusi valulikke liigeseid, tuleks kohe lastereumatoloogi juurde (e-konsultatsioonile) suunata.
MSPR-id on apteegi käsimüügist kergesti kättesaadavad. Seetõttu pidas töörühm siinkohal oluliseks eraldi märkida, et patsiendile peab kohe farmakoteraapia alguses selgitama, et erinevaid MSPR-e (nt ibuprofeeni ja deksketoprofeeni) omavahel kombineerida ei tohi: kõrvaltoimed võivad kumuleeruda.
Konkreetse ravimi (toimeaine) valimisel soovitab töörühm tugineda ravimi tooteomaduste kokkuvõttele ja patsiendi varasemale kogemusele MSPR-idega ning võtta arvesse kaasuvaid haigusi ja ravimi võimalikke (sh varem ilmnenud) kõrvaltoimeid. Samas võib kõige sagedamini esinevate kõrvaltoimete (seedetrakti kõrvaltoimete) ennetamiseks patsiendile kohe määrata lisaravi prootonpumba inhibiitoriga.
Töörühma hinnangul tuleb kliinilises praktikas suhteliselt sageli ette, et MSPR-i võetakse alalävises annuses. Seetõttu on raske eristada, kas mitterahuldav ravitulemus on tingitud ravimi ebapiisavast annusest või ravimi toimeaine sobimatusest. Viimasel juhul tuleks ravimit (toimeainet) vahetada. Igal juhul soovitab töörühm valitud MSPR-i määrata maksimaalses ööpäevases annuses.
MSPR-ravi tulemust soovitab töörühm nii täiskasvanul kui 8–18-aastasel lapsel (kui ta selleks ajaks veel lastereumatoloogi juurde jõudnud ei ole) hinnata 2 nädala pärast, sest mõningate artriitide puhul on see aeg piisav kaebuste täielikuks taandumiseks. Kui kahe nädala möödudes on MSPR-i ravitulemus mitterahuldav, soovitab töörühm MSPR-i (toimeainet) vahetada ja kahe nädala pärast tulemust uuesti hinnata. Kui ravi MSPR-i(de)ga ei ole nelja nädala jooksul soovitud tulemust andnud, soovitab töörühm põletikulise liigesehaiguse kahtlusega patsiendi suunata reumatoloogi e-konsultatsioonile.
Kui patsiendi kaebused MSPR-ravi ajal ägenevad või lisandub uusi kaebusi, võib ta juba varem, enne nelja nädala möödumist (laste)reumatoloogi e-konsultatsioonile suunata. MSPR-ide absoluutsete vastunäidustuste (nt neerupuudulikkuse) korral soovitab töörühm määrata patsiendile ainult valuravi ja suunata ta koheselt reumatoloogi e-konsultatsioonile.
Kuni 7-aastase (k.a) lapse puhul, kes esmasel visiidil vastavalt juhendis eespool antud soovitusele kohe lastereumatoloogi juurde (e-konsultatsioonile) on suunatud (vt soovitus nr 10), tuleb kaebuste leevendamiseks samuti määrata MSPR-ravi. Selle jälgimise ja tulemuse hindamise võtab esimesel võimalusel üle lastereumatoloog, reeglina vähem kui kahe nädala jooksul.
Patsiendile (nii täiskasvanule kui ka lapsele) tuleks aga kindlasti öelda, et ta MSPR-ravi omaalgatuslikult ei katkestaks, vaid jätkaks seda kuni reumatoloogi vastuvõtuni.
Kui täiskasvanul püsib vaatamata adekvaatsele MSPR-ravile tugev valusündroom, võib MSPR-ile lisada nõrga opioidi (nt kodeiini, tramadooli) koos paratsetamooliga või ilma. Selle n-ö astmelise lähenemise põletiku ja valu farmakoteraapiale võttis töörühm üle värskelt valminud alaseljavalu ravi käsitlevast juhendist (Eesti Haigekassa 2019). Laps, kelle valusündroom püsib ja/või lisandub uusi valulikke liigeseid, tuleks kohe lastereumatoloogi juurde (e-konsultatsioonile) suunata.
MSPR-id on apteegi käsimüügist kergesti kättesaadavad. Seetõttu pidas töörühm siinkohal oluliseks eraldi märkida, et patsiendile peab kohe farmakoteraapia alguses selgitama, et erinevaid MSPR-e (nt ibuprofeeni ja deksketoprofeeni) omavahel kombineerida ei tohi: kõrvaltoimed võivad kumuleeruda.
| 12 | Põletikulise liigesehaiguse kahtlusega patsiendi esmasel visiidil ehk enne reumatoloogi või lastereumatoloogi e-konsultatsioonile suunamist ärge alustage süsteemset glükokortikosteroidravi. Praktiline soovitus |
Kliinilises praktikas on juhtunud, et eesmärgiga patsiendi kaebusi võimalikult kiiresti vähendada, on enne reumatoloogi juurde jõudmist ehk esmatasandil alustatud süsteemset glükokortikosteroidravi (GKS-ravi). GKS võib aga haiguse kliinilist pilti oluliselt muuta, mistõttu muutub reumatoloogil GKS-ravi foonil põletikulise liigesehaiguse diagnoosimine raskemaks.
Kui täiskasvanu haigusnähud on nii tugevalt väljendunud, et eespool soovitatud MSPR-raviga ega kombineeritud farmakoteraapiaga ei saada soovitud ravitulemust või kaebused adekvaatse ravi foonil koguni süvenevad, tuleb patsient GKS-ravi alustamise asemel koheselt reumatoloogi e-konsultatsioonile suunata. Laps, kel adekvaatse farmakoteraapia foonil kaebused püsivad või süvenevad, tuleb samuti koheselt lastereumatoloogi e-konsultatsioonile suunata.
| 13 |
|
Põletikulise liigesehaiguse kahtlusega patsient, kel vaatamata esmasele adekvaatsele põletiku- ja valuvastasele ravile püsib valu ja/või funktsioonihäire üle ühe kuu, suunake taastusarsti e-konsultatsioonile, kus otsustatakse füsio- ja tegevusteraapia vajadus. Tugev positiivne soovitus, mõõdukas tõendatuse aste |
Eestis jõuab põletikulise liigesehaigusega patsient taastusarsti juurde enamasti reumatoloogi suunamisel pärast konkreetse haiguse diagnoosimist. Kliinilises praktikas tuleb siiski ette olukordi, kus põletikulise liigesehaiguse kahtlusega patsiendi valust (koos funktsioonihäirega või ilma) adekvaatsele farmakoteraapiale vaatamata ühe kuu jooksul jagu ei saada, samas on reumatoloogi vastuvõtuni veel aega. Kui patsiendil on aga tõepoolest põletikuline liigesehaigus, peab viivitamatult alustama haigust modifitseerivat ravi (vt (laste)reumatoloogi juurde suunamise kohta antud soovitusi 7-10) ja taastusravi.
Töörühm arutas juhendit koostama asudes, kuivõrd saaks esmatasandi arst aidata kaasa sellele, et põletikulise liigesehaigusega patsient optimaalse aja jooksul taastusravile jõuaks. Nii esitati kliinilised küsimused: kas taastusarstile tuleb suunata kõik esmase põletikulise liigesehaigusega patsiendid ja millise aja jooksul seda teha. Taastusarst koostab patsiendile tervikliku, vajaduse korral nii füsio- kui ka tegevusteraapiat sisaldava raviplaani. Seepärast võeti teadusliku tõendusmaterjali otsinguil vaatluse alla uuringud, milles oli hinnatud kas füsio-, tegevusteraapia või nende kombinatsiooni mõju põletikulise liigesehaiguse ravitulemusele. Sõelale jäi vastavalt 6, 7 ja 11 süstemaatilist ülevaadet, milles osa (üksik)uuringuid kattus.
FÜSIOTERAAPIA teemal leiti kuus juhuslikustatud kontrollitud uuringutel põhinevat süstemaatilist ülevaadet, milles tehti käesoleva kliinilise küsimusega haakuvaid metaanalüüse (N = 5–13, n = 298–1049). Neist viies ülevaates olid uuritavaiks RA-patsiendid, kelle keskmine vanus jäi vahemikku 41–65 aastat, haigus oli keskmiselt kestnud 4–13 aastat (Burghardt 2019, Kelley 2018, Rausch Osthoff 2018, Peres 2017, Hurkman 2009). Ühes uuringus olid uuritavaiks JIA-patsiendid vanuses 4–19,9 aastat (N = 9, n = 457) (Klepper 2019).
Süstemaatilistesse ülevaadetesse ja metaanalüüsidesse kaasatud üksikuuringud olid väga heterogeensed. Sekkumiseks oli üldfüüsiline treening, aeroobne treening, (vastupanu)jõutreening või eelnimetatute kombinatsioon(id). Kontrollrühmas ei sekkutud osa juhtudel üldse, teisel juhul said uuritavad tavapärast ravi või muu (treening)sekkumise. Varieerusid ka treeningute intensiivsus, sagedus ja kestus. Tulemusnäitajatena hinnati valutugevust, valulike liigeste arvu, liigeste liikuvust ja nende radioloogilisi muutusi, funktsionaalset võimekust, lihasjõudu ja aeroobset võimekust, haiguse aktiivsust, väsimust/kurnatust ja elukvaliteeti.
Füsioteraapia eeliseid võrdlustegevuste ees RA-ga patsientide puhul kinnitas kahes metaanalüüsis nähtud aeroobse võimekuse statistiliselt oluline paranemine:
- Rausch Osthoffi jt metaanalüüsis (N = 9, n = 461) aeroobse treeningu (sh kombinatsioonis jõutreeninguga) rühmas võrreldes kontrollrühmaga (SMD 0,54 [95% Cl 0,22–0,86]) (Rausch Osthoff 2018);
- Hurkmansi jt metaanalüüsis (N = 3, n = 82) lühiajalise (vähem kui kolm kuud) aeroobse treeningu rühmas võrreldes kontrollrühmaga vahetult pärast sekkumise lõppu (SMD = 0,99 [95% CI 0,29–1,68]), kuigi 9. uuringukuuks erinevus uuringurühmade vahel kadus (Hurkman 2009).
Füsioteraapia eeliseid võrdlustegevuste ees RA-patsientide puhul kinnitas ka kahes metaanalüüsis nähtud lihasjõu statistiliselt oluline suurenemine:
- Rausch Osthoffi jt metanalüüsis (N = 7) jalalihaste jõuharjutuste rühmas võrreldes kontrollrühmaga (SMD = 0,47 [95% CI 0,19–0,76]) (Rausch Osthoff 2018);
- Hurkmansi jt metaanalüüsis (N = 2, n = 74) lühiajalise (vähem kui kolm kuud) aeroobse ja vastupanu-jõutreeningu rühmas võrreldes kontrollrühmaga (SMD = 0,47 (95% CI 0,01–0,93]) (Hurkmans 2009).
Kelley jt metaanalüüsis (N = 5, n = 570) vähenes lühiajalise (vähem kui kolm kuud) aeroobse treeningu rühmas uuritavate väsimus statistiliselt oluliselt enam kui kontrollrühmas (MID (minimal important difference) = -0,34 [95% Cl -0,5 kuni -0,10]) (Kelley 2018).
Üksikuuringute vähesuse või heterogeensuse tõttu ei saanud Burghardt jt, Kelley jt, Rausch Osthoff jt, Peres jt, Hurkman jt ning Klepper jt oma süstemaatilistes ülevaadetes füsioteraapia mõju paljude huvi pakkunud tulemusnäitajate kohta metaanalüüsi teha. Füsioteraapia (erinevate treeningumeetodite) statistiliselt olulisi eeliseid võrdlustegevuste ees nähti erinevate tulemusnäitajate alusel ka järgmistes süstemaatilistesse ülevaadetesse kaasatud üksikuuringutes:
Üksikuuringute vähesuse või heterogeensuse tõttu ei saanud Burghardt jt, Kelley jt, Rausch Osthoff jt, Peres jt, Hurkman jt ning Klepper jt oma süstemaatilistes ülevaadetes füsioteraapia mõju paljude huvi pakkunud tulemusnäitajate kohta metaanalüüsi teha. Füsioteraapia (erinevate treeningumeetodite) statistiliselt olulisi eeliseid võrdlustegevuste ees nähti erinevate tulemusnäitajate alusel ka järgmistes süstemaatilistesse ülevaadetesse kaasatud üksikuuringutes:
- aeroobse võimekuse paranemine (Breedland 2011, Hsieh 2009, De Jong 2003, van den Ende 1996, Baslund 1993, Minor 1989, Harkcom 1985);
- funktsionaalse võimekuse paranemine (De Jong 2003, Minor 1989);
- haiguse aktiivsuse vähenemine vahetult pärast sekkumist (van den Ende 1996, Lyngberg 1994);
- liigeste liikuvuse paranemine (De Jong 2003, Minor 1989);
- lihasjõu suurenemine (Einaggar 2016, Baydogan 2015, Breedland 2011, Strasser 2010, De Jong 2009, Stenström 1999, Neuberger 1997, Rall 1996, van den Ende 1996, Lyngberg 1994);
- valulike liigeste arvu vähenemine (Harkcom 1985);
- valu vähenemine (Elnaggar 2016, Mendonca 2013, Komatireddy jt 1997, Rall jt 1996).
De Jongi jt uuring näitas ka radioloogiliste muutuse süvenemist suurtes liigestes füsioteraapia (dünaamiliste harjutuste) foonil (De Jong 2003), kuid sama autori hilisemas uuringus seda enam ei täheldatud (De Jong 2009).
JIA-patsientide puhul näitasid Klepperi jt süstemaatilisse ülevaatesse kaasatud uuringute (N = 9, n = 457) põhjal tehtud metaanalüüsid või üksikuuringud, et füüsiline aktiivsus (harjutused 30–50 minutit, 2–3 korda nädalas, 12–24 nädala vältel) vähendab patsientide valu. Samuti parandab füüsiline aktiivsus liigeste liikuvust, funktsionaalset võimekust ja elukvaliteeti ning suurendab lihasjõudu, põhjustamata seejuures haiguse ägenemist või sümptomite halvenemist (Klepper 2019).
Täpsem ülevaade tõendusmaterjalina kasutatud füsioteraapiateemaliste uuringute tulemustest on esitatud tõendusmaterjali kokkuvõttes nr 2.
TEGEVUSTERAAPIA teemal leiti kuus valdavalt juhuslikustatud kontrollitud uuringutel põhinevat süstemaatilist ülevaadet, milles tehti käesoleva kliinilise küsimusega haakuvaid metaanalüüse (N = 3–51) (Bobos 2019, Williams 2018, Siegel 2017, Hammond 2016, Bergsta 2014, Steultjens 2004). Lisaks leiti üks juhuslikustatud kontrollitud uuring (n = 326) (Hammond 2004).
Süstemaatilistesse ülevaadetesse ja metaanalüüsidesse olid valdavalt kaasatud RA-patsiendid keskmiselt vanuses 47–60 aastat, kelle haiguse keskmine kestus oli 5–14 aastat. Kaasatud üksikuuringud oli väga heterogeensed: erinesid nii sekkumised (raviviis ja selle intensiivsus, kestus ning sagedus) kui ka võrdlustegevus(ed). Hinnati füüsilise aktiivsuse (tegevuse), mitmekülgse tegevusteraapia, multidistsiplinaarse lähenemise, patsiendi koolitamise ja iseseisva toimetuleku õpetamise, liigese kaitsmise, ortoosi kasutamise, abivahendite kasutamise ning kognitiivse käitumisteraapia mõju. Suures osas ülevaadetest kuulusid peamiste tulemusnäitajate hulka valutugevus ning funktsioonivõime ja haardetugevuse muutus.
Tegevusteraapia eeliseid võrdlustegevus(t)e ees kinnitas valu statistiliselt oluline vähenemine:
JIA-patsientide puhul näitasid Klepperi jt süstemaatilisse ülevaatesse kaasatud uuringute (N = 9, n = 457) põhjal tehtud metaanalüüsid või üksikuuringud, et füüsiline aktiivsus (harjutused 30–50 minutit, 2–3 korda nädalas, 12–24 nädala vältel) vähendab patsientide valu. Samuti parandab füüsiline aktiivsus liigeste liikuvust, funktsionaalset võimekust ja elukvaliteeti ning suurendab lihasjõudu, põhjustamata seejuures haiguse ägenemist või sümptomite halvenemist (Klepper 2019).
Täpsem ülevaade tõendusmaterjalina kasutatud füsioteraapiateemaliste uuringute tulemustest on esitatud tõendusmaterjali kokkuvõttes nr 2.
TEGEVUSTERAAPIA teemal leiti kuus valdavalt juhuslikustatud kontrollitud uuringutel põhinevat süstemaatilist ülevaadet, milles tehti käesoleva kliinilise küsimusega haakuvaid metaanalüüse (N = 3–51) (Bobos 2019, Williams 2018, Siegel 2017, Hammond 2016, Bergsta 2014, Steultjens 2004). Lisaks leiti üks juhuslikustatud kontrollitud uuring (n = 326) (Hammond 2004).
Süstemaatilistesse ülevaadetesse ja metaanalüüsidesse olid valdavalt kaasatud RA-patsiendid keskmiselt vanuses 47–60 aastat, kelle haiguse keskmine kestus oli 5–14 aastat. Kaasatud üksikuuringud oli väga heterogeensed: erinesid nii sekkumised (raviviis ja selle intensiivsus, kestus ning sagedus) kui ka võrdlustegevus(ed). Hinnati füüsilise aktiivsuse (tegevuse), mitmekülgse tegevusteraapia, multidistsiplinaarse lähenemise, patsiendi koolitamise ja iseseisva toimetuleku õpetamise, liigese kaitsmise, ortoosi kasutamise, abivahendite kasutamise ning kognitiivse käitumisteraapia mõju. Suures osas ülevaadetest kuulusid peamiste tulemusnäitajate hulka valutugevus ning funktsioonivõime ja haardetugevuse muutus.
Tegevusteraapia eeliseid võrdlustegevus(t)e ees kinnitas valu statistiliselt oluline vähenemine:
- Williamsi jt metaanalüüsis (N = 2, n = 124) käeharjutuste rühmas võrreldes kontrollrühmaga lühikeses ajaperspektiivis (MD -27,98 [95% CI -48,93 kuni -7,03]) (Williams 2018), samas keskmises ja pikemas perspektiivis uuringurühmade vahel erinevust ei nähtud;
- Bobosi jt metaanalüüsis liigese kaitsmise rühmas võrreldes kontrollrühmaga keskmises ajaperspektiivis (N = 3, n = 358) (SMD -0,32 [95% CI -0,75 kuni -0,22]) ning pikas perspektiivis (N = 4, n = 857) (SMD -0,27 [95% CI -0,41 kuni -0,12]) (Bobos 2019).
Tegevusteraapia eeliseid kinnitas ka funktsioonivõime statistiliselt oluliselt suurem paranemine:
- Bobosi jt metaanalüüsis liiges(t)e kaitsmise rühmas võrreldes kontrollrühmaga keskmises ajaperspektiivis (N = 3, n = 358) (SMD -0,49 [95% CI -0,53 kuni -0,11]) ja pikas perspektiivis (N = 4, n = 857) (SMD -0,27 [95% CI -0,41 kuni -0,12]) (Bobos 2019);
- Steultjens jt 2004 metaanalüüsis ortoosi kasutajate rühmas võrreldes kontrollrühmaga pikemas ajaperspektiivis (N = 6 , n = 1077) [SMD -0,31 (95% CI -0,50 kuni -0,11)] (Steultjens 2004).
Tegevusteraapia eeliseid võrdlustegevus(t)e ees kinnitas ka haardetugevuse statistiliselt oluline paranemine Williamsi jt metaanalüüsi (N = 3, n = 141) sekkumisrühmas võrreldes kontrollrühmaga lühikeses ajaperspektiivis nii vasakul (SMD = 0,44 [95% CI 0,11–0,78]) kui ka paremal käel (SMD = 0,46 [95% CI 0,13–0,80]) (Williams 2018). Pikemas perspektiivis uuringurühmade vahel erinevusi ei leitud.
Tegevusteraapia (erinevate raviviiside) statistiliselt olulisi eeliseid võrdlustegevuste ees nähti erinevate tulemusnäitajate alusel veel ka eelnimetatud süstemaatilistesse ülevaadetesse kaasatud üksikuuringutes:
Tegevusteraapia (erinevate raviviiside) statistiliselt olulisi eeliseid võrdlustegevuste ees nähti erinevate tulemusnäitajate alusel veel ka eelnimetatud süstemaatilistesse ülevaadetesse kaasatud üksikuuringutes:
- valu vähenemine (Lamb 2015, Manning 2014, Crowley 2009, Macedo 2009, Ronningen 2008, Christie 2007, Masiero 2007, Rapoliene 2006, Buljina 2001, Dellhag 1992);
- funktsioonivõime paranemine (Lamb 2015, Manning 2014, Cima 2013, Dogu 2013, Brorsson 2009, Cairns 2009, Crowley 2009, Macedo 2009, Ronningen 2008, Christie 2007, Masiero 2007, O’Brien 2006, Rapolinene 2006, Sharpe 2003, Buljina 2001, Hammond 2001, Hammond 1999, Neuberger 1993, Helewa 1991);
- haardetugevuse paranemine (Lamb 2015, Manning 2014, Niedermann 2012, Brorsson 2009, Crowley 2009, Holm 2008, Ronningen 2008, Rapoliene 2006, Hammond 2002, Buljina 2001, Ring 1998, Brighton 1993, Schaufler 1987).
Ühtlasi jõudsid Hammond jt, Bergstra jt ning Siegel jt oma süstemaatilistes ülevaadetes järeldusele, et intensiivsem ja/või pikema kestusega tegevusteraapia on tulemuslikum (Siegel 2017, Hammond 2016, Bergstra 2014).
Siegeli jt süstemaatilisest ülevaatest selgus veel, et üldfüüsilistest tegevustest osutusid hea kvaliteediga uuringute põhjal tulemuslikuks aeroobne ja vastupanutreening ning vesivõimlemine. Dünaamiliste harjutuste, taiji ja jooga tulemused olid vastukäivad. (Siegel 2017) Samuti nägid Siegel jt, et kõrvaltoimete puhul ei esinenud üheski ülevaatesse kaasatud uuringus tegevusteraapia ja võrdlusrühma vahel statistiliselt olulisi erinevusi (Siegel 2017).
Täpsem ülevaade tõendusmaterjalina kasutatud tegevusteraapiateemaliste uuringute tulemustest on esitatud tõendusmaterjali kokkuvõttes nr 2.
Lisaks eelnevalt eraldi FÜSIO- ja TEGEVUSTERAAPIAT käsitlenud süstemaatilistele ülevaadetele jäid tõendusmaterjali otsingul sõelale veel sellised allikad, kus süstemaatilistesse ülevaadetesse, millest osa koondas mh omakorda süstemaatilisi ülevaateid, olid kaasatud nii füsio- kui ka tegevusteraapiat käsitlevad uuringud (Santos 2019, Geenen 2018, Daien 2016, Park 2016, Al-Qubaeissy 2013, Cramp 2013, Baillet 2012, Baillet 2010, Brosseau 2004, Cairns 2009, Metsios 2008). Neis 11 allikas olid esmase põletikulise liigesehaigusega patsiendi taastusravile suunamise küsimustega haakuvatesse süstemaatilistesse ülevaadetesse kaasatud RA-patsiendid, kelle keskmine vanus jäi vahemikku 41–68 aastat ning haigus oli keskmiselt kestnud 1–16 aastat. Uuritud oli erinevate sekkumiste mõju: tegevusteraapia (üldmõistena), (üld)füüsiline tegevus, aeroobne treening, vesivõimlemine, vastupanu-jõutreening, dünaamilised harjutused, patsiendi koolitamine, ortooside kasutamine, psühholoogiline/psühhosotsiaalne sekkumine ja/või multidistsiplinaarne lähenemine. Varieerusid ka võrdlustegevused. Läbivalt olid uuringuis peamiste tulemusnäitajate hulgas sekkumise mõju valutugevusele ja patsiendi funktsioonivõimele, mille alusel nähti ka teraapia statistiliselt olulisi eeliseid võrdlustegevus(t)e ees. Cairnsi jt ja Metsiose jt süstemaatilistesse ülevaadetesse kaasatud üksikuuringuis nähti ka võrreldes kontrollrühmaga teraapia alguseks välja kujunenud suuremate (radioloogiliselt hinnatud) liigesekahjustuste kiiremat süvenemist väga intensiivse sekkumise (dünaamiliste harjutuste) rühmas (Cairns 2009, Metsios 2007).
Metaanalüüside ning üksikuuringute (juhul, kui metaanalüüsi ei olnud võimalik teha) ülevaade on esitatud tõendusmaterjali kokkuvõttes nr 2.
KOKKUVÕTTES: Tõendusmaterjalina kasutatud füsio-, tegevusteraapia ja nende kombinatsioonide mõju käsitlenud uuringute kvaliteet varieerus väga madalast kõrgeni. Andes tulemusnäitajatest suurema kaalu peamistele (eespool välja toodud) tulemusnäitajatele ja suurema võimsusega uuringutele (metaanalüüsidele), luges töörühm soovituse tõendatuse kokkuvõttes mõõdukaks. Kõigi tõendusmaterjalina kasutatud uuringute tulemused ning kvaliteedihinnangud on esitatud tõendusmaterjali kokkuvõttes nr 2.
Soovituse tugevuse määramisel arvestas töörühm seda, et ehkki füsio- ja tegevusteraapia vähendavad esmase põletikulise liigesehaigusega patsiendi peamisi kaebusi (valu, funktsioonivõime halvenemine) vähesel kuni mõõdukal määral, paraneb teraapia toel patsiendi toimetulek igapäevategevustega ja seeläbi tagatakse parem elukvaliteet. Töörühma hinnangul kaalub füsio- ja tegevusteraapiast saadav kasu kindlalt üles väga harva esineva võimaliku kahju (väljakujunenud suure liigesekahjustuse süvenemise väga intensiivse sekkumise korral).
Ehkki tõendusmaterjalist ei selgunud esmase põletikulise liigesehaigusega patsiendi füsio- ja/või tegevusteraapia optimaalne algusaeg, leidis töörühm, et haiguse tõttu häirunud (liigese)funktsioonide taastamine on seda tõenäolisem, mida varem sellega pärast haiguse diagnoosimist alustatakse. Ühekuulise ajapiirangu seadmine tuleneb sellest, et osal põletikulise liigesehaiguse kahtlusega patsientidest võivad kaebused esmatasandil alustatud MSPR-raviga selle aja jooksul vaibuda ja teda ei ole vaja edasi suunata (vt ka soovituse nr 11 selgitust). Kui patsiendil adekvaatsele farmakoteraapiale vaatamata põletikulisele liigesehaigusele viitavad kaebused püsivad, ei jää ta tänu ajapiirangu seadmisele tervishoiusüsteemis (erinevate erialade esindajate vahel) n-ö kahe silma vahele ja asjakohane ravi ei hiline.
Et taastusravi on Eestis põletikulise liigesehaigusega patsiendi ravi osa, aitab antud soovituse järgimine kaasa patsientide õigeaegsele taastusravile jõudmisele. Nii võidakse vältida edasisi kaugemale arenenud haiguse suuremaid ravikulusid. Samas võib see esialgu kaasa tuua mõningase taastusravi saajate arvu suurenemise. Põletikulise liigesehaiguse taastusravi kulutõhusust näitasid kaks tõendusmaterjalina kasutatud uuringut (Lamb 2015, Manning 2015).
Füsio-, eelkõige aga tegevusteraapia kättesaadavus on Eestis piiratud, sest spetsialistid koonduvad suurematesse keskustesse ja tegevusterapeute pole piisavalt. Taastusarstile suunatavale patsiendile (lapse puhul tema täiskasvanud saatjale) võiks anda lühikese ülevaate taastusravi erinevatest võimalustest: füsio- ja tegevusteraapia perearsti, taastusarsti, reumatoloogi suunamisel või rehabilitatsiooni kaudu tasulise teenusena. Samuti võiks patsiendile lühidalt selgitada, millisel juhul võiks ta paluda sotsiaaltöötaja abi, mida teha töövõime languse korral ning kuidas vajadusel abivahendeid soetada (vt ka infot soovituse nr 14 selgituses).
Lisaks tõi töörühm välja, et e-konsultatsioon on kiireim viis patsiendil taastusarsti juurde jõuda. Samas alustavad Eestis järjest tööd esmatasandi tervisekeskused, kus osutatakse muu hulgas füsioteraapiateenust. Kui põletikulise liigesehaiguse kahtlusega patsiendiga tegelev perearst töötab tervisekeskuses, kus on füsioterapeut olemas, võib patsiendi, kel vaatamata adekvaatsele farmakoteraapiale püsib valu ja/või funktsioonihäire üle ühe kuu, füsioteraapia vajaduse korral otse füsioterapeudi juurde suunata. Otsetee kindlustamiseks pidas töörühm vajalikuks perearstide teraapiafondi suurendamist füsioteraapiateenuse jaoks. Taotluse koostamine kirjutati sisse käesoleva juhendi rakenduskavva.
Siegeli jt süstemaatilisest ülevaatest selgus veel, et üldfüüsilistest tegevustest osutusid hea kvaliteediga uuringute põhjal tulemuslikuks aeroobne ja vastupanutreening ning vesivõimlemine. Dünaamiliste harjutuste, taiji ja jooga tulemused olid vastukäivad. (Siegel 2017) Samuti nägid Siegel jt, et kõrvaltoimete puhul ei esinenud üheski ülevaatesse kaasatud uuringus tegevusteraapia ja võrdlusrühma vahel statistiliselt olulisi erinevusi (Siegel 2017).
Täpsem ülevaade tõendusmaterjalina kasutatud tegevusteraapiateemaliste uuringute tulemustest on esitatud tõendusmaterjali kokkuvõttes nr 2.
Lisaks eelnevalt eraldi FÜSIO- ja TEGEVUSTERAAPIAT käsitlenud süstemaatilistele ülevaadetele jäid tõendusmaterjali otsingul sõelale veel sellised allikad, kus süstemaatilistesse ülevaadetesse, millest osa koondas mh omakorda süstemaatilisi ülevaateid, olid kaasatud nii füsio- kui ka tegevusteraapiat käsitlevad uuringud (Santos 2019, Geenen 2018, Daien 2016, Park 2016, Al-Qubaeissy 2013, Cramp 2013, Baillet 2012, Baillet 2010, Brosseau 2004, Cairns 2009, Metsios 2008). Neis 11 allikas olid esmase põletikulise liigesehaigusega patsiendi taastusravile suunamise küsimustega haakuvatesse süstemaatilistesse ülevaadetesse kaasatud RA-patsiendid, kelle keskmine vanus jäi vahemikku 41–68 aastat ning haigus oli keskmiselt kestnud 1–16 aastat. Uuritud oli erinevate sekkumiste mõju: tegevusteraapia (üldmõistena), (üld)füüsiline tegevus, aeroobne treening, vesivõimlemine, vastupanu-jõutreening, dünaamilised harjutused, patsiendi koolitamine, ortooside kasutamine, psühholoogiline/psühhosotsiaalne sekkumine ja/või multidistsiplinaarne lähenemine. Varieerusid ka võrdlustegevused. Läbivalt olid uuringuis peamiste tulemusnäitajate hulgas sekkumise mõju valutugevusele ja patsiendi funktsioonivõimele, mille alusel nähti ka teraapia statistiliselt olulisi eeliseid võrdlustegevus(t)e ees. Cairnsi jt ja Metsiose jt süstemaatilistesse ülevaadetesse kaasatud üksikuuringuis nähti ka võrreldes kontrollrühmaga teraapia alguseks välja kujunenud suuremate (radioloogiliselt hinnatud) liigesekahjustuste kiiremat süvenemist väga intensiivse sekkumise (dünaamiliste harjutuste) rühmas (Cairns 2009, Metsios 2007).
Metaanalüüside ning üksikuuringute (juhul, kui metaanalüüsi ei olnud võimalik teha) ülevaade on esitatud tõendusmaterjali kokkuvõttes nr 2.
KOKKUVÕTTES: Tõendusmaterjalina kasutatud füsio-, tegevusteraapia ja nende kombinatsioonide mõju käsitlenud uuringute kvaliteet varieerus väga madalast kõrgeni. Andes tulemusnäitajatest suurema kaalu peamistele (eespool välja toodud) tulemusnäitajatele ja suurema võimsusega uuringutele (metaanalüüsidele), luges töörühm soovituse tõendatuse kokkuvõttes mõõdukaks. Kõigi tõendusmaterjalina kasutatud uuringute tulemused ning kvaliteedihinnangud on esitatud tõendusmaterjali kokkuvõttes nr 2.
Soovituse tugevuse määramisel arvestas töörühm seda, et ehkki füsio- ja tegevusteraapia vähendavad esmase põletikulise liigesehaigusega patsiendi peamisi kaebusi (valu, funktsioonivõime halvenemine) vähesel kuni mõõdukal määral, paraneb teraapia toel patsiendi toimetulek igapäevategevustega ja seeläbi tagatakse parem elukvaliteet. Töörühma hinnangul kaalub füsio- ja tegevusteraapiast saadav kasu kindlalt üles väga harva esineva võimaliku kahju (väljakujunenud suure liigesekahjustuse süvenemise väga intensiivse sekkumise korral).
Ehkki tõendusmaterjalist ei selgunud esmase põletikulise liigesehaigusega patsiendi füsio- ja/või tegevusteraapia optimaalne algusaeg, leidis töörühm, et haiguse tõttu häirunud (liigese)funktsioonide taastamine on seda tõenäolisem, mida varem sellega pärast haiguse diagnoosimist alustatakse. Ühekuulise ajapiirangu seadmine tuleneb sellest, et osal põletikulise liigesehaiguse kahtlusega patsientidest võivad kaebused esmatasandil alustatud MSPR-raviga selle aja jooksul vaibuda ja teda ei ole vaja edasi suunata (vt ka soovituse nr 11 selgitust). Kui patsiendil adekvaatsele farmakoteraapiale vaatamata põletikulisele liigesehaigusele viitavad kaebused püsivad, ei jää ta tänu ajapiirangu seadmisele tervishoiusüsteemis (erinevate erialade esindajate vahel) n-ö kahe silma vahele ja asjakohane ravi ei hiline.
Et taastusravi on Eestis põletikulise liigesehaigusega patsiendi ravi osa, aitab antud soovituse järgimine kaasa patsientide õigeaegsele taastusravile jõudmisele. Nii võidakse vältida edasisi kaugemale arenenud haiguse suuremaid ravikulusid. Samas võib see esialgu kaasa tuua mõningase taastusravi saajate arvu suurenemise. Põletikulise liigesehaiguse taastusravi kulutõhusust näitasid kaks tõendusmaterjalina kasutatud uuringut (Lamb 2015, Manning 2015).
Füsio-, eelkõige aga tegevusteraapia kättesaadavus on Eestis piiratud, sest spetsialistid koonduvad suurematesse keskustesse ja tegevusterapeute pole piisavalt. Taastusarstile suunatavale patsiendile (lapse puhul tema täiskasvanud saatjale) võiks anda lühikese ülevaate taastusravi erinevatest võimalustest: füsio- ja tegevusteraapia perearsti, taastusarsti, reumatoloogi suunamisel või rehabilitatsiooni kaudu tasulise teenusena. Samuti võiks patsiendile lühidalt selgitada, millisel juhul võiks ta paluda sotsiaaltöötaja abi, mida teha töövõime languse korral ning kuidas vajadusel abivahendeid soetada (vt ka infot soovituse nr 14 selgituses).
Lisaks tõi töörühm välja, et e-konsultatsioon on kiireim viis patsiendil taastusarsti juurde jõuda. Samas alustavad Eestis järjest tööd esmatasandi tervisekeskused, kus osutatakse muu hulgas füsioteraapiateenust. Kui põletikulise liigesehaiguse kahtlusega patsiendiga tegelev perearst töötab tervisekeskuses, kus on füsioterapeut olemas, võib patsiendi, kel vaatamata adekvaatsele farmakoteraapiale püsib valu ja/või funktsioonihäire üle ühe kuu, füsioteraapia vajaduse korral otse füsioterapeudi juurde suunata. Otsetee kindlustamiseks pidas töörühm vajalikuks perearstide teraapiafondi suurendamist füsioteraapiateenuse jaoks. Taotluse koostamine kirjutati sisse käesoleva juhendi rakenduskavva.
| 14 | Põletikulise liigesehaiguse kahtlusega patsiendile võite valu vähendamiseks soovitada abivahendeid. Nõrk positiivne soovitus, madal tõendatuse aste |
Esmakordsete põletikulisele liigesehaigusele viitavate kaebuste leevendamine ei alga abivahendi soetamisest ja kasutamisest. Siiski pidas töörühm oluliseks, et juhul, kui teaduslik tõendusmaterjal näitab, et abivahend(e)ist on abi, saaks patsient sellest ravivõttest võimalikult vara teada. Nii oskaks ta pärast põletikulise liigesehaiguse diagnoosi saamist vajaduse korral ka abivahendi(te)le mõelda ja neid nõuda.
Teemakohase teadusliku tõendusmaterjali otsinguil jäi sõelale 10 uuringut, millest kolm olid ülevaated (kaks süstemaatilist ja üks mixed methods-ülevaade) ning seitse üksikuuringud. Valdavalt olid tõendusmaterjaliks (nii ülevaadetesse kaasatud kui ka eraldi leitud) uuringud juhuslikustatud kontrollitud kavandiga.
Uuritavateks olid erinevate põletikuliste liigesehaigustega (valdavalt RA-ga) patsiendid, abivahendeiks ortoosid või spetsiaalsed jalanõud. Peamisteks abivahendi tulemuslikkuse hindamisel kasutatud näitajateks olid valutugevus, funktsioon ja haardetugevus. Abivahendeid võrreldi muu raviga, teis(t)e vahendi(te)ga ja/või ka nn platseebovahendiga.
Haigusest haaratud käel randmeortoosi kasutamist uurinud Ramsey jt jõudsid mixed methods-ülevaatesse kaasatud kaheksa uuringu põhjal (kuus juhuslikustatud kontrollitud ja kaks muu kavandiga uuringut) järeldusele, et tugev kvantitatiivne tõendus näitab abivahendi kasutamisel valu vähenemist (Cohen d = 0,7–0,8) (Ramsey jt 2014). Lisaks leitud kolmest juhuslikustatud kontrollitud uuringust kaks näitasid, et abivahendi kasutajatel vähenes valu statistiliselt oluliselt enam kui kontrollrühmas. Silva jt uuringus (n = 50) oli valutugevuse erinevus uuringurühmade vahel statistiliselt oluline nii 45. kui ka 90. päeval hinnatuna (p = 0,001) (Silva jt 2008a). Hasketti jt uuringus (n = 45) vähenes valu abivahendi kasutajatel statistiliselt oluliselt enam kui kontrollrühmas (p < 0,007) (Haskett 2004). Abivahendi kasutamise eeliseid ei tulnud välja Adamsi jt uuringus, kus mõlemas uuringurühmas oli 12 kuu vältel kasutusel ka tegevusteraapia (Adams 2008). Lisaks leiti üks uuring abivahendi kasutamise mõjust pöidlaliigese valule RA-patsientide puhul (n = 40). Sekkumisrühmas vähenes valu 90. päevaks statistiliselt oluliselt enam kui kontrollrühmas (erinevus VAS-i skoori alusel 4,60 [SD 2,81], p = 0,03) (Silva 2008b).
Valutugevuse muutuse kohta jala abivahendi kasutamisel leiti kaks süstemaatilist ülevaadet ning kolm juhuslikustatud kontrollitud uuringut. Tenten-Diepenmaati jt ülevaates (N = 9, n = 417) vähenes sekkumisrühmas valu statistiliselt oluliselt rohkem (SMD = 0,60 [95% CI 0,28–0,92; p ≤ 0,001]), Gijon-Nogueroni jt ülevaates (N = 5, n = 301) mitte (Tenten-Diepenmaat 2018, Gijon-Nogueron 2018). Kõigis kolmes lisaks leitud üksikuuringus vähenes abivahendi kasutajatel valu statistiliselt oluliselt enam kui kontrollrühmas (Reina-Bueno 2019, Coda 2014, Powell 2005).
Abivahendi mõjust funktsioonivõimele leiti käe abivahendi(te) kohta üks mixed methods-ülevaade (Ramsey 2014) ja lisaks kaks juhuslikustatud kontrollitud uuringut (Adams 2008, Silva 2008a). Jala abivahendi(te) kohta leiti üks süstemaatiline ülevaade (Gijon-Nogueron 2018) ja kaks juhuslikustatud kontrollitud uuringut (Silva 2008b, Powell 2005). Käefunktsiooni paranemist abivahendi toel näitas vaid Silva jt väike juhuslikustatud kontrollitud uuring RA-ga täiskasvanud patsientidel (n = 50): erinevus uuringurühmade vahel oli uuringu lõpus ehk 90. päeval statistiliselt oluline (p < 0,001) (Silva 2008a). Jalafunktsiooni paranemist teatud kindla abivahendi toel näitas leitud uuringutest vaid Powelli jt JIA-ga laste puhul tehtud väike juhuslikustatud kontrollitud uuring (n = 40). Viimase uuringu puhul vähenesid jalatugede rühmas (võrreldes muid abivahendeid kasutanud kahe kontrollrühmaga) 3. uuringukuuks nii tegevuspiirangud (activity limitations) kui ka puude aste (level of disability) (vastavalt p = 0,002 ja p = 0,024). (Powell 2005) Lisaks ei nähtud abivahendi kasutamise eeliseid ka Silva jt juhuslikustatud kontrollitud uuringus, kuhu olid kaasatud pöidla Boutonniere’i deformatsiooniga RA-patsiendid (n = 40) (Silva 2008b).
Abivahendi mõju kohta käe haardetugevusele leiti üks mixed methods-ülevaade (Ramsey 2014) ja kaks juhuslikustatud kontrollitud uuringut (Reina-Bueno 2019, Silva 2008a). Vaid Ramsey jt ülevaade (N = 9) näitas abivahendi kasutamise eeliseid: haardetugevuse paranemise kohta abivahendi kasutamisel saadi mõõdukas kvantitatiivne tõendus (Cohen d = 0,3–0,4) (Ramsey jt 2014).
KOKKUVÕTTES: Tõendusmaterjalina kasutatud uuringute kvaliteet varieerus madalast kõrgeni ning kokkuvõttes loeti abivahendi kasutamise soovituse tõendatuse aste madalaks. Kõigi tõendusmaterjalina kasutatud uuringute tulemused ja kvaliteedihinnangud on esitatud tõendusmaterjali kokkuvõttes nr 3.
Soovituse koostamisel arutles töörühm, et kuigi abivahendi eelised eespool nimetatud tulemusnäitajate alusel ei olnud märkimisväärsed, siis võib näiteks valu vähenemine isegi üksnes vähesel määral inimese toimetulekut igapäevategevustega ja seega ka tema elukvaliteeti oluliselt parandada. Samas tõi töörühm välja, et abivahendi soetamist võivad takistada selle maksumus ning kaasinimeste hoiakud ja suhtumine. Selleks, et abivahendi soetamiseks toetust saada, peab olema tekkinud ja vormistatud töövõime kaotus, mida nooremad inimesed tööalaste võimaluste ahenemise kartuses sageli siiski ette ei võta. Samas võib vanematel inimestel abivahendi soetamist takistada ka asjaajamise keerukus toetuse taotlemisel.
Abivahenditest on enamlevinud puhke-, sõrme- ja randmeortoosid, tallatoed ja nii standardsed kui ka individuaalselt valmistatud spetsiaalsed ravijalanõud. Abivahendi valikul on olulised patsiendi eelistused ja vajadused, sh igapäevategevuste (sh töö) iseloom. Patsient saab abivahendite valikul nõu küsida reumatoloogilt, taastusarstilt, füsioterapeudilt ja/või tegevusterapeudilt. Abivahenditele kehtivate soodustustega on kursis patsiendi elukohajärgne sotsiaaltöötaja.
Lisainfot nii abivahendite kui ka kroonilise põletikulise liigesehaiguse kohta leiab patsient reumatoidartriidi juhendmaterjalist patsientidele (Tuvik 2008).
Teemakohase teadusliku tõendusmaterjali otsinguil jäi sõelale 10 uuringut, millest kolm olid ülevaated (kaks süstemaatilist ja üks mixed methods-ülevaade) ning seitse üksikuuringud. Valdavalt olid tõendusmaterjaliks (nii ülevaadetesse kaasatud kui ka eraldi leitud) uuringud juhuslikustatud kontrollitud kavandiga.
Uuritavateks olid erinevate põletikuliste liigesehaigustega (valdavalt RA-ga) patsiendid, abivahendeiks ortoosid või spetsiaalsed jalanõud. Peamisteks abivahendi tulemuslikkuse hindamisel kasutatud näitajateks olid valutugevus, funktsioon ja haardetugevus. Abivahendeid võrreldi muu raviga, teis(t)e vahendi(te)ga ja/või ka nn platseebovahendiga.
Haigusest haaratud käel randmeortoosi kasutamist uurinud Ramsey jt jõudsid mixed methods-ülevaatesse kaasatud kaheksa uuringu põhjal (kuus juhuslikustatud kontrollitud ja kaks muu kavandiga uuringut) järeldusele, et tugev kvantitatiivne tõendus näitab abivahendi kasutamisel valu vähenemist (Cohen d = 0,7–0,8) (Ramsey jt 2014). Lisaks leitud kolmest juhuslikustatud kontrollitud uuringust kaks näitasid, et abivahendi kasutajatel vähenes valu statistiliselt oluliselt enam kui kontrollrühmas. Silva jt uuringus (n = 50) oli valutugevuse erinevus uuringurühmade vahel statistiliselt oluline nii 45. kui ka 90. päeval hinnatuna (p = 0,001) (Silva jt 2008a). Hasketti jt uuringus (n = 45) vähenes valu abivahendi kasutajatel statistiliselt oluliselt enam kui kontrollrühmas (p < 0,007) (Haskett 2004). Abivahendi kasutamise eeliseid ei tulnud välja Adamsi jt uuringus, kus mõlemas uuringurühmas oli 12 kuu vältel kasutusel ka tegevusteraapia (Adams 2008). Lisaks leiti üks uuring abivahendi kasutamise mõjust pöidlaliigese valule RA-patsientide puhul (n = 40). Sekkumisrühmas vähenes valu 90. päevaks statistiliselt oluliselt enam kui kontrollrühmas (erinevus VAS-i skoori alusel 4,60 [SD 2,81], p = 0,03) (Silva 2008b).
Valutugevuse muutuse kohta jala abivahendi kasutamisel leiti kaks süstemaatilist ülevaadet ning kolm juhuslikustatud kontrollitud uuringut. Tenten-Diepenmaati jt ülevaates (N = 9, n = 417) vähenes sekkumisrühmas valu statistiliselt oluliselt rohkem (SMD = 0,60 [95% CI 0,28–0,92; p ≤ 0,001]), Gijon-Nogueroni jt ülevaates (N = 5, n = 301) mitte (Tenten-Diepenmaat 2018, Gijon-Nogueron 2018). Kõigis kolmes lisaks leitud üksikuuringus vähenes abivahendi kasutajatel valu statistiliselt oluliselt enam kui kontrollrühmas (Reina-Bueno 2019, Coda 2014, Powell 2005).
Abivahendi mõjust funktsioonivõimele leiti käe abivahendi(te) kohta üks mixed methods-ülevaade (Ramsey 2014) ja lisaks kaks juhuslikustatud kontrollitud uuringut (Adams 2008, Silva 2008a). Jala abivahendi(te) kohta leiti üks süstemaatiline ülevaade (Gijon-Nogueron 2018) ja kaks juhuslikustatud kontrollitud uuringut (Silva 2008b, Powell 2005). Käefunktsiooni paranemist abivahendi toel näitas vaid Silva jt väike juhuslikustatud kontrollitud uuring RA-ga täiskasvanud patsientidel (n = 50): erinevus uuringurühmade vahel oli uuringu lõpus ehk 90. päeval statistiliselt oluline (p < 0,001) (Silva 2008a). Jalafunktsiooni paranemist teatud kindla abivahendi toel näitas leitud uuringutest vaid Powelli jt JIA-ga laste puhul tehtud väike juhuslikustatud kontrollitud uuring (n = 40). Viimase uuringu puhul vähenesid jalatugede rühmas (võrreldes muid abivahendeid kasutanud kahe kontrollrühmaga) 3. uuringukuuks nii tegevuspiirangud (activity limitations) kui ka puude aste (level of disability) (vastavalt p = 0,002 ja p = 0,024). (Powell 2005) Lisaks ei nähtud abivahendi kasutamise eeliseid ka Silva jt juhuslikustatud kontrollitud uuringus, kuhu olid kaasatud pöidla Boutonniere’i deformatsiooniga RA-patsiendid (n = 40) (Silva 2008b).
Abivahendi mõju kohta käe haardetugevusele leiti üks mixed methods-ülevaade (Ramsey 2014) ja kaks juhuslikustatud kontrollitud uuringut (Reina-Bueno 2019, Silva 2008a). Vaid Ramsey jt ülevaade (N = 9) näitas abivahendi kasutamise eeliseid: haardetugevuse paranemise kohta abivahendi kasutamisel saadi mõõdukas kvantitatiivne tõendus (Cohen d = 0,3–0,4) (Ramsey jt 2014).
KOKKUVÕTTES: Tõendusmaterjalina kasutatud uuringute kvaliteet varieerus madalast kõrgeni ning kokkuvõttes loeti abivahendi kasutamise soovituse tõendatuse aste madalaks. Kõigi tõendusmaterjalina kasutatud uuringute tulemused ja kvaliteedihinnangud on esitatud tõendusmaterjali kokkuvõttes nr 3.
Soovituse koostamisel arutles töörühm, et kuigi abivahendi eelised eespool nimetatud tulemusnäitajate alusel ei olnud märkimisväärsed, siis võib näiteks valu vähenemine isegi üksnes vähesel määral inimese toimetulekut igapäevategevustega ja seega ka tema elukvaliteeti oluliselt parandada. Samas tõi töörühm välja, et abivahendi soetamist võivad takistada selle maksumus ning kaasinimeste hoiakud ja suhtumine. Selleks, et abivahendi soetamiseks toetust saada, peab olema tekkinud ja vormistatud töövõime kaotus, mida nooremad inimesed tööalaste võimaluste ahenemise kartuses sageli siiski ette ei võta. Samas võib vanematel inimestel abivahendi soetamist takistada ka asjaajamise keerukus toetuse taotlemisel.
Abivahenditest on enamlevinud puhke-, sõrme- ja randmeortoosid, tallatoed ja nii standardsed kui ka individuaalselt valmistatud spetsiaalsed ravijalanõud. Abivahendi valikul on olulised patsiendi eelistused ja vajadused, sh igapäevategevuste (sh töö) iseloom. Patsient saab abivahendite valikul nõu küsida reumatoloogilt, taastusarstilt, füsioterapeudilt ja/või tegevusterapeudilt. Abivahenditele kehtivate soodustustega on kursis patsiendi elukohajärgne sotsiaaltöötaja.
Lisainfot nii abivahendite kui ka kroonilise põletikulise liigesehaiguse kohta leiab patsient reumatoidartriidi juhendmaterjalist patsientidele (Tuvik 2008).
Kroonilise põletikulise liigesehaigusega patsient
Eestis paneb põletikulise liigesehaiguse diagnoosi ja juhib ravi reumatoloog. Haigust modifitseeriva antireumaatilise ravi (HMR-ravi), sh bioloogilise ravi alustamise järel ja haiguse ägedas faasis jälgib reumatoloog patsienti iga 2–3 kuu järel. Edaspidi on visiitide vahed pikemad (4–6 kuud). Kui HMR-raviga on saavutatud haiguse remissioon, võib reumatoloog haige jälgimise vahepeal perearstile usaldada.
Piisab, kui HMR-ravi foonil remissioonis põletikulise liigesehaigusega täiskasvanud patsient käib reumatoloogi juures kontrollis üks kord aastas. Samas seisus laps peaks lastereumatoloogi juures kontrollis käima vähemalt iga nelja kuu järel.
Haiguse kulgu ja ravi tulemuslikkust tuleb hinnata regulaarselt: pöörata tähelepanu patsiendi liigestega seotud kaebustele ja nende võimalikule süvenemisele ning hinnata objektiivselt võimalikke liigestekahjustusi (funktsioonihäireid ja deformatsioone). Samuti ei tohi unustada ravimite võimalikke kõrvaltoimeid.
Järgnevalt antakse praktilised soovitused kroonilise põletikulise liigesehaigusega patsiendi jälgimise kohta perearstipraksises. Need soovitused koos lisainfoga on kokku võetud juhendi lisas (vt lisa 2). Käesolevas juhendis järgnevad soovitused kattuvad nendega, mida reumatoloog Eestis juba praegu tavaliselt patsiendile tema edaspidiseks jälgimiseks perearstipraksises kirjalikult kaasa annab. Eesti reumatoloogid kasutavad üleeuroopalise põletikulise liigesehaigusega patsientide, tervishoiutöötajate ja teadlaste organisatsiooni European League Against Rheumatism (EULAR) käsiraamatus antud soovitusi (www.eular.org) (Bijlsma 2018).
Piisab, kui HMR-ravi foonil remissioonis põletikulise liigesehaigusega täiskasvanud patsient käib reumatoloogi juures kontrollis üks kord aastas. Samas seisus laps peaks lastereumatoloogi juures kontrollis käima vähemalt iga nelja kuu järel.
Haiguse kulgu ja ravi tulemuslikkust tuleb hinnata regulaarselt: pöörata tähelepanu patsiendi liigestega seotud kaebustele ja nende võimalikule süvenemisele ning hinnata objektiivselt võimalikke liigestekahjustusi (funktsioonihäireid ja deformatsioone). Samuti ei tohi unustada ravimite võimalikke kõrvaltoimeid.
Järgnevalt antakse praktilised soovitused kroonilise põletikulise liigesehaigusega patsiendi jälgimise kohta perearstipraksises. Need soovitused koos lisainfoga on kokku võetud juhendi lisas (vt lisa 2). Käesolevas juhendis järgnevad soovitused kattuvad nendega, mida reumatoloog Eestis juba praegu tavaliselt patsiendile tema edaspidiseks jälgimiseks perearstipraksises kirjalikult kaasa annab. Eesti reumatoloogid kasutavad üleeuroopalise põletikulise liigesehaigusega patsientide, tervishoiutöötajate ja teadlaste organisatsiooni European League Against Rheumatism (EULAR) käsiraamatus antud soovitusi (www.eular.org) (Bijlsma 2018).
| 15 | Kroonilise põletikulise liigesehaigusega täiskasvanud patsiendi puhul, kes saab HMR-ravi (sh bioloogilist ravi) ja kelle haigus on remissioonis, tehke kontrollanalüüsid iga kolme kuu järel, kui reumatoloog ei ole määranud teisiti. Praktiline soovitus |
|
| 16 | Kroonilise põletikulise liigesehaigusega lapse puhul, kes saab HMR-ravi (sh bioloogilist ravi) ning kelle haigus on remissioonis, tehke kontrollanalüüsid üks kord kahe lastereumatoloogi vastuvõtu vahelisel perioodil ja mitte harvem kui iga 2–3 kuu järel, kui reumatoloog ei ole määranud teisiti. Praktiline soovitus |
Kontrollanalüüsid on ESR, CRP ja hemogramm 5-osalise leukogrammiga, ALAT ning kreatiniinitaseme määramine. Kaks esimest aitavad hinnata liigesepõletiku aktiivsust ja ülejäänud antireumaatiliste ravimite võimalikke kõrvaltoimeid. Kõige sagedamini esineb HMR-ravi kõrvaltoimena tsütopeeniat ja maksaensüümide taseme tõusu, mille korral tuleb mõnel juhul ravi katkestada. Täpsemad erinevate ravimite tarvitamisel kehtivad juhised on juhendi lisas (vt lisa 2).
HMR-ravi alguses tehakse kontrollanalüüse sagedamini, kui eespool soovitustes 13 ja 14 öeldud, kuid siis on patsient reeglina veel reumatoloogi juures jälgimisel.
| 17 | Kroonilise põletikulise liigesehaigusega täiskasvanud patsiendil hinnake kardiovaskulaarseid riskitegureid üks kord aastas. Praktiline soovitus |
Käesolevat soovitust (meeldetuletust) pidas töörühm vajalikuks seetõttu, et nii põletikulise liigesehaiguse kui ka selle ravi (eelkõige süsteemse GKS-ravi) tõttu suureneb kroonilise põletikulise liigesehaigusega patsiendil kardiovaskulaarsete tüsistuste risk. Näiteks esineb neil müokardiinfarkti sagedamini ja nooremas eas kui üldrahvastiku puhul (Radner 2017, Avina-Zubieta 2008, Solomon 2006, Maradit-Kremers 2005, Del Rinco 2001).
2006. aastal valmis „Eesti südame- ja veresoonkonnahaiguste preventsiooni juhend“, millele tuginedes saab patsiendi südame- ja veresoonkonnahaiguste üldriski hindamiseks soovitada riskitabelite süsteemi SCORE (systematic coronary evaluation) (Viigimaa 2006).
2006. aastal valmis „Eesti südame- ja veresoonkonnahaiguste preventsiooni juhend“, millele tuginedes saab patsiendi südame- ja veresoonkonnahaiguste üldriski hindamiseks soovitada riskitabelite süsteemi SCORE (systematic coronary evaluation) (Viigimaa 2006).
| 18 | Kroonilise põletikulise liigesehaigusega täiskasvanud patsiendi puhul, kes vajab infektsiooni tõttu antibiootilist, antimükootilist või antiviraalset ravi, katkestage selle ajaks HMR-ravi (sh bioloogiline ravi). Praktiline soovitus |
|
| 19 |
|
Kroonilise põletikulise liigesehaigusega lapse puhul katkestage HMR-ravi (sh bioloogiline ravi) mistahes infektsiooni esmaste tunnuste ilmnemisel, ravi taasalustab lastereumatoloog. Praktiline soovitus |
| 20 |
Kroonilise põletikulise liigesehaigusega patsiendi infektsiooni korral MSPR-, glükokortikosteriod- ja valuravis muudatusi ärge tehke. Praktiline soovitus |
Põletikulise liigesehaigusega patsiendi immuunsüsteem on nii haiguse kui ka selle ravi (HMR-ravi) tõttu supresseeritud. Seetõttu ei pruugi neil ägeda infektsiooni korral põletikumarkerid adekvaatselt tõusta ja infektsioon võib kulgeda fulminantselt. Niisiis tuleb põletikulise liigesehaigusega patsiendil infektsiooni kahtlustades olla valvas ja infektsioonivastase raviga mitte viivitada.
Täiskasvanul tuleb infektsioonivastase ravi(kuuri) ajaks tsütostaatilise toimega HMR-ravi (sh bioloogiline ravi) katkestada, et vältida ravimite ohtlikke koostoimeid ja soodustada organismi infektsioonist paranemist. Kui infektsioonivastane ravi(kuur) on lõppenud, võib HMR-raviga jätkata.
0–18-aastasel lapsel peab HMR-ravi (sh bioloogilise ravi) katkestama kohe ägeda infektsiooni esmaste tunnuste ilmnemisel. Erandiks on ravi hüdroksüklorokiiniga (Plaquenil), mida ei ole infektsiooni korral vaja katkestada. HMR-ravi taasalustamiseks tuleb laps suunata lastereumatoloogi e-konsultatsioonile. Lastereumatoloogi juurde tuleks laps suunata ka siis, kui infektsiooni ja/või selle ravi ajal põletikulise liigesehaiguse nähud süvenevad.
Lisaks pidas töörühm oluliseks välja tuua, et MSPR-, glükokortikosteroid- ja/või muud üksnes valuvastast ravi ei ole vaja kroonilise põletikulise liigesehaigusega patsiendi puhul infektsioonivastase ravi ajaks katkestada.
| 21 | Kroonilise põletikulise liigesehaigusega patsiendi puhul, kes läheb plaanilisele operatsioonile, jätkake glükokortikosteroidravi. Praktiline soovitus |
Juhul kui kroonilise liigesehaigusega patsient läheb plaanilisele operatsioonile, võib HMR-ravi (sh bioloogilist ravi) jätkata vastavalt juhendi lisas antud soovitustele (vt lisa 2). Kõrge septilise riskiga operatsiooni eel on võimalike tüsistuste vältimiseks vaja HMR-ravi lõpetada. Ravi glükokortikosteroididega (GKS-ravi) tuleb aga jätkata, et põletikulist liigesehaigust peri- ja postoperatiivses perioodis kontrolli all hoida ja ägenemist vältida. HMR-ravi võib jätkata pärast operatsioonihaavade paranemist.
| 22 | Kroonilise põletikulise liigesehaigusega patsient, kes läheb plaanilisele liigese endoproteesimise või muule luu(de) või liiges(t)e operatsioonile, suunake aegsasti (vähemalt kaks kuud) enne operatsiooni taastusarsti e-konsultatsioonile. Praktiline soovitus |
Kroonilise põletikulise liigesehaigusega patsient peaks plaanilise liigese endoproteesimise või muu luu(de) või liiges(t)e operatsiooni eel aegsasti taastusarsti juurde jõudma, et taastusarst jõuaks talle operatsioonijärgseks perioodiks füsio- ja tegevusteraapia korraldada ja abivahendeid soovitada.
Taastusarsti juurde peaks sellise patsiendi suunama kirurgilise ravi määranud arst: reumatoloog või ortopeed. Siiski tuleb Eestis kliinilises praktikas sageli ette, et patsient ei jõua operatsiooni eel taastusarsti vastuvõtule või jõuab sinna liiga hilja. Seepärast soovitabki töörühm perearstil võimalusel kontrollida, kas tema nimistusse kuuluva kroonilise põletikulise liigesehaigusega patsiendi, kes läheb plaanilisele liigese endoproteesimisele või muule luu(de)/liiges(t)e operatsioonile, on reumatoloog või ortopeed enne operatsiooni taastusarsti juurde suunanud.
Samas oli töörühm teadlik, et juhendi koostamise ajal (2019. aastal) ei võimalda igapäevatöös kasutatavad arvutiprogrammid perearstil või -õel väikese vaevaga, n-ö automaatselt oma nimistusse kuuluvate põletikulise liigesehaigusega patsientide kohta ülevaadet saada. Vastavaid andmeid peab iga patsiendi puhul individuaalselt käsitsi otsima.
Töörühm leidis aga, et juhul, kui suhtlusest patsiendiga selgub, et ta on sellisele operatsioonile minemas, peaks perearst või -õde kindlaks tegema, kas ta on juba taastusarsti juurde suunatud. Kui ei, siis tuleb ta taastusarsti e-konsultatsioonile suunata. Kui patsient peaks saama abivahendi soodustusega, kuid tal ei ole isikliku abivahendi kaarti, võiks perearst või -õde soovitada patsiendil kaart sotsiaalkindlustusametist taotleda.
| 23 | Kroonilise põletikulise liigesehaigusega patsiendi puhul kontrollige, kas ta on ühe aasta jooksul pärast haiguse diagnoosimist jõudnud taastusarsti vastuvõtule. Kui ei, suunake patsient taastusarsti e-konsultatsioonile. Praktiline soovitus |
Põletikulise liigesehaigusega patsiendi ravikompleksi kuulub lisaks farmakoteraapiale ka taastusravi. Tavapäraselt suunab Eestis põletikulise liigesehaigusega patsiendi kohe pärast haiguse diagnoosimist taastusarsti juurde reumatoloog. Perearstiga puutub patsient aga üldjuhul aeg-ajalt igasugustes tervisega seotud küsimustes kokku. Seetõttu leidis töörühm, et perearst võiks jälgida, kas patsient, kelle ta põletikulise liigesehaiguse kahtlusega reumatoloogi juurde suunas ja kelle põletikuline liigesehaigus diagnoositi, on üldse taastusarsti konsultatsioonile jõudnud.
Soovituses toodud ühe aasta piiri valis töörühm arvestades nii taastusravi võimalikult varase alguse olulisust (vt ka soovitust nr 13) kui ka perearsti või -õe töökoormust. Nimelt ei võimalda juhendi koostamise ajal (2019. aastal) igapäevatöös kasutatavad arvutiprogrammid perearstil/-õel väikese vaevaga (n-ö automaatselt) oma nimistusse kuuluvate põletikulise liigesehaigusega patsientide kohta ülevaadet saada ning kontrolli, kas kunagi tema poole pöördunud põletikulise liigesehaiguse kahtlusega patsiendil vastav diagnoos kinnitus ning kas ta on taastusarsti juurde jõudnud, tuleb teha iga patsiendi puhul individuaalselt (n-ö käsitsi).
Soovituses toodud ühe aasta piiri valis töörühm arvestades nii taastusravi võimalikult varase alguse olulisust (vt ka soovitust nr 13) kui ka perearsti või -õe töökoormust. Nimelt ei võimalda juhendi koostamise ajal (2019. aastal) igapäevatöös kasutatavad arvutiprogrammid perearstil/-õel väikese vaevaga (n-ö automaatselt) oma nimistusse kuuluvate põletikulise liigesehaigusega patsientide kohta ülevaadet saada ning kontrolli, kas kunagi tema poole pöördunud põletikulise liigesehaiguse kahtlusega patsiendil vastav diagnoos kinnitus ning kas ta on taastusarsti juurde jõudnud, tuleb teha iga patsiendi puhul individuaalselt (n-ö käsitsi).
| 24 | Kroonilise põletikulise liigesehaigusega patsiendi vaktsineerimisel järgige Eesti riiklikku immuniseerimiskava ja reumatoloogide soovitusi. Praktiline soovitus |
Töörühm pidas esmalt oluliseks välja tuua, et põletikuline liigesehaigus ei ole vaktsineerimise vastunäidustuseks, pigem vastupidi: patsienti on soovitatav vaktsineerida, järgides riiklikku vaktsinatsioonikava ja ka hooajalise gripi ja pneumokokknakkuse vastu.
Eestis juhindutakse vaktsineerimisel riiklikust immuniseerimiskavast (www.vaktsineeri.ee/index.php/et/riiklik-immuniseerimiskava).
Kroonilise põletikulise liigesehaigusega lapse puhul kehtivad inaktiveeritud vaktsiiniga vaktsineerimisel immuniseerimiskava soovitused. Võimalusel soovitab töörühm patsienti vaktsineerida enne HMR-ravi (sh bioloogilise ravi) alustamist. Vajaduse korral (eelkõige kasutades elus-nõrgestatud vaktsiini) tuleks konsulteerida lastereumatoloogiga.
Kroonilise põletikulise liigesehaigusega (eelkõige just HMR-ravi saava) täiskasvanud patsiendi vaktsineerimise ohutuse ja efektiivsuse asjus on Eesti arstkond kohati kõhkleval seisukohal olnud. Seetõttu koostas Eesti Reumatoloogia Selts (ERS) 2019. aastal „Eesti Reumatoloogia Seltsi soovitused reumaatilise haiguse tõttu bioloogilist ravi saavate täiskasvanud patsientide vaktsineerimiseks“, mis peatselt seltsi kodulehel avaldatakse.
Üldine soovitus on patsienti võimaluse korral vaktsineerida enne HMR-ravi (sh bioloogilise ravi) alustamist. Bioloogilise ravi saajate vaktsineerimisega tegeleb koostöös nakkushaiguste arstiga reumatoloog. Erandiks võib lugeda patsiendi vaktsineerimist hooajalise gripi vastu: seda võib patsient teha seal, kus talle kõige mugavam (sh perearsti või -õe juures).
Eestis juhindutakse vaktsineerimisel riiklikust immuniseerimiskavast (www.vaktsineeri.ee/index.php/et/riiklik-immuniseerimiskava).
Kroonilise põletikulise liigesehaigusega lapse puhul kehtivad inaktiveeritud vaktsiiniga vaktsineerimisel immuniseerimiskava soovitused. Võimalusel soovitab töörühm patsienti vaktsineerida enne HMR-ravi (sh bioloogilise ravi) alustamist. Vajaduse korral (eelkõige kasutades elus-nõrgestatud vaktsiini) tuleks konsulteerida lastereumatoloogiga.
Kroonilise põletikulise liigesehaigusega (eelkõige just HMR-ravi saava) täiskasvanud patsiendi vaktsineerimise ohutuse ja efektiivsuse asjus on Eesti arstkond kohati kõhkleval seisukohal olnud. Seetõttu koostas Eesti Reumatoloogia Selts (ERS) 2019. aastal „Eesti Reumatoloogia Seltsi soovitused reumaatilise haiguse tõttu bioloogilist ravi saavate täiskasvanud patsientide vaktsineerimiseks“, mis peatselt seltsi kodulehel avaldatakse.
Üldine soovitus on patsienti võimaluse korral vaktsineerida enne HMR-ravi (sh bioloogilise ravi) alustamist. Bioloogilise ravi saajate vaktsineerimisega tegeleb koostöös nakkushaiguste arstiga reumatoloog. Erandiks võib lugeda patsiendi vaktsineerimist hooajalise gripi vastu: seda võib patsient teha seal, kus talle kõige mugavam (sh perearsti või -õe juures).
Lisa 1. Patsiendi edasisuunamise algoritmid
Põletikulise liigesehaiguse kahtlusega täiskasvanud patsiendi edasisuunamine
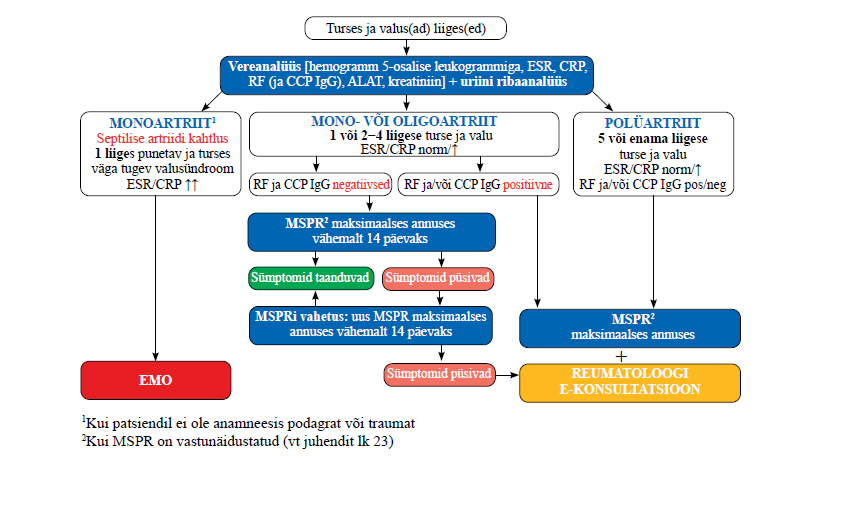

Põletikulise liigesehaiguse kahtlusega 8-18-aastase patsiendi edasisuunamine
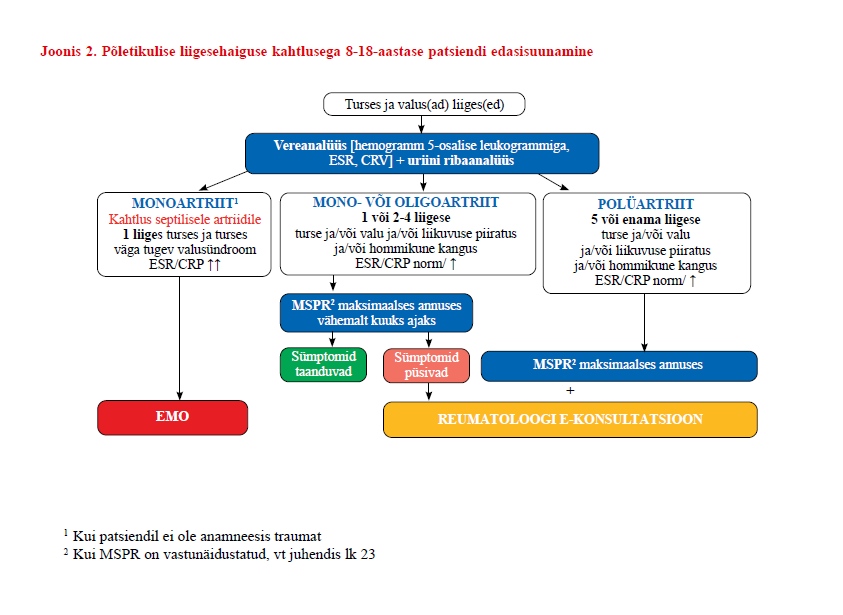

Põletikulise liigesehaiguse kahtlusega kuni 7-aastase (k.a.) lapse edasisuunamine
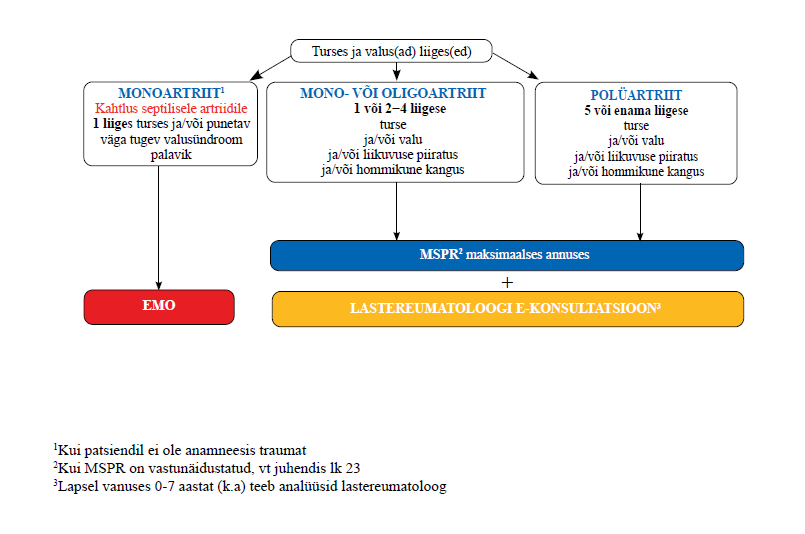

Lisa 2. Põletikulise liigesehaigusega HMR-ravi saava patsiendi käsitlus
Kasutatud kirjandus
Adams J, Burridge J, Mullee M, Hammond A, Cooper C. The clinical effectiveness of static resting splints in early rheumatoid arthritis: a randomized controlled trial. Rheumatology; 2008.
Al‐Qubaeissy KY, Fatoye FA, Goodwin PC, Yohannes A.M. The Effectiveness of Hydrotherapy in the Management of Rheumatoid Arthritis: A Systematic Review. Musculoskelet. Care; 2013.
Avina-Zubieta JA, Choi HK, et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis: A meta-analysis of observational studies. Arthritis Rheum. 2008 Dec 15; 59(12): 1690–7.
Baillet A, Vaillant M, Guinot M, Juvin R, Gaudin P. Efficacy of resistance exercises in rheumatoid arthritis: meta-analysis of randomized controlled trials. Rheumatology; 2012.
Baillet A, Zeboulon N, Gossec L, Combescure C, Bodin LA, Juvin R, Dougados M, Gaudin P. Efficacy of Cardiorespiratory Aerobic Exercise in Rheumatoid Arthritis: Meta-Analysis of Randomized Controlled Trials. Arthritis Care Res (Hoboken); 2010.
Bergstra SA, Murgia A, Te Velde AF, Caljouw SR. A systematic review into the effectiveness of hand exercise therapy in the treatment of rheumatoid arthritis. Clin Rheumatol. 2014 Nov; 33(11): 1539–48.
Bijlsma JWJ, Hachulla E et al. EULAR Textbook on Rheumatic Diseases, 3rd ed. 2018, 339.
Birkenfeldt R jt. Reumatoloogia. Tallinn: Medicina; 2012, 162.
Bobos P, Nazari G, Szekeres M, Lalone EA, Ferreira L, MacDermid JC. The effectiveness of joint-protection programs on pain, hand function, and grip strength levels in patients with hand arthritis: a systematic review and meta- analysis. J Hand Ther; 2019 Apr-Jun; 32(2): 194–211. Epub 2018 Dec 23.
Brosseau L, Wells GA, Tugwell P, Egan M, Dubouloz CJ, Casimiro L, Robinson VA, Pelland L, McGowan J, Bell M, Finestone HM, Légaré F, Caron C, Lineker S, Haines-Wangda A, Russell-Doreleyers M, Hall M, Cedar P, Lamb M. Ottawa Panel Evidence-Based Clinical Practice Guidelines for Therapeutic Exercises in the Management of Rheumatoid Arthritis in Adults. Physical Therapy; 2004.
Burghardt RD, Kazim MA, Rüther W, Niemeier A, Strahl A. The impact of physical activity on serum levels of inflammatory markers in rheumatoid arthritis: a systematic literature review. Rheumatol Int. 2019 May; 39(5): 793–804. Epub 2019 Mar 21.
Cairns AP, McVeigh J. A systematic review of the effects of dynamic exercise in
rheumatoid arthriti. Springer-Verlag; 2009.
Cameron-Fiddes V, Santos D. The use of ‘off-the-shelf’ foot orthoses in the reduction of foot symptoms in patients with early rheumatoid arthritis. Foot (Edinb); 2013.
Coda A, Fowlie PW, Davidson JE, Walsh J, Carline T, Santos D. Foot orthoses in children with juvenile idiopathic arthritis: a randomised controlled trial. Arch Dis Child; 2014.
Cramp F, Hewlett S, Almeida C, Kirwan JR, Choy EH, Chalder T, Pollock J, Christensen R. Non-pharmacological interventions for fatigue in rheumatoid arthritis. Cochrane Database of Systematic Reviews; 2013.
Daien CI, Hua C, Combe B, Landewe R. Non-pharmacological and pharmaco- logical interventions in patients with early arthritis: a systematic literature review informing the 2016 update of EULAR recommendations for the management of early arthritis. RMD Open; 2017.
Del Rincon I, Williams K, et al. High incidence of cardiovascular events in a rheumatoid arthritis cohort not explained by traditional cardiac risk factors. Arthritis Rheum. 2001 Dec; 44(12): 2737–45.
Eesti Haigekassa 2019. „Alaseljavalu diagnostika ja ravi esmatasandil (RJ-...)“. https://www.ravijuhend.ee/tervishoiuvarav/juhendid/125/alaseljavalu-diagnostika- ja-ravi-esmatasandil.
ESPOGUIA. Clinical guidelines for patients with spondyloarthritis. Sociedad Española de Reumatologia (ESPOGUIA); 2015. https://www.ser.es/wp-content/ uploads/2016/06/ENGLISH_updated_GPC_Treatment_SpondyloArthritis.pdf.
Geenen R, Overman CL, Christensen R, Åsenlöf P, Capela S, Huisinga KL, Husebø MEP, Köke AJA, Paskins Z, Pitsillidou IA, Savel C, Austin J, Hassett AL, Severijns G, Stoffer-Marx M, Vlaeyen JWS, Fernández-de-Las-Peñas C, Ryan SJ, Bergman S. EULAR recommendations for the health professional’s approach to pain management in inflammatory arthritis and osteoarthritis. Annals of the Rheumatic Diseases; 2018.
Gijon-Nogueron G, Ramos-Petersen L, Ortega-Avila AB, Morales-Asencio JM, Garcia-Mayor S. Effectiveness of foot orthoses in patients with rheumatoid arthritis related to disability and pain: a systematic review and meta-analysis. Qual Life Res; 2018.
GPAC. Rheumatoid Arthritis: Diagnosis, Management and Monitoring. Guide- lines and Protocols and Advisory Committee (GPAC); 2012. https://www2.gov. bc.ca/assets/gov/health/practitioner-pro/bc-guidelines/rheumatoid_arthritis.pdf.
Hammond A, Prior Y. The effectiveness of home hand exercise programmes in rheumatoid arthritis: a systematic review. Br Med Bull. 2016 Sep; 119(1): 49–62. Epub 2016 Jun 30.
Hammond A, Young A, Kidao R. (2004). A randomised controlled trial of occupational therapy for people with early rheumatoid arthritis. Annals of the rheumatic diseases; 63(1), 23–30.
Haskett S, Backman C, Porter B, Goyert J, Palejko G. A Crossover Trial of Custom-Made and Commercially Available Wrist Splints in Adults With Inflammatory Arthritis. Arthritis & Rheumatism; 2004.
Hurkmans E, van der Giesen FJ, Vliet Vlieland TP, Schoones J, Van den Ende EC. Dynamic exercise programs (aerobic capacity and/or muscle strength training) in patients with rheumatoid arthritis. Cochrane Database Syst Rev. 2009 Oct 7; (4): CD006853.
Kelley GA, Kelley KS, Callahan LF. Aerobic Exercise and Fatigue in Rheumatoid Arthritis Participants: A Meta-Analysis Using the Minimal Important Difference Approach. Arthritis Care Res (Hoboken). 2018 Dec; 70(12): 1735–9.
Klepper S, Mano Khong TT, Klotz R, Gregorek AO, Chan YC, Sawade S. Effects of Structured Exercise Training in Children and Adolescents With Juvenile Idiopathic Arthritis. Pediatr Phys Ther. 2019; 31(1): 3–21.
Kyburz D, Gabay C, Michel BA, et al. The long-term impact of early treatment of rheumatoid arthritis on radiographic progression: a population-based cohort study. Rheumatology (Oxford) 2011; 50: 1106–10.
Maradit-Kremers H, Crowson CS, et al. Increased unrecognized coronary heart disease and sudden deaths in rheumatoid arthritis: a population-based cohort study. Arthritis Rheum. 2005; 52(2): 402–11.
Metsios GS, Stavropoulos-Kalinoglou A, Veldhuijzen van Zanten JJ, Treharne GJ, Panoulas VF, Douglas KM, Koutedakis Y, Kitas GD. Rheumatoid arthritis, cardiovascular disease and physical exercise: a systematic review. Rheumatology; 2007.
Moura CS, Abrahamowicz M, Beauchamp ME, et al. Early medication use in new-onset rheumatoid arthritis may delay joint replacement: results of a large population-based study. Arthritis Res Ther 2015; 17: 197.
Nell VP, Machold KP, Eberl G, et al. Benefit of very early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology (Oxford) 2004; 43: 906–14.
NHMRC. Clinical guideline for the diagnosis and management of early rheumatoid arthritis. National Health and Medical Research Council (NHMRC); 2009. https://www.projecthealth.com.au/static/uploads/files/racgp-ra-guideline- wfatriobhnhp.pdf.
NICE. Psoriasis assessment and management [CG153]. National Institute for Health and Clinical Excellence (NICE); 2012. https://www.nice.org.uk/guidance/ cg153/evidence/full-guideline-pdf-188351533.
NICE. Rheumatoid arthritis in adults: management [NG100]. National Institute for Health and Clinical Excellence (NICE); 2018. https://www.nice.org.uk/guidance/ ng100
NICE. Spondyloarthritis in over 16s: diagnosis and management [NG65]. National Institute for Health and Clinical Excellence (NICE); 2017. https://www.nice.org. uk/guidance/ng65.
Otsa K, Tammaru M, Vorobjov S, Esko M, Pärsik E, Lang K. The prevalence of rheumatoid arthritis in Estonia: an estimate based on rheumatology patients’ database. Rheumatol Int 2013; 33: 955–8.
Park Y, Chang M. Effects of rehabilitation for pain relief in patients with rheumatoid
arthritis: a systematic review. The Journal of Physical Therapy Science; 2016.
Peres D, Sagawa Y Jr, Dugué B, Domenech SC, Tordi N, Prati C. The practice of physical activity and cryotherapy in rheumatoid arthritis: systematic review. Eur J Phys Rehabil Med. 2017 Oct; 53(5): 775–87. Epub 2016 Dec 19.
Powell M, Seid M, Szer IS. Efficacy of custom foot orthotics in improving pain and functional status in children with juvenile idiopathic arthritis: a randomized trial. J Rheumatol; 2005.
Pruunsild C, Liivamägi H, Uibo K, Tarraste S, Talvik T, Pelkonen P. Incidence of juvenile idiopathic erthritis in children in Estonia: a prospective population-based study. Scand J Rheumatol. 2007 Jan-Feb; 36(1): 7–13.
Radner H, Lesperance T, et al. Incidence and Prevalence of Cardiovascular Risk Factors Among Patients With Rheumatoid Arthritis, Psoriasis, or Psoriatic Arthritis. Arthritis Care Res (Hoboken). 2017; 69(10): 1510–18.
Ramsey L, Winder RJ, McVeigh JG. The effectiveness of working wrist splints in adults with rheumatoid arthritis: a mixed methods systematic review. J Rehabil Med; 2014.
Rausch Osthoff A, Juhl CB, Knittle K, et al. Effects of exercise and physical activity promotion: meta-analysis informing the 2018 EULAR recommendations for physical activity in people with rheumatoid arthritis, spondyloarthritis and hip/knee osteoarthritis. RMD Open 2018; 4:e000713.
Reina-Bueno M, Vázquez-Bautista MDC, Pérez-García S, Rosende-Bautista C, Sáez-Díaz A, Munuera-Martínez PV. Effectiveness of custom-made foot orthoses in patients with rheumatoid arthritis: a randomized controlled trial. Clin Rehabil; 2019.
Rohekar S, Chan J, Tse SM, et al. 2014 Update of the Canadian Rheumatology Association/Spondyloarthritis Research Consortium of Canada Treatment Recommendations for the Management of Spondyloarthritis. Part II: Specific Management Recommendations. J Rheumatol. 2015; 42(4): 665–81. Epub 2015 Feb 15.
Rongen-van Dartel SA, Repping-Wuts H, Flendrie M, Bleijenberg G, Metsios GS, van den Hout WB, van den Ende CH, Neuberger G, Reid A, van Riel PL, Fransen J. Effect of Aerobic Exercise Training on Fatigue in Rheumatoid Arthritis: A Meta-Analysis. Arthritis Care Res (Hoboken). 2015 Aug; 67(8): 1054–62.
Santos, EJF, Duarte C, Marques A, Cardoso D, Apóstolo J, da Silva JAP, Barbieri-Figueiredo M. Effectiveness of non-pharmacological and non-surgical interventions for rheumatoid arthritis: an umbrella review. JBI Database of Systematic Reviews and Implementation Reports; 2019.
Siegel P, Tencza M, Apodaca B, Poole JL. Effectiveness of Occupational Therapy Interventions for Adults With Rheumatoid Arthritis: A Systematic Review. Am J Occup Ther. 2017; 71(1): 7101180050p1–7101180050p11.
SIGN. Diagnosis and management of psoriasis and psoriatic arthritis in adults [SIGN121]. Scottish Intercollegiate Guidelines Network (SIGN); 2010. https:// www.sign.ac.uk/assets/sign121.pdf.
SIGN. Management of early rheumatoid arthritis [SIGN123]. Scottish Inter-collegiate Guidelines Network (SIGN); 2011. https://www.sign.ac.uk/assets/ sign123.pdf.
Silva AC, Jones A, Gabriel Silva P, Natour J. Effectiveness of a night-time hand positioning splint in rheumatoid arthritis: a randomized controlled trial. J Rehabil Med; 2008.
Silva PG, Lombardi I, Breitschwerdt C, Poli Araujo PM, Natour J. Functional thumb orthosis for type I and II boutonniere deformity on the dominant hand in patients with rheumatoid arthritis: a randomized controlled study. Clinical Rehabilitation; 2008.
Singh JA, Saag KG, S. Bridges SL Jr, et al. 2015. American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2016 Jan; 68(1): 1–25. Epub 2015 Nov 6.
Smolen JS, Landewé R, Bijlsma J, et al. 2016 update of the EULAR recommendations for the management of early arthritis. Ann Rheum Dis. 2017; 76(6): 960–77. Epub 2017 Mar 6.
Smolen JS, Landewé R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017 Jun; 76(6): 960–77. Epub 2017 Mar 6.
Solomon DH, Goodson NJ, et al. Patterns of cardiovascular risk in rheumatoid arthritis. Ann Rheum Dis. 2006 Dec; 65(12): 1608–12.
Steultjens EM, Dekker J, Bouter LM, van Schaardenburg D, van Kuyk MA, van den Ende CH. Occupational therapy for rheumatoid arthritis. Cochrane Database Syst Rev. 2004; (1): CD003114.
Tenten Diepenmaat M, van der Leeden M, Vliet Vlieland TPM, Roorda LD, Dekker J. The effectiveness of therapeutic shoes in patients with rheumatoid arthritis: a systematic review and meta-analysis. Rheumatology International; 2018.
Tervise Arengu Instituut. Esmashaigestumus 100 000 elaniku kohta soo ja vanuserühma järgi. Tervisestatistika ja terviseuuringute andmebaas. http://pxweb.tai.ee/ PXWeb2015/pxweb/et/02Haigestumus/02Haigestumus__01Esmashaigestumus/ EH12.px/?rxid=f67d1ba1-274c-4501-b4e3-b2917183b39e.
Tuvik P. Reumatoidartriit. Juhendmaterjal patsientidele; 2008. https://media.voog. com/0000/0044/8154/files/Reumatoidartriit%20Juhendmaterjal%20patsiendile%20_ eesti1.pdf.
Vabariigi valitsus 2019: Vabariigi valitsus. Eesti Haigekassa tervishoiuteenuste loetelu. RT I, 28.06.2019, 11. https://www.riigiteataja.ee/akt/128062019011 (vaadatud 13.12.2019).
Van Aken J, Lard LR, le Cessie S, et al. Radiological outcome after four years of early versus delayed treatment strategy in patients with recent onset rheumatoid arthritis. Ann Rheum Dis 2004; 63: 274–9.
Van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76(6): 978–91. Epub 2017 Jan 13.
Viigimaa M, Eha J, Hedman A, jt. Eesti südame- ja veresoonkonnahaiguste preventsiooni juhend. Eesti Arst 2006; 85(3): 182–216. https://eestiarst.ee/eesti- sudame-ja-veresoonkonnahaiguste-preventsiooni-juhend/.
Ward MM, Deodhar A, Akl EA, et al. American College of Rheumatology/ Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 recommendations for the treatment of ankylosing spondylitis and nonradiographic axial spondyloarthritis. Arthritis Care Res 2016; 68: 151–66.
Williams MA, Srikesavan C, Heine PJ, Bruce J, Brosseau L, Hoxey-Thomas N, Lamb SE. Exercise for rheumatoid arthritis of the hand. Cochrane Database Syst Rev. 2018 Jul 31; 7: CD003832.
Al‐Qubaeissy KY, Fatoye FA, Goodwin PC, Yohannes A.M. The Effectiveness of Hydrotherapy in the Management of Rheumatoid Arthritis: A Systematic Review. Musculoskelet. Care; 2013.
Avina-Zubieta JA, Choi HK, et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis: A meta-analysis of observational studies. Arthritis Rheum. 2008 Dec 15; 59(12): 1690–7.
Baillet A, Vaillant M, Guinot M, Juvin R, Gaudin P. Efficacy of resistance exercises in rheumatoid arthritis: meta-analysis of randomized controlled trials. Rheumatology; 2012.
Baillet A, Zeboulon N, Gossec L, Combescure C, Bodin LA, Juvin R, Dougados M, Gaudin P. Efficacy of Cardiorespiratory Aerobic Exercise in Rheumatoid Arthritis: Meta-Analysis of Randomized Controlled Trials. Arthritis Care Res (Hoboken); 2010.
Bergstra SA, Murgia A, Te Velde AF, Caljouw SR. A systematic review into the effectiveness of hand exercise therapy in the treatment of rheumatoid arthritis. Clin Rheumatol. 2014 Nov; 33(11): 1539–48.
Bijlsma JWJ, Hachulla E et al. EULAR Textbook on Rheumatic Diseases, 3rd ed. 2018, 339.
Birkenfeldt R jt. Reumatoloogia. Tallinn: Medicina; 2012, 162.
Bobos P, Nazari G, Szekeres M, Lalone EA, Ferreira L, MacDermid JC. The effectiveness of joint-protection programs on pain, hand function, and grip strength levels in patients with hand arthritis: a systematic review and meta- analysis. J Hand Ther; 2019 Apr-Jun; 32(2): 194–211. Epub 2018 Dec 23.
Brosseau L, Wells GA, Tugwell P, Egan M, Dubouloz CJ, Casimiro L, Robinson VA, Pelland L, McGowan J, Bell M, Finestone HM, Légaré F, Caron C, Lineker S, Haines-Wangda A, Russell-Doreleyers M, Hall M, Cedar P, Lamb M. Ottawa Panel Evidence-Based Clinical Practice Guidelines for Therapeutic Exercises in the Management of Rheumatoid Arthritis in Adults. Physical Therapy; 2004.
Burghardt RD, Kazim MA, Rüther W, Niemeier A, Strahl A. The impact of physical activity on serum levels of inflammatory markers in rheumatoid arthritis: a systematic literature review. Rheumatol Int. 2019 May; 39(5): 793–804. Epub 2019 Mar 21.
Cairns AP, McVeigh J. A systematic review of the effects of dynamic exercise in
rheumatoid arthriti. Springer-Verlag; 2009.
Cameron-Fiddes V, Santos D. The use of ‘off-the-shelf’ foot orthoses in the reduction of foot symptoms in patients with early rheumatoid arthritis. Foot (Edinb); 2013.
Coda A, Fowlie PW, Davidson JE, Walsh J, Carline T, Santos D. Foot orthoses in children with juvenile idiopathic arthritis: a randomised controlled trial. Arch Dis Child; 2014.
Cramp F, Hewlett S, Almeida C, Kirwan JR, Choy EH, Chalder T, Pollock J, Christensen R. Non-pharmacological interventions for fatigue in rheumatoid arthritis. Cochrane Database of Systematic Reviews; 2013.
Daien CI, Hua C, Combe B, Landewe R. Non-pharmacological and pharmaco- logical interventions in patients with early arthritis: a systematic literature review informing the 2016 update of EULAR recommendations for the management of early arthritis. RMD Open; 2017.
Del Rincon I, Williams K, et al. High incidence of cardiovascular events in a rheumatoid arthritis cohort not explained by traditional cardiac risk factors. Arthritis Rheum. 2001 Dec; 44(12): 2737–45.
Eesti Haigekassa 2019. „Alaseljavalu diagnostika ja ravi esmatasandil (RJ-...)“. https://www.ravijuhend.ee/tervishoiuvarav/juhendid/125/alaseljavalu-diagnostika- ja-ravi-esmatasandil.
ESPOGUIA. Clinical guidelines for patients with spondyloarthritis. Sociedad Española de Reumatologia (ESPOGUIA); 2015. https://www.ser.es/wp-content/ uploads/2016/06/ENGLISH_updated_GPC_Treatment_SpondyloArthritis.pdf.
Geenen R, Overman CL, Christensen R, Åsenlöf P, Capela S, Huisinga KL, Husebø MEP, Köke AJA, Paskins Z, Pitsillidou IA, Savel C, Austin J, Hassett AL, Severijns G, Stoffer-Marx M, Vlaeyen JWS, Fernández-de-Las-Peñas C, Ryan SJ, Bergman S. EULAR recommendations for the health professional’s approach to pain management in inflammatory arthritis and osteoarthritis. Annals of the Rheumatic Diseases; 2018.
Gijon-Nogueron G, Ramos-Petersen L, Ortega-Avila AB, Morales-Asencio JM, Garcia-Mayor S. Effectiveness of foot orthoses in patients with rheumatoid arthritis related to disability and pain: a systematic review and meta-analysis. Qual Life Res; 2018.
GPAC. Rheumatoid Arthritis: Diagnosis, Management and Monitoring. Guide- lines and Protocols and Advisory Committee (GPAC); 2012. https://www2.gov. bc.ca/assets/gov/health/practitioner-pro/bc-guidelines/rheumatoid_arthritis.pdf.
Hammond A, Prior Y. The effectiveness of home hand exercise programmes in rheumatoid arthritis: a systematic review. Br Med Bull. 2016 Sep; 119(1): 49–62. Epub 2016 Jun 30.
Hammond A, Young A, Kidao R. (2004). A randomised controlled trial of occupational therapy for people with early rheumatoid arthritis. Annals of the rheumatic diseases; 63(1), 23–30.
Haskett S, Backman C, Porter B, Goyert J, Palejko G. A Crossover Trial of Custom-Made and Commercially Available Wrist Splints in Adults With Inflammatory Arthritis. Arthritis & Rheumatism; 2004.
Hurkmans E, van der Giesen FJ, Vliet Vlieland TP, Schoones J, Van den Ende EC. Dynamic exercise programs (aerobic capacity and/or muscle strength training) in patients with rheumatoid arthritis. Cochrane Database Syst Rev. 2009 Oct 7; (4): CD006853.
Kelley GA, Kelley KS, Callahan LF. Aerobic Exercise and Fatigue in Rheumatoid Arthritis Participants: A Meta-Analysis Using the Minimal Important Difference Approach. Arthritis Care Res (Hoboken). 2018 Dec; 70(12): 1735–9.
Klepper S, Mano Khong TT, Klotz R, Gregorek AO, Chan YC, Sawade S. Effects of Structured Exercise Training in Children and Adolescents With Juvenile Idiopathic Arthritis. Pediatr Phys Ther. 2019; 31(1): 3–21.
Kyburz D, Gabay C, Michel BA, et al. The long-term impact of early treatment of rheumatoid arthritis on radiographic progression: a population-based cohort study. Rheumatology (Oxford) 2011; 50: 1106–10.
Maradit-Kremers H, Crowson CS, et al. Increased unrecognized coronary heart disease and sudden deaths in rheumatoid arthritis: a population-based cohort study. Arthritis Rheum. 2005; 52(2): 402–11.
Metsios GS, Stavropoulos-Kalinoglou A, Veldhuijzen van Zanten JJ, Treharne GJ, Panoulas VF, Douglas KM, Koutedakis Y, Kitas GD. Rheumatoid arthritis, cardiovascular disease and physical exercise: a systematic review. Rheumatology; 2007.
Moura CS, Abrahamowicz M, Beauchamp ME, et al. Early medication use in new-onset rheumatoid arthritis may delay joint replacement: results of a large population-based study. Arthritis Res Ther 2015; 17: 197.
Nell VP, Machold KP, Eberl G, et al. Benefit of very early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology (Oxford) 2004; 43: 906–14.
NHMRC. Clinical guideline for the diagnosis and management of early rheumatoid arthritis. National Health and Medical Research Council (NHMRC); 2009. https://www.projecthealth.com.au/static/uploads/files/racgp-ra-guideline- wfatriobhnhp.pdf.
NICE. Psoriasis assessment and management [CG153]. National Institute for Health and Clinical Excellence (NICE); 2012. https://www.nice.org.uk/guidance/ cg153/evidence/full-guideline-pdf-188351533.
NICE. Rheumatoid arthritis in adults: management [NG100]. National Institute for Health and Clinical Excellence (NICE); 2018. https://www.nice.org.uk/guidance/ ng100
NICE. Spondyloarthritis in over 16s: diagnosis and management [NG65]. National Institute for Health and Clinical Excellence (NICE); 2017. https://www.nice.org. uk/guidance/ng65.
Otsa K, Tammaru M, Vorobjov S, Esko M, Pärsik E, Lang K. The prevalence of rheumatoid arthritis in Estonia: an estimate based on rheumatology patients’ database. Rheumatol Int 2013; 33: 955–8.
Park Y, Chang M. Effects of rehabilitation for pain relief in patients with rheumatoid
arthritis: a systematic review. The Journal of Physical Therapy Science; 2016.
Peres D, Sagawa Y Jr, Dugué B, Domenech SC, Tordi N, Prati C. The practice of physical activity and cryotherapy in rheumatoid arthritis: systematic review. Eur J Phys Rehabil Med. 2017 Oct; 53(5): 775–87. Epub 2016 Dec 19.
Powell M, Seid M, Szer IS. Efficacy of custom foot orthotics in improving pain and functional status in children with juvenile idiopathic arthritis: a randomized trial. J Rheumatol; 2005.
Pruunsild C, Liivamägi H, Uibo K, Tarraste S, Talvik T, Pelkonen P. Incidence of juvenile idiopathic erthritis in children in Estonia: a prospective population-based study. Scand J Rheumatol. 2007 Jan-Feb; 36(1): 7–13.
Radner H, Lesperance T, et al. Incidence and Prevalence of Cardiovascular Risk Factors Among Patients With Rheumatoid Arthritis, Psoriasis, or Psoriatic Arthritis. Arthritis Care Res (Hoboken). 2017; 69(10): 1510–18.
Ramsey L, Winder RJ, McVeigh JG. The effectiveness of working wrist splints in adults with rheumatoid arthritis: a mixed methods systematic review. J Rehabil Med; 2014.
Rausch Osthoff A, Juhl CB, Knittle K, et al. Effects of exercise and physical activity promotion: meta-analysis informing the 2018 EULAR recommendations for physical activity in people with rheumatoid arthritis, spondyloarthritis and hip/knee osteoarthritis. RMD Open 2018; 4:e000713.
Reina-Bueno M, Vázquez-Bautista MDC, Pérez-García S, Rosende-Bautista C, Sáez-Díaz A, Munuera-Martínez PV. Effectiveness of custom-made foot orthoses in patients with rheumatoid arthritis: a randomized controlled trial. Clin Rehabil; 2019.
Rohekar S, Chan J, Tse SM, et al. 2014 Update of the Canadian Rheumatology Association/Spondyloarthritis Research Consortium of Canada Treatment Recommendations for the Management of Spondyloarthritis. Part II: Specific Management Recommendations. J Rheumatol. 2015; 42(4): 665–81. Epub 2015 Feb 15.
Rongen-van Dartel SA, Repping-Wuts H, Flendrie M, Bleijenberg G, Metsios GS, van den Hout WB, van den Ende CH, Neuberger G, Reid A, van Riel PL, Fransen J. Effect of Aerobic Exercise Training on Fatigue in Rheumatoid Arthritis: A Meta-Analysis. Arthritis Care Res (Hoboken). 2015 Aug; 67(8): 1054–62.
Santos, EJF, Duarte C, Marques A, Cardoso D, Apóstolo J, da Silva JAP, Barbieri-Figueiredo M. Effectiveness of non-pharmacological and non-surgical interventions for rheumatoid arthritis: an umbrella review. JBI Database of Systematic Reviews and Implementation Reports; 2019.
Siegel P, Tencza M, Apodaca B, Poole JL. Effectiveness of Occupational Therapy Interventions for Adults With Rheumatoid Arthritis: A Systematic Review. Am J Occup Ther. 2017; 71(1): 7101180050p1–7101180050p11.
SIGN. Diagnosis and management of psoriasis and psoriatic arthritis in adults [SIGN121]. Scottish Intercollegiate Guidelines Network (SIGN); 2010. https:// www.sign.ac.uk/assets/sign121.pdf.
SIGN. Management of early rheumatoid arthritis [SIGN123]. Scottish Inter-collegiate Guidelines Network (SIGN); 2011. https://www.sign.ac.uk/assets/ sign123.pdf.
Silva AC, Jones A, Gabriel Silva P, Natour J. Effectiveness of a night-time hand positioning splint in rheumatoid arthritis: a randomized controlled trial. J Rehabil Med; 2008.
Silva PG, Lombardi I, Breitschwerdt C, Poli Araujo PM, Natour J. Functional thumb orthosis for type I and II boutonniere deformity on the dominant hand in patients with rheumatoid arthritis: a randomized controlled study. Clinical Rehabilitation; 2008.
Singh JA, Saag KG, S. Bridges SL Jr, et al. 2015. American College of Rheumatology Guideline for the Treatment of Rheumatoid Arthritis. Arthritis Care Res (Hoboken). 2016 Jan; 68(1): 1–25. Epub 2015 Nov 6.
Smolen JS, Landewé R, Bijlsma J, et al. 2016 update of the EULAR recommendations for the management of early arthritis. Ann Rheum Dis. 2017; 76(6): 960–77. Epub 2017 Mar 6.
Smolen JS, Landewé R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis. 2017 Jun; 76(6): 960–77. Epub 2017 Mar 6.
Solomon DH, Goodson NJ, et al. Patterns of cardiovascular risk in rheumatoid arthritis. Ann Rheum Dis. 2006 Dec; 65(12): 1608–12.
Steultjens EM, Dekker J, Bouter LM, van Schaardenburg D, van Kuyk MA, van den Ende CH. Occupational therapy for rheumatoid arthritis. Cochrane Database Syst Rev. 2004; (1): CD003114.
Tenten Diepenmaat M, van der Leeden M, Vliet Vlieland TPM, Roorda LD, Dekker J. The effectiveness of therapeutic shoes in patients with rheumatoid arthritis: a systematic review and meta-analysis. Rheumatology International; 2018.
Tervise Arengu Instituut. Esmashaigestumus 100 000 elaniku kohta soo ja vanuserühma järgi. Tervisestatistika ja terviseuuringute andmebaas. http://pxweb.tai.ee/ PXWeb2015/pxweb/et/02Haigestumus/02Haigestumus__01Esmashaigestumus/ EH12.px/?rxid=f67d1ba1-274c-4501-b4e3-b2917183b39e.
Tuvik P. Reumatoidartriit. Juhendmaterjal patsientidele; 2008. https://media.voog. com/0000/0044/8154/files/Reumatoidartriit%20Juhendmaterjal%20patsiendile%20_ eesti1.pdf.
Vabariigi valitsus 2019: Vabariigi valitsus. Eesti Haigekassa tervishoiuteenuste loetelu. RT I, 28.06.2019, 11. https://www.riigiteataja.ee/akt/128062019011 (vaadatud 13.12.2019).
Van Aken J, Lard LR, le Cessie S, et al. Radiological outcome after four years of early versus delayed treatment strategy in patients with recent onset rheumatoid arthritis. Ann Rheum Dis 2004; 63: 274–9.
Van der Heijde D, Ramiro S, Landewé R, et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017; 76(6): 978–91. Epub 2017 Jan 13.
Viigimaa M, Eha J, Hedman A, jt. Eesti südame- ja veresoonkonnahaiguste preventsiooni juhend. Eesti Arst 2006; 85(3): 182–216. https://eestiarst.ee/eesti- sudame-ja-veresoonkonnahaiguste-preventsiooni-juhend/.
Ward MM, Deodhar A, Akl EA, et al. American College of Rheumatology/ Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 recommendations for the treatment of ankylosing spondylitis and nonradiographic axial spondyloarthritis. Arthritis Care Res 2016; 68: 151–66.
Williams MA, Srikesavan C, Heine PJ, Bruce J, Brosseau L, Hoxey-Thomas N, Lamb SE. Exercise for rheumatoid arthritis of the hand. Cochrane Database Syst Rev. 2018 Jul 31; 7: CD003832.
