Palliatiivne ravi (II osa). Erakorraliste seisundite käsitlus, elulõpuravi ja palliatiivse ravi korraldus.
Ravijuhendi koostajad
Ravijuhendi töörühma liikmed
Ravijuhendi sekretariaadi liikmed
Ravijuhendi konsultandid
| Pille Sillaste (juht) | Anestesioloog-ülemarst, keskuse juhataja, SA Põhja-Eesti Regionaalhaigla taastus- ja palliatiivravi kliiniku palliatiivravi keskus |
| Jelena Leibur | Sisearst, juhataja, SA EELK Tallinna Diakooniahaigla |
| Mare Kolk | Anestesioloog-vanemarst, SA Põhja-Eesti Regionaalhaigla taastus- ja palliatiivravi kliiniku palliatiivravi keskus |
| Katrin Elmet | Anestesioloog, arst-õppejõud, SA Tartu Ülikooli Kliinikumi anestesioloogia ja intensiivravi kliinik |
| Kadri Suija | Kaasprofessor, Tartu Ülikooli peremeditsiini ja rahvatervishoiu instituut Perearst, Ülikooli Perearstikeskus OÜ |
| Vanda Kristjan | Perearst, Mähe Perearst OÜ |
| Mari Lõhmus | Onkoloog, kliiniku juhataja, SA Põhja-Eesti Regionaalhaigla taastus- ja palliatiivravi kliinik |
| Svetlana Gromova | Õde, SA Tartu Ülikooli Kliinikumi spordimeditsiini ja taastusravi kliinik |
| Liina Kivi (töörühmas kuni august 2020) | Terviseõde, OÜ Medendi, AS Fertilitas |
| Aina Saarma (töörühmas alates september 2020) | Koduõde, vastutav õde, Medendi OÜ |
| Merike Värik | Patsientide esindaja, kogemusnõustaja, vaimse tervise õde, SA Põhja-Eesti Regionaalhaigla Põhja-Eesti Vähihaigete Ühendus MTÜ, Rinnavähk BCF MTÜ |
| Made Bambus | Peaspetsialist, esmatasandi teenuste osakond, Eesti Haigekassa |
| Kaire Pakkonen (juht) | Anestesioloog, SA Pärnu Haigla anestesioloogia, operatiiv- ja intensiivraviteenistus |
| Jana Lass | Kliiniline proviisor, SA Tartu Ülikooli Kliinikumi apteek |
| Marika Saar | Kliiniline proviisor, SA Tartu Ülikooli Kliinikumi apteek |
| Pille Kilgi | Anestesioloog, SA Pärnu Haigla anestesioloogia, operatiiv- ja intensiivraviteenistus |
| Ivi Normet | Peremeditsiini arst-resident |
| Anna Vesper | Ravijuhendite metoodikanõunik, Tartu Ülikooli peremeditsiini ja rahvatervishoiu instituut |
| Agnes Aart | Ravijuht, Lõuna-Eesti Haigla AS |
| Kristiina Põld | Erakorralise meditsiini vanemarst, SA Põhja-Eesti Regionaalhaigla erakorralise meditsiini osakond |
| Katri Aaslav-Tepandi | Hingehoidja, SA Põhja-Eesti Regionaalhaigla taastus- ja palliatiivravi kliinik Vanemkaplan, Sotsiaalministeerium |
Lühendid ja mõisted
Lühendid
Mõisted
| AGREE | Ravijuhendite hindamise töövahend, ingl appraisal of guidelines research and evaluation instrument |
| AIDS | Omandatud immuunpuudulikkuse sündroom, ingl acquired immune deficiency syndrome |
| ASCO | Ameerika Kliinilise Onkoloogia Ühing, ingl American Society of Clinical Oncology |
| CADTH | Kanada ravimi- ja tervishoiutehnoloogia amet, ingl Canadian Agency for Drugs and Technologies in Health |
| CYP-ensüümid | Tsütokroom P450 ensüümid, ravimeid metaboliseerivad ensüümid |
| EAPC | Euroopa Palliatiivse Ravi Assotsiatsioon, ingl European Association for Palliative Care |
| ECOG | Sooritusvõime staatuse skaala kasvajaga patsientidel, ingl Eastern Cooperative Oncology Group (ECOG) performance status |
| EMO | Erakorralise meditsiini osakond |
| ESMO | Euroopa Meditsiinilise Onkoloogia Ühing, ingl European Society for Medical Oncology |
| ESPEN | Euroopa Kliinilise Toitmise Selts, ingl European Society for Clinical Nutrition and Metabolism |
| GIN | Rahvusvaheline ravijuhendite võrgustik, ingl Guidelines International Network |
| IPOS | Integreeritud palliatiivravi tulemusmõõdik, ingl Integrated Palliative Care Outcome Scale |
| KOK | Krooniline obstruktiivne kopsuhaigus |
| MPE | Maliigne pleuraefusioon |
| MSPVR | Mittesteroidne põletikuvastane ravim, ingl nonsteroidal anti- inflammatory drug (NSAID) |
| NICE | Ühendkuningriigi riiklik tervishoiu ja kliinilise kvaliteedi instituut, ingl The National Institute for Health and Care Excellence |
| NCCN | National Comprehensive Cancer Network |
| RCT | Juhuslikustatud kontrollitud uuring, ingl randomized controlled trial |
| SSRI | Selektiivne serotoniini tagasihaarde inhibiitor, ingl selective serotonin reuptake inhibitors |
| WHO | Maailma Terviseorganisatsioon, ingl World Health Organization |
Mõisted
| Anasarka | Generaliseerunud turse, vedeliku kogunemine nahas ja nahaaluses koes |
| Antikonvulsant | Epilepsiavastane ravim |
| Düsfaagia | Neelamishäire |
| Düsuuria | Valu või ebamugavustunne urineerimisel |
| Ekspertkeskus (ingl centre of excellence) |
Regionaalsel tasandil osutatav spetsialiseeritud palliatiivse ravi keskus, mis tegeleb lisaks spetsialiseeritud palliatiivse ravi osutamisele teadustöö, koolitamise, uute meetodite ja standardite väljatöötamisega |
| Elukvaliteet |
Inimese subjektiivne hinnang oma positsioonile elus väärtussüsteemi ja kultuurikeskkonna kontekstis. Hinnangud on seotud inimese ootuste, eesmärkide, elustandardite ja tajutud probleemidega (Maailma Terviseorganisatsioon) |
| Elulõpuravi (ingl end of life care, best supportive care, comfort measures only) |
Elulõpuravi (ka parim toetav ravi, ainult vaevusi leevendav ravi, hospiitsravi) on palliatiivse ravi osa, mis algab, kui haigusspetsiifiline ravi on ammendunud, kuid seisundi raskuse tõttu vajab inimene palliatiivse ravi teenuseid. Elulõpuravi peamine eesmärk on vaevuste leevendamine, inimväärikust austav põetamine ja parima võimaliku elukvaliteedi võimaldamine surmani, rahu ja väärikas surm ning perede toetamine, leinatöö surma saabudes ja selle järel. Patsiendi eeldatav elupikkus on kuus kuud kuni üks aasta. Teenust osutatakse kodus, hooldekodus, ambulatoorselt, statsionaarselt (õendusabiosakonnas, haiglas). |
| Esmane palliatiivne ravi (ingl palliative approach, general palliative care) | Palliatiivse ravi põhimõtete järgimine tervishoiuteenuse osutajate poolt, kelle põhitöö ei ole palliatiivne ravi, kuid kes tegelevad oma töös palliatiivset ravi vajavate patsientidega; perearstiabis, õendusabis (sh hooldekodudes) osutatav palliatiivne rav |
| Hingehoid (ingl pastoral care) |
Patsiendi ja lähedaste toetamine ning nõustamine kannatuses, kriisis ja leinas, lähtudes abivajaja vajadustest ja usulistest veendumustest ning keskendudes spirituaalsetele, eksistentsiaalsetele ja religioossetele teemadele. Tegevuste alla kuuluvad ka tervishoiutöötajate ja tugispetsialistide poolne nõustamine surma ja leina teemadel, läbipõlemise ennetus, supervisioon ja koolitused. |
| Hingehoidja | Teoloogilise kõrgharidusega ja hingehoiu väljaõppega spetsialist (vaimulik pühitsus ei ole nõutud) |
| Interdistsiplinaarne meeskond |
Erialaspetsialistide koostöö patsiendi ja tema lähedaste vajaduste rahuldamiseks. Meeskonda kuuluvad ka patsient ja tema lähedased. Meeskond hindab patsiendi ja lähedaste vajadusi, püstitab eesmärgid, koostab raviplaani ja hindab tulemusi ühiselt. Igal meeskonnaliikmel on oma erialast tulenev roll patsiendi ravis ja lähedaste toetamisel. |
| Juhtumikorraldaja (ingl case manager, case coordinator) |
Spetsialiseeritud palliatiivse ravi meeskonna liige, kellel on ülevaade ja teadmised palliatiivse ravi võimalustest. Juhtumikorraldaja koordineerib sotsiaal- ja tervishoiuvaldkonna koostööd ja eri asutuste koostööd ning leiab tervikliku lahenduse patsiendi ja lähedase komplekssetele probleemidele. |
| Kaplan | Teoloogilise kõrgharidusega ja hingehoiu väljaõppega spetsialist (vaimulik pühitsus on nõutud) |
| Karnofsky indeks | Üldseisundi hindamise skaala kasvajaga patsientidel |
| Lein ja leinatöö |
Lein on protsess, mille kestel kogeb inimene kaotusvalu ja kurbust. Leinatöö tähendab leina eri staadiumide läbimist tavapärase elu taastumiseks, et kohaneda eluga uues olukorras või eluga ilma lahkunuta. |
| Maliigne | Pahaloomuline |
| Massiivne verejooks | Verejooks, mis lõpeb minutite jooksul surmaga |
| Palliatiivne ravi |
Interdistsiplinaarne terviklik aktiivne ravi, mis on suunatud elu ohustava ja elukvaliteeti halvendava tervisliku seisundiga patsientide ja nende lähedaste elukvaliteedi parandamisele elu lõpuni kogu haiguse vältel. Palliatiivse ravi eesmärk on aegsasti märgata, hinnata ja ravida haigusest ning selle ravist tingitud valu ja teisi kehalisi vaevusi, samuti leevendada psühhosotsiaalseid kannatusi. |
| Palliatiivse ravi plaan |
Arsti tehtud haigusloo sissekanne, mis peab sisaldama sel hetkel patsiendi seisundist lähtuvaid sümptomaatilise ravi otsuseid, edaspidi vajalikke tegevusi ning arvestab patsiendi ja tema lähedaste soove |
| Palliatiivse ravi võrgustik |
Mitmetasandiline süsteem, mis ühendab ja koordineerib eri asutusi ning teenuseid ja parandab palliatiivse ravi kättesaadavust, kvaliteeti ja järjepidevust |
| Paratsentees | Õõnepunktsioon vedeliku eemaldamiseks |
| Patsiendipoolne toidust ja vedelikest loobumine (ingl voluntary stopping of eating and drinking, VSED) | Patsiendi teadlik otsus loobuda toidust ja/või vedelikest |
| Pleuraefusioon |
Pleuravedeliku patoloogiline kogunemine hulkades, mis on kindlaks tehtav kliiniliste ja/või radioloogiliste uurimismeetoditega ja/või mis võib põhjustada patsiendile vaevusi |
| Pleurodees |
Pleuralestmete keemiline või mehaaniline ärritamine eesmärgiga tekitada aseptiline põletik, mille tulemusena pleuralestmed omavahel liituvad ja pleuraõõs kaob |
| Psühhosotsiaalne nõustamine/abi |
Terviklik patsiendi ja lähedaste emotsionaalsete, vaimsete, hingeliste, sotsiaalsete ja praktiliste vajaduste käsitlemine. Psühhosotsiaalse nõustamise/ abi eesmärk on toetada patsiendi ja lähedaste toimetulekut, kohanemist, taastumist ja vaimset tervist ning tagada parim võimalik elukvaliteet ja heaolu. Psühhosotsiaalse toetamise alus on patsiendi ja lähedaste vajaduste mitmekülgne ja kompleksne hindamine. |
| Spetsialiseeritud palliatiivne ravi (ingl specialist palliative care) | Palliatiivse ravi teenuseid osutavad spetsiaalse palliatiivse ravi väljaõppega meeskonna liikmed. Spetsialiseeritud palliatiivset ravi osutatakse maakondlikul ja regionaalsel tasandil. |
| Sümptomaatiline ravi | Haigusest või ravist tingitud vaevuste ennetamine ja leevendamine |
| Terminaalne seisund |
Patsiendi seisundi halvenemine, mis eelneb patsiendi surmale, limiteeritud tundide kuni kolme nädalaga. Terminaalses seisundis patsient on surija. |
| Toitmisravi (ingl artificial nutrition, therapeutic nutrition) |
Ravi, mille eesmärk on tagada vanusele, kehakaalule, haigustele, seisundile ja muudele teguritele vastav vajalik ravitoidu ja vedeliku kogus. Toit võib olla naturaalne või kunstlik ja seda manustatakse suu kaudu, enteraalselt (sondid ja stoomid) või parenteraalselt (veenisiseselt). |
| Tunnelleeritud püsidreen | Pleuradreen, mille väljumisava on infektsiooniohu vähendamiseks toodud nahaalusi punktsioonikohast eemale |
| Tulevikujuhised (ingl living will, advance directives) |
Patsiendi avaldus (raviplaani osa, tavaliselt kirjalik) selle kohta, millist ravi ta soovib või ei soovi olukorras, kus ta pole enam võimeline ise otsuseid langetama (ka elutestament, patsienditestament, patsiendi elulõpu tahteavaldus) |
| Vedelikravi (ingl artificial hydration) | Vee või elektrolüütide lahuse manustamine muul viisil kui suu kaudu, tehakse ka intravenoosselt, nahaalusi või rektaalselt |
Sissejuhatus
Ravijuhendi koostmise vajadus
Palliatiivne ravi on interdistsiplinaarne terviklik aktiivne ravi, mis on suunatud elu ohustava ja elukvaliteeti halvendava tervisliku seisundiga patsientide ning nende lähedaste elukvaliteedi parandamisele diagnoosi saamisest elu lõpuni kogu haiguse vältel, vajaduse korral ka haigusest tervistumisel. Palliatiivne ravi toimub haigusspetsiifilise raviga samal ajal ja jätkub haigusspetsiifilise ravi lõpetamisel. Kõik patsiendid ei pruugi vajada palliatiivset ravi igas ravietapis samas mahus, kuid kaugele arenenud haiguse korral suureneb palliatiivse ravi tähtsus, olulisemaks muutub vaid elukvaliteedi säilitamine ja parandamine (1). Patsiendiga tegeleb interdistsiplinaarne meeskond, mille liikmete arv ja spetsialiseerumine sõltub patsiendi ja tema lähedaste vajadustest. Palliatiivne ravi peab olema kättesaadav tervishoiusüsteemi eri tasanditel.
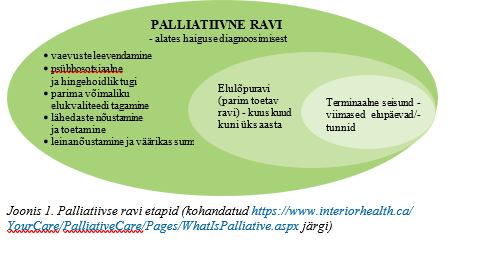
Palliatiivne ravi pakub meditsiinilist, psühholoogilist, sotsiaalset ja vaimset (spirituaalset) tuge kogu raviteekonna jooksul, hõlmates elulõpuravi ehk parimat toetavat ravi, terminaalses seisundis patsiendi vaevuste leevendamist ja leinanõustamist (vt joonis 1). Palliatiivse ravi kestus võib ulatuda päevadest aastateni. Uuringud näitavad, et palliatiivse ravi vajadus on kõige suurem kuus kuud enne patsiendi surma (2). Diagnoosimisest alates toimub vajaduse korral palliatiivne ravi koos haigusspetsiifilise raviga. Kui haigusspetsiifiline ravi on ammendunud, siis jätkub ainult palliatiivne ravi. Elulõpuravi peamine eesmärk on vaevuste leevendamine, inimväärikust austav põetamine ja parima võimaliku elukvaliteedi tagamine patsiendi surmani, rahulik ja väärikas surm ning perede toetamine ja leinatöö surma saabudes ning selle järel.
Palliatiivne ravi pakub meditsiinilist, psühholoogilist, sotsiaalset ja vaimset (spirituaalset) tuge kogu raviteekonna jooksul, hõlmates elulõpuravi ehk parimat toetavat ravi, terminaalses seisundis patsiendi vaevuste leevendamist ja leinanõustamist (vt joonis 1). Palliatiivse ravi kestus võib ulatuda päevadest aastateni. Uuringud näitavad, et palliatiivse ravi vajadus on kõige suurem kuus kuud enne patsiendi surma (2). Diagnoosimisest alates toimub vajaduse korral palliatiivne ravi koos haigusspetsiifilise raviga. Kui haigusspetsiifiline ravi on ammendunud, siis jätkub ainult palliatiivne ravi. Elulõpuravi peamine eesmärk on vaevuste leevendamine, inimväärikust austav põetamine ja parima võimaliku elukvaliteedi tagamine patsiendi surmani, rahulik ja väärikas surm ning perede toetamine ja leinatöö surma saabudes ning selle järel.
Palliatiivse ravi vajadus kasvab, sest nii pahaloomuliste kasvajate kui ka krooniliste mitteonkoloogiliste haigustega patsientide arv suureneb. Euroopa Palliatiivse Ravi Assotsiatsiooni dokumendi „EAPC Atlas of Palliative Care in Europe 2019“ andmetel suri Euroopas 2014. aastal üle 4,4 miljoni inimese, kes kogesid haigusega seotud kannatusi ja vajanuks palliatiivset ravi (3). 12 riigi andmete analüüsi põhjal on leitud, et 64% surnud patsientidest oleksid oma haiguse tõttu vajanud palliatiivset ravi (4). Väga täpselt ei ole tegelik palliatiivset ravi vajavate patsientide arv maailmas ega ka Eestis teada (5).
Enamikus Euroopa riikides (76%) on palliatiivne ravi sätestatud tervishoiu valdkonna seadusandluses eraldi teenuse või patsiendi õigusena. Palliatiivne ravi on kantud perearstiabi teenuste loetellu 36 (71%) Euroopa riigis. (3) „Global Atlas of Palliative Care“ andmetel kuulub Eesti nende riikide hulka, kus palliatiivse ravi arendamine on ebaühtlane: seda ei toetata piisavalt, ravi osutamine sõltub suures osas rahastajatest ja palliatiivse ravi teenuste hulk on populatsiooni arvestades piiratud. Dokumendis nenditakse, et palliatiivse ravi osutamine ilma toetava riikliku poliitikata on keeruline. Vajalikud on seadused, millega tunnustatakse ja määratletakse palliatiivne ravi tervishoiusüsteemi osana, riiklikud palliatiivse ravi programmid ja strateegiad selle juurutamiseks, ravijuhendid, palliatiivse ravi eriala/alameriala loomine, palliatiivse ravi teenuse osutajatele tegevusloa andmise reguleerimine. (5) Praegu on koostamisel Eesti vähitõrje tegevuskava 2021–2030, kus käsitletakse ka palliatiivset ravi, selle arendamist ja eesmärke. Samuti on alates 2020.aasta algusest rahastatud statsionaarse hospiitsravi teenus. Eestis on väga vähe palliatiivse ravi ettevalmistusega tervishoiutöötajaid. Süsteemne ravikorraldus vajab arendamist ja rahastamist, sealhulgas koolitusi palliatiivse ravi osutajatele.
Enamikus Euroopa riikides (76%) on palliatiivne ravi sätestatud tervishoiu valdkonna seadusandluses eraldi teenuse või patsiendi õigusena. Palliatiivne ravi on kantud perearstiabi teenuste loetellu 36 (71%) Euroopa riigis. (3) „Global Atlas of Palliative Care“ andmetel kuulub Eesti nende riikide hulka, kus palliatiivse ravi arendamine on ebaühtlane: seda ei toetata piisavalt, ravi osutamine sõltub suures osas rahastajatest ja palliatiivse ravi teenuste hulk on populatsiooni arvestades piiratud. Dokumendis nenditakse, et palliatiivse ravi osutamine ilma toetava riikliku poliitikata on keeruline. Vajalikud on seadused, millega tunnustatakse ja määratletakse palliatiivne ravi tervishoiusüsteemi osana, riiklikud palliatiivse ravi programmid ja strateegiad selle juurutamiseks, ravijuhendid, palliatiivse ravi eriala/alameriala loomine, palliatiivse ravi teenuse osutajatele tegevusloa andmise reguleerimine. (5) Praegu on koostamisel Eesti vähitõrje tegevuskava 2021–2030, kus käsitletakse ka palliatiivset ravi, selle arendamist ja eesmärke. Samuti on alates 2020.aasta algusest rahastatud statsionaarse hospiitsravi teenus. Eestis on väga vähe palliatiivse ravi ettevalmistusega tervishoiutöötajaid. Süsteemne ravikorraldus vajab arendamist ja rahastamist, sealhulgas koolitusi palliatiivse ravi osutajatele.
Eetilised küsimused palliatiivses ravis
Palliatiivne ravi on valdkond, millega kaasneb palju raskeid valikuid. Otsuseid on keeruline teha muuhulgas ka sellepärast, et palliatiivset ravi vajavad patsiendid on haprad ja haavatavad ning tihtipeale peab valima halva ja veel halvema vahel. Seetõttu on tähtis, et palliatiivses ravis töötavad spetsialistid orienteeruksid hästi meditsiinieetikas ja valdaksid keerulistes olukordades suhtlemise kunsti.
Palliatiivses ravis, nagu ka meditsiinis üldiselt, on otsuste ja tegutsemise juhisteks meditsiinieetika nurgakivid – heategemine, mittekahjustamine, õiglus ja autonoomia (6). Tähtsad põhimõtted on ka inimese väärikuse austamine ja tõerääkimine, milleta on enamasti keeruline teha head ja mitte kahjustada.
Palliatiivses ravis, nagu ka meditsiinis üldiselt, on otsuste ja tegutsemise juhisteks meditsiinieetika nurgakivid – heategemine, mittekahjustamine, õiglus ja autonoomia (6). Tähtsad põhimõtted on ka inimese väärikuse austamine ja tõerääkimine, milleta on enamasti keeruline teha head ja mitte kahjustada.
- Heategemine tähendab seda, et kõik otsused ja tegevused peavad olema kooskõlas patsiendi parimate huvidega.
- Alati peab püüdlema selle poole, et kasu kaaluks riski üles. Kui head pole võimalik olulisel määral teha, siis peab vähemalt kahjustamist vältima.
- Õiglus tähendab laiemas mõttes kõigile võrdsete võimaluste tagamist. Üksikisiku suhtes tehtud otsused ei tohiks ebaproportsionaalselt vähendada teiste väljavaateid saada vajalikku arstiabi.
- Autonoomia ehk enesemääramisõigus on inimese õigus otsustada, missugust meditsiiniabi ta endale osutada lubab, samas ei ole patsiendil õigust nõuda ravi, mis ei ole talle üldse näidustatud. Autonoomia ei pruugi teenida patsiendi parimaid huvisid, kui patsient ei ole otsuse tegemiseks piisavalt ja tõemeelselt informeeritud.
- Elu säilitamise kohustus on tekitanud ja ilmselt tekitab ka tulevikus pingeid ja erimeelsusi. 1948. aasta Genfi deklaratsioonis on kirjas, et iga arst peab alati meeles pidama kohustust säilitada inimelu, kuid uuendatud versioonides alates 2005. aastast on arsti kohustus austada inimelu (7). Meditsiinitehnoloogia arengu tingimustes on selline muutus möödapääsmatu. Meditsiini võimekus inimest elus hoida on nüüdisajal suur, kuid paljud haigused on jäänud endiselt ravimatuks ja inimesed surelikuks. Austus inimelu vastu ei pruugi tähendada elu säilitamist kõigi meditsiiniliste vahenditega, pikendades inimese kannatusi haiguse halva prognoosi korral. Rõhuasetus peab olema pigem patsiendi terviklikul käsitlusel, mis toetub nüüdisaegsele palliatiivse ravi filosoofiale: tuleb tagada parim võimalik elukvaliteet surma saabumist kiirendamata ja edasi lükkamata.
Palliatiivse raviga on seotud palju tundlikke teemasid ja küsimusi.
- Otsuste langetamine. Ideaalis langetavad arst ja patsient otsuseid üheskoos (ingl shared decision-making). Arst teeb meditsiinilist situatsiooni silmas pidades ettepanekud ja patsient reageerib neile sõltuvalt oma väärtustest, eelistustest, kogemustest ja sotsiaalsest olukorrast. Raviplaani tegemisele peavad eelnema põhjalikud vestlused ravimeeskonna, patsiendi ja tema lähedaste vahel ning patsiendi eelistusi peab austama.
- Patsiendi parimad huvid. Otsustusvõimeline patsient annab informeeritud nõusoleku. Eeldusel, et arst pakub parimat ravi, patsient saab endaga toimuvast aru ja pakutu ei lähe vastuollu patsiendi väärtuste ja ootustega, ongi patsiendi
parimad huvid kaitstud. Keerulisem on olukord, kus patsient on otsustusvõimetu. Sellises olukorras on hea, kui patsient on varem koostanud tulevikujuhised. Kui mitte, siis peab patsiendi eeldatava tahte püüdma ära arvata koostöös patsiendi lähedastega.
- Lähedaste roll otsuste tegemisel. Patsiendi lähedaste, seaduslike esindajate või patsiendi poolt tulevikujuhistega määratud asendusotsustaja roll on suur, kui patsient ei ole otsustusvõimeline. Lähedastega koos patsiendi jaoks parimate otsuste tegemine on pahatihti keeruline. Sellel on palju põhjuseid: lähedased ei ole võimelised otsustades keskenduma patsiendi huvidele vaid on kantud eelkõige enda tunnetest nagu kaotusvalu, lein, süütunne jne; nad ei pruugi olla võimelised olukorrast aru saama; neil võivad olla põhjendamatud paranemislootused; otsustamine võib olla emotsionaalselt liiga koormav ja vastutusrikas jne. Samuti võivad lähedased soovida vaidlustada patsiendi varem avaldatud juhised.
- Ravipiirangud. Elu pikendava ja paranemisele suunatud ravi (aktiivravi) lõpetamine või mittealustamine võivad realiseeruda kahel juhul: 1) on meditsiiniliselt põhjendatud otsus, et aktiivravi on patsiendi jaoks kasutu (ingl futile therapy, medical futility) ja võib teda isegi kahjustada; 2) ravipiiranguid tehakse otsustusvõimelise patsiendi soovil. Soovi saab patsient avaldada vahetult või vahetult enne ravi või varem elulõpu tahteavalduse (patsienditestamendi) vormis.
- Patsiendi elulõpu tahteavaldus (patsienditestament) on otsustusvõimelise isiku meditsiiniline juhis olukorraks, kus ta ei ole enam ise otsustusvõimeline
(8). Tavaliselt märgivad patsiendid ära, mida nad ei soovi, et nende elu pikendamiseks rakendataks, näiteks elustamine kliinilisest surmast, hingamine aparaadiga, kunstlik toitmine. Eetilisi dilemmasid reeglina ei teki, kui patsienditestament on õigel ajal kättesaadav, üheselt mõistetav ja patsiendi soovid ühtivad ka arstiteaduse üldiste eesmärkidega (patsient ei keela ravi, mis annaks häid tulemusi).
- Valuravi ja sedatsioon elu lõpus (9). Terminaalne sedatsioon on Eestis hetkel seaduslikult reguleerimata.
Ravijuhendi käsitlusala ja sihtrühm
Ravijuhendi eesmärk on ühtlustada tervishoiutöötajate teadmisi palliatiivse ravi patsientidel sagedamini esinevate erakorraliste seisundite käsitlemisest ja elulõpuravis kasutatavatest sekkumistest, et parandada seeläbi patsientide ja
lähedaste elukvaliteeti ning heaolu. Samuti antakse soovitused palliatiivse ravi korraldamiseks Eestis.
Ravijuhend keskendub palliatiivsele ravile täiskasvanud patsientidel (alates 18. eluaastast), kellel on diagnoositud progresseeruv, elu ohustav ja elukvaliteeti halvendav haigus. Ravijuhend on kasutamiseks arstidele, õdedele, teistele spetsialistidele (psühholoogid, hingehoidjad/kaplanid, sotsiaaltöötajad, hooldustöötajad, logopeedid, füsioterapeudid, tegevusterapeudid, toitumisnõustajad, kogemusnõustajad), sotsiaalteenuste osutajatele, patsientidele ja patsientide esindusorganisatsioonidele ning omastehooldajatele, kes puutuvad kokku palliatiivset ravi vajava patsiendi ja tema lähedastega.
Ravijuhendis ei käsitleta järgmiseid teemasid:
- palliatiivset ravi lastel;
- detailselt vähispetsiifilist palliatiivset ravi ja sellest tingitud kõrvaltoimeid;
- haigusspetsiifilist ravi;
- valuravi.
Valuravi käsitlemine on ravijuhendist välja jäetud teema mahukuse tõttu. Valuravi juhendi koostamisega plaanitakse alustada esimesel võimalusel pärast palliatiivse ravi juhendi valmimist.
Ravijuhendi soovitused lähtuvad tõenduspõhiste uuringute tulemustest ja kliinilisest praktikast. Palliatiivses ravis ja eriti elulõpuravis on uuringute tegemine eetilistel põhjustel keeruline ning leidub vähe hea kvaliteediga tõendusmaterjali. Seetõttu on ravijuhendi töörühm sõnastanud mitu praktilist soovitust, mis aitavad tervishoiutöötajatel palliatiivse ravi osutamisel eri olukordades toime tulla ja otsuseid langetada.
Mõnes ravijuhendi soovituses on patsiendi üldseisundi hindamise aluseks ECOG sooritusvõime staatuse skaala. Skaala on välja töötatud ja kasutusel kasvajaga patsientide funktsionaalse seisundi hindamiseks, kuid sobib tänu universaalsusele ka teiste haigustega patsientide üldseisundi hindamiseks. Ravijuhend ei asenda tervishoiutöötaja individuaalset vastutust teha õigeid raviotsuseid konkreetse patsiendi seisundist ja eelistustest lähtudes. Kõik soovitused ei pruugi kõikide patsientide puhul sobida.
Ravijuhend on alus edasiste tegevuste kavandamisel ja rakendamisel ning uute teenuste loomisel. Tegevused on toodud ravijuhendi rakenduskavas. Palliatiivse ravi korraldust käsitlevad soovitused on rakendatavad eeldusel, et rakenduskavas toodud tegevused on ellu viidud (palliatiivse ravi teenused, koolitused, rahastus).
Ravijuhendi soovitused lähtuvad tõenduspõhiste uuringute tulemustest ja kliinilisest praktikast. Palliatiivses ravis ja eriti elulõpuravis on uuringute tegemine eetilistel põhjustel keeruline ning leidub vähe hea kvaliteediga tõendusmaterjali. Seetõttu on ravijuhendi töörühm sõnastanud mitu praktilist soovitust, mis aitavad tervishoiutöötajatel palliatiivse ravi osutamisel eri olukordades toime tulla ja otsuseid langetada.
Mõnes ravijuhendi soovituses on patsiendi üldseisundi hindamise aluseks ECOG sooritusvõime staatuse skaala. Skaala on välja töötatud ja kasutusel kasvajaga patsientide funktsionaalse seisundi hindamiseks, kuid sobib tänu universaalsusele ka teiste haigustega patsientide üldseisundi hindamiseks. Ravijuhend ei asenda tervishoiutöötaja individuaalset vastutust teha õigeid raviotsuseid konkreetse patsiendi seisundist ja eelistustest lähtudes. Kõik soovitused ei pruugi kõikide patsientide puhul sobida.
Ravijuhend on alus edasiste tegevuste kavandamisel ja rakendamisel ning uute teenuste loomisel. Tegevused on toodud ravijuhendi rakenduskavas. Palliatiivse ravi korraldust käsitlevad soovitused on rakendatavad eeldusel, et rakenduskavas toodud tegevused on ellu viidud (palliatiivse ravi teenused, koolitused, rahastus).
Ravijuhendi koostamine
Ravijuhendi teemaalgatuse esitas MTÜ Pallium. Ravijuhendit hakati koostama 2019. aastal. Moodustati ravijuhendi töörühm ja sekretariaat, ravijuhendi koostamisse kaasati eri kutsealade esindajad ja Eesti Haigekassa esindaja.
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2017) põhimõtetest (10). Ravijuhendi esialgne käsitlusala kinnitati ravijuhendite nõukojas 2019. aasta aprillis. Ravijuhendi koostamise käigus selgus, et teema on mahukas, mistõttu otsustas töörühm koostada ravijuhendi mitmeosalisena. Ravijuhendi esimene osa, mis käsitles palliatiivse ravi patsientidel sagedamate haigusseisundite korral esinevate sümptomite leevendamise võimalusi (nii mittefarmakoloogilisi kui farmakoloogilisi meetodeid) kinnitati ravijuhendite nõukojas 3. märtsil 2020. Siinne ravijuhend on teine osa, mis hõlmab palliatiivse ravi vajaduste hindamist, palliatiivse ravi patsientidel sagedamini esinevate erakorraliste seisundite käsitlemist ja elulõpuravis kasutatavaid sekkumisi. Samuti annab ravijuhend soovitusi palliatiivse ravi korraldamiseks Eestis. Ravijuhendi käsitlusala muudatus kinnitati ravijuhendite nõukojas 13. mail 2020. Ravijuhendi käsitlusalas on kokku kuus PICO-formaadis vormistatud kliinilist küsimust ja üks tervishoiukorralduslik küsimus.
Soovituste koostamisel arvestati peale teadusliku tõendusmaterjali tugevuse ka sekkumise kasu tervisele (sh potentsiaalse kasu ja kahju vahekorda), inimeste eelistusi ja väärtushinnanguid. Samuti võeti arvesse soovitusega kaasneda võivat inimeste ebavõrdsesse olukorda jätmist ja võimaluse korral soovituste rakendamisvõimalusi.
11. jaanuaril 2021 saadeti ravijuhend kommenteerimiseks erialaseltsidele ja Eesti Haigekassa lepingupartneritele, avaldati veebilehel www.ravijuhend.ee ning esitati hindamiseks ravijuhendite nõukojale. Ravijuhendite nõukojast oli ravijuhendi retsensendiks Maivi Parv, väliste ekspertidena Katrin Siirak ja Merike Toomik. Peale retsensentide tagasiside saabus veel 18 erialaseltsi, organisatsiooni või üksikisiku tagasiside. Laekunud kommentaarid arutati töörühma koosolekul läbi ja ravijuhendis tehti vajalikud täiendused. Töörühm kinnitas ravijuhendi koos rakenduskavaga 1. veebruaril 2021 toimunud koosolekul, misjärel esitati kõik asjakohased dokumendid ravijuhendite nõukojale. Ravijuhendit uuendatakse viis aastat pärast selle heakskiitmist või uue asjakohase tõendusmaterjali avaldamisel. Ravijuhendi koostajad tänavad kõiki, kes panustasid ravijuhendi valmimisse.
Ravijuhendi käsitlusala, täisversioon, rakenduskava, koostajate huvide deklaratsioonide kokkuvõte, tõendusmaterjali ja soovituste kokkuvõtte tabelid ning koosolekute protokollid on kättesaadavad veebilehel www.ravijuhend.ee.
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2017) põhimõtetest (10). Ravijuhendi esialgne käsitlusala kinnitati ravijuhendite nõukojas 2019. aasta aprillis. Ravijuhendi koostamise käigus selgus, et teema on mahukas, mistõttu otsustas töörühm koostada ravijuhendi mitmeosalisena. Ravijuhendi esimene osa, mis käsitles palliatiivse ravi patsientidel sagedamate haigusseisundite korral esinevate sümptomite leevendamise võimalusi (nii mittefarmakoloogilisi kui farmakoloogilisi meetodeid) kinnitati ravijuhendite nõukojas 3. märtsil 2020. Siinne ravijuhend on teine osa, mis hõlmab palliatiivse ravi vajaduste hindamist, palliatiivse ravi patsientidel sagedamini esinevate erakorraliste seisundite käsitlemist ja elulõpuravis kasutatavaid sekkumisi. Samuti annab ravijuhend soovitusi palliatiivse ravi korraldamiseks Eestis. Ravijuhendi käsitlusala muudatus kinnitati ravijuhendite nõukojas 13. mail 2020. Ravijuhendi käsitlusalas on kokku kuus PICO-formaadis vormistatud kliinilist küsimust ja üks tervishoiukorralduslik küsimus.
Soovituste koostamisel arvestati peale teadusliku tõendusmaterjali tugevuse ka sekkumise kasu tervisele (sh potentsiaalse kasu ja kahju vahekorda), inimeste eelistusi ja väärtushinnanguid. Samuti võeti arvesse soovitusega kaasneda võivat inimeste ebavõrdsesse olukorda jätmist ja võimaluse korral soovituste rakendamisvõimalusi.
11. jaanuaril 2021 saadeti ravijuhend kommenteerimiseks erialaseltsidele ja Eesti Haigekassa lepingupartneritele, avaldati veebilehel www.ravijuhend.ee ning esitati hindamiseks ravijuhendite nõukojale. Ravijuhendite nõukojast oli ravijuhendi retsensendiks Maivi Parv, väliste ekspertidena Katrin Siirak ja Merike Toomik. Peale retsensentide tagasiside saabus veel 18 erialaseltsi, organisatsiooni või üksikisiku tagasiside. Laekunud kommentaarid arutati töörühma koosolekul läbi ja ravijuhendis tehti vajalikud täiendused. Töörühm kinnitas ravijuhendi koos rakenduskavaga 1. veebruaril 2021 toimunud koosolekul, misjärel esitati kõik asjakohased dokumendid ravijuhendite nõukojale. Ravijuhendit uuendatakse viis aastat pärast selle heakskiitmist või uue asjakohase tõendusmaterjali avaldamisel. Ravijuhendi koostajad tänavad kõiki, kes panustasid ravijuhendi valmimisse.
Ravijuhendi käsitlusala, täisversioon, rakenduskava, koostajate huvide deklaratsioonide kokkuvõte, tõendusmaterjali ja soovituste kokkuvõtte tabelid ning koosolekute protokollid on kättesaadavad veebilehel www.ravijuhend.ee.
Tõendusmaterjali otsimine ja hindamine
Tõendusmaterjali otsimist alustati olemasolevatest ravijuhenditest, mille on koostanud sõltumatud avaliku sektori asutused. Andmebaasist PubMed (www. ncbi.nlm.nih.gov/pubmed/) otsiti inglis-, soome- ja eestikeelseid ravijuhendeid, mis on valminud 2010. aastal või hiljem.
Veel vaadati läbi järgmised ravijuhendite andmebaasid/veebilehed: Guideline Central (https://www.guidelinecentral.com/); Ühendkuningriigi riiklik tervishoiu ja kliinilise kvaliteedi instituut (NICE) (www.nice.org.uk); GIN (https:// www.g-i-n.net/); Kanada kliiniliste ravijuhendite andmebaas (CPG infobase: clinical practice guidelines; https://joulecma.ca/cpg/homepage); WHO ravijuhendid (https://www.who.int/publications/guidelines/en/); Kanada ravimi- ja tervishoiutehnoloogia amet (CADTH) (www.cadth.ca); Šoti palliatiivse ravi juhendid (https://www.palliativecareguidelines.scot.nhs.uk/); NCCN (https:// www.nccn.org/); ESMO (https://www.esmo.org/guidelines); ASCO (https:// www.asco.org/research-guidelines/quality-guidelines/guidelines).
Kõiki leitud (ravi)juhendeid (kokku 56) hinnati esmalt sisukokkuvõtete alusel ja jäeti välja need, mis ei vastanud käsitlusalale või kordusid. Valiti ravijuhendid, mis käsitlesid mitte ainult ühe sümptomi ravi, vaid palliatiivset ravi laiemalt. Edasiseks hindamiseks sobis 14 ravijuhendit. Hindamiseks kasutati ravijuhendite hindamise töövahendit AGREE. Kasutamiseks sobivaks loeti need ravijuhendid, mille hindamistulemus oli üle 80% ja mida soovitasid kasutada kõik ravijuhendit hinnanud sekretariaadi liikmed. Ravijuhendi koostamisse kaasati hindamiste alusel kaheksa ravijuhendit (vt järgnev loetelu). Konkreetse sümptomi ravi käsitlevaid ravijuhendeid kaasati vajaduse korral tõendusmaterjali otsimisel ja analüüsimisel eraldi.
Ravijuhendi koostamisse kaasatud ravijuhendid:
Veel vaadati läbi järgmised ravijuhendite andmebaasid/veebilehed: Guideline Central (https://www.guidelinecentral.com/); Ühendkuningriigi riiklik tervishoiu ja kliinilise kvaliteedi instituut (NICE) (www.nice.org.uk); GIN (https:// www.g-i-n.net/); Kanada kliiniliste ravijuhendite andmebaas (CPG infobase: clinical practice guidelines; https://joulecma.ca/cpg/homepage); WHO ravijuhendid (https://www.who.int/publications/guidelines/en/); Kanada ravimi- ja tervishoiutehnoloogia amet (CADTH) (www.cadth.ca); Šoti palliatiivse ravi juhendid (https://www.palliativecareguidelines.scot.nhs.uk/); NCCN (https:// www.nccn.org/); ESMO (https://www.esmo.org/guidelines); ASCO (https:// www.asco.org/research-guidelines/quality-guidelines/guidelines).
Kõiki leitud (ravi)juhendeid (kokku 56) hinnati esmalt sisukokkuvõtete alusel ja jäeti välja need, mis ei vastanud käsitlusalale või kordusid. Valiti ravijuhendid, mis käsitlesid mitte ainult ühe sümptomi ravi, vaid palliatiivset ravi laiemalt. Edasiseks hindamiseks sobis 14 ravijuhendit. Hindamiseks kasutati ravijuhendite hindamise töövahendit AGREE. Kasutamiseks sobivaks loeti need ravijuhendid, mille hindamistulemus oli üle 80% ja mida soovitasid kasutada kõik ravijuhendit hinnanud sekretariaadi liikmed. Ravijuhendi koostamisse kaasati hindamiste alusel kaheksa ravijuhendit (vt järgnev loetelu). Konkreetse sümptomi ravi käsitlevaid ravijuhendeid kaasati vajaduse korral tõendusmaterjali otsimisel ja analüüsimisel eraldi.
Ravijuhendi koostamisse kaasatud ravijuhendid:
- „Integration of palliative care into standard oncology care: American Society of Clinical Oncology clinical practice guideline update“, American Society of Clinical Oncology, 2016.
- „Palliative care in the global setting: ASCO resource-stratified practice guideline“, American Society of Clinical Oncology, 2018.
3 „Evidenced-based guideline: palliative care for patients with incurable cancer“, German Association for Palliative Medicine, 2015.
4. „Palliative care“, version 1.2019, National Comprehensive Cancer Network, 2018.
4. „Palliative care“, version 1.2019, National Comprehensive Cancer Network, 2018.
5 „Palliatiivinen hoito ja saattohoito“, Duodecim, 2018.
- „Care of dying adults in the last days of life“, NICE, 2015.
- „Palliative care for adults“, Institute for Clinical Systems Improvement (ISCI), 2013.
- „Clinical practice guidelines for quality palliative care, 4th edition“, National Coalition for Hospice and Palliative Care, 2018.
Kliiniliste küsimuste tõendusmaterjali kokkuvõtete koostamiseks otsis sekretariaat lisaks ravijuhendites kasutatud allikatele metaanalüüse ja süstemaatilisi ülevaateid, vajaduse korral RCT-sid ning madalama tõenduspõhisusega uuringuid. Kasutati Cochrane’i koostöövõrgustiku süstemaatiliste ülevaadete andmebaasi ja elektroonilist andmebaasi PubMed, mõnel juhul otsiti ka käsitsi. Võimalusel piirati otsinguid viimasel viiel aastal (alates 2014) publitseeritud uuringutega, kuid kasutati ka vanemaid allikaid. Vajaduse korral kaasati kitsama teema kohta koostatud ravijuhendeid.
Ravijuhendi iga kliinilise küsimuse ja alaküsimuse kohta koostas sekretariaat kliinilise küsimuse tõendusmaterjali kokkuvõtte, kasutades veebipõhist tööriista GRADEpro. Töörühm koostas ja kinnitas ravijuhendi soovitused koos suuna ja tugevusega. Ravijuhendite soovituste aluseks olevad tõendusmaterjali ja soovituste kokkuvõtte tabelid on kättesaadavad veebilehel www.ravijuhend.ee.
Ravijuhendi iga kliinilise küsimuse ja alaküsimuse kohta koostas sekretariaat kliinilise küsimuse tõendusmaterjali kokkuvõtte, kasutades veebipõhist tööriista GRADEpro. Töörühm koostas ja kinnitas ravijuhendi soovitused koos suuna ja tugevusega. Ravijuhendite soovituste aluseks olevad tõendusmaterjali ja soovituste kokkuvõtte tabelid on kättesaadavad veebilehel www.ravijuhend.ee.
Ravijuhendi soovitused
Erakorraliste seisundite käsitlus palliatiivses ravis |
||
| Verejooksu käsitlus | ||
| 1 |
|
Patsiendil, kelle haigusspetsiifiline ravi on lõpetatud ja üldseisund ECOG skaala järgi 1–2 (vt lisa 1), on verejooksu käsitlus juhupõhine. Praktiline soovitus |
| 2 |
|
Kui patsiendil, kelle haigusspetsiifiline ravi on lõpetatud ja üldseisund ECOG skaala järgi 3–4, tekib põhihaigusega seotud verejooks, ei ole verekomponentide ülekanne ega invasiivsete ravisekkumiste rakendamine näidustatud (vt lisa 2). Praktiline soovitus |
| Intrakraniaalse rõhu tõusu ja epileptilise hoo käsitlus | ||
| 3 |
|
Ajumetastaaside või primaarse ajukasvajaga palliatiivse ravi patsiendile on näidustatud deksametasooni kasutamine:
|
| 4 |
|
Palliatiivse ravi patsiendil kasutage epileptilise hoo kupeerimiseks bensodiasepiine. Veenitee puudumisel eelistage ravimi manustamist suu limaskestale, intranasaalselt (ninaaplikaatoriga) või rektaalselt (vt lisa 3). Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 5 |
|
Palliatiivse ravi patsiendile epilepsiavastaste ravimite määramisel alustage väikeste annustega ja suurendage annust aeglaselt olenevalt ravitoimest ja jälgides ravimite kõrvaltoimete mõju elukvaliteedile. Praktiline soovitus |
| 6 |
|
Kui palliatiivse ravi patsiendile on näidustatud keemiaravi ja ta vajab samal ajal antikonvulsanti, kaaluge CYP-ensüüme mitteindutseerivate epilepsiavastaste ravimite kasutamist (vt lisa 3). Praktiline soovitus |
| 7 |
|
Kui terminaalses seisundis patsiendil tekib epileptiline hoog, ei ole epilepsiavastase ravi alustamine näidustatud. Praktiline soovitus |
| Ülemise õõnesveeni maliigse kompressiooni käsitlus | ||
| 8 |
|
Palliatiivse ravi patsiendil, kellel on tekkinud ülemise õõnesveeni maliigse kompressiooni kliiniline pilt, kaaluge deksametasooni ja madalmolekulaarse hepariini kasutamist ning konsulteerige onkoloogiga võimalike täiendavate ravisekkumiste selgitamiseks (vt lisa 4). Praktiline soovitus |
| Seljaaju maliigse kompressiooni käsitlus | ||
| 9 |
|
Kõikidele palliatiivse ravi patsientidele, kellel on tekkinud seljaaju maliigse kompressiooni kliiniline pilt, on näidustatud deksametasooni kasutamine (vt lisa 5). Tugev positiivne soovitus, madal tõendatuse aste |
| 10 |
|
Kui palliatiivse ravi patsiendil, kelle üldseisund on enne olnud ECOG skaala järgi 1–2, on tekkinud seljaaju maliigse kompressiooni kliiniline pilt, tuleb püsiva neuroloogilise kahjustuse vältimiseks teha kiiritusravi või kirurgiline dekompressioon 48 tunni jooksul sümptomite tekkest (vt lisa 5). Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 11 |
|
Kui palliatiivse ravi patsiendil, kelle üldseisund on enne olnud ECOG skaala järgi 3–4, on tekkinud seljaaju maliigse kompressiooni kliiniline pilt, alustage esimesel võimalusel deksametasooni ja valuraviga (vt lisa 5). Praktiline soovitus |
| 12 |
|
Palliatiivse ravi patsiendile seljaaju maliigse kompressiooni käsitluse raviplaani tegemiseks on vajalik valveonkoloogi konsultatsioon. Praktiline soovitus |
| Maliigse ja mittemaliigse pleuraefusiooni käsitlus | ||
| 13 |
|
Palliatiivse ravi patsiendil esinev asümptomaatiline pleuraefusioon ei vaja sekkumist. Praktiline soovitus |
| 14 |
|
Palliatiivse ravi patsiendile on sümptomaatilise maliigse pleuraefusiooni (suure valgusisaldusega) korral näidustatud pleurapunktsioon (vt lisa 6). Praktiline soovitus |
| 15 |
|
Kui palliatiivse ravi patsiendil pleurapunktsiooni järel maliigse pleuraefusiooni sümptomid leevenevad, sõltub patsiendi edasine käsitlus pleuravedeliku taastekke kiirusest, üldseisundist ja vaevuste raskusest (vt lisa 6). Praktiline soovitus |
| 16 |
|
Kui palliatiivse ravi patsiendil taastekib maliigse pleuraefusiooni korral pleuravedelik aeglaselt (30 ja enam päeva), on näidustatud korduv pleurapunktsioon. Praktiline soovitus |
| 17 |
|
Kui palliatiivse ravi patsiendil taastekib maliigse pleuraefusiooni korral pleuravedelik kiiresti (alla 30 päeva), põhjustades vaevusi, ja patsiendi üldseisund võimaldab (ECOG 1–2), kaaluge erialaspetsialisti konsultatsiooni talkpleurodeesi tegemiseks. Kui patsiendi üldseisund ei võimalda (ECOG 3–4) talkpleurodeesi, on näidustatud püsidrenaaž (võimalusel eelistage tunnelleeritud püsidreeni). Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 18 |
|
Kui pleurapunktsiooni järel maliigse pleuraefusiooni sümptomid ei leevene ja palliatiivse ravi patsiendi üldseisund ECOG skaala järgi on 3–4, jätkake mitteinvasiivse vaevusi leevendava raviga (vt õhupuuduse käsitluse algoritmi palliatiivse ravi juhendi I osa lisas 2). Praktiline soovitus |
| 19 |
|
Palliatiivse ravi patsiendil, kellel on mittemaliigne pleuraefusioon, mis diureetilise ravi maksimaalsete talutavate annuste foonil püsib, kaaluge pleuraõõne püsidrenaaži (võimalusel eelistage tunnelleeritud püsidreeni). Praktiline soovitus |
| Astsiidi käsitlus | ||
| 20 |
|
Kui palliatiivse ravi patsiendil on mittemaliigsest astsiidist tingitud vaevused, mis diureetilise ravi maksimaalsete talutavate annuste foonil püsivad, on näidustatud punktsioon (vt lisa 7). Praktiline soovitus |
| 21 |
|
Kui palliatiivse ravi patsiendil taastekib astsiidi esmase punktsiooni järel astsiit aeglaselt (30 ja enam päeva), on näidustatud korduv punktsioon. Kui esmase punktsiooni järel taastekib astsiit kiiresti (alla 30 päeva), kaaluge püsidrenaaži (vt lisa 7). Praktiline soovitus |
| 22 |
|
Albumiini ja teiste plasmaasendajate kasutamine astsiidi punktsiooni järgse arteriaalse hüpotensiooni korrigeerimiseks ei ole põhjendatud. Nõrk negatiivne soovitus, madal tõendatuse aste |
Elulõpuravi sekkumised palliatiivse ravi patsiendil |
||
| Diagnostilised uuringud | ||
| 23 |
|
Elulõpuravi saavale patsiendile tehke diagnostilisi uuringuid juhul, kui nende tulemused on vajalikud täiendavate sümptomaatilise ravi võimaluste selgitamiseks. Praktiline soovitus |
| 24 | |
Terminaalses seisundis patsiendile on diagnostiliste uuringute tegemine ebaeetiline ega ole näidustatud. Praktiline soovitus |
| Antibakteriaalne ravi | ||
| 25 |
|
Elulõpuravi saavale patsiendile tehke antibakteriaalset ravi infektsiooni korral, kui see leevendab infektsioonist põhjustatud häirivaid sümptomeid ja parandab eeldatavalt patsiendi elukvaliteeti. Praktiline soovitus |
| 26 |
|
Terminaalses seisundis patsiendile ei ole olenemata põletikumarkerite tõusust antibakteriaalse ravi tegemine põhjendatud. Praktiline soovitus |
| Verekomponentide ülekanded | ||
| 27 |
|
Väljendunud aneemia sümptomite puhul võite elulõpuravi saavale patsiendile, kelle üldseisund ECOG skaala järgi on 1–2, teha verekomponentide ülekande, kui see parandab lühiajaliselt tema elukvaliteeti. Kui verekomponentide ülekanne ei vähenda patsiendi vaevusi, ärge korrake seda. Nõrk positiivne soovitus, väga madal tõendatuse aste |
| 28 |
Terminaalses seisundis patsiendile ei ole verekomponentide ülekanne näidustatud, ka mitte vaevuste leevendamiseks. Praktiline soovitus |
|
| Toitmisravi ja vedelikravi | ||
| 29 |
|
Elulõpuravis otsustage toitmisravi ja vedelikravi juhupõhiselt, arvestades patsiendi eeldatavat elupikkust, oodatavat elukvaliteedi paranemist ja tahet. Lõpetage toitmisravi ja vedelikravi, kui sekkumised enam patsiendi enesetunnet ei paranda. Praktiline soovitus |
| 30 |
|
Terminaalses seisundis patsiendile ei ole toitmisravi ega vedelikravi näidustatud, need võivad halvendada tema seisundit. Praktiline soovitus |
| 31 |
|
Terminaalses seisundis patsiendi suukuivuse leevendamiseks jätkake suuhoolduse ja väikeste vedelikukoguste andmisega (lonksu kaupa), kui patsient suudab veel ise neelata. Praktiline soovitus |
| Õhupuuduse ravi | ||
| 32 |
|
Elulõpuravi saava õhupuudusega patsiendi puhul järgige õhupuuduse ravi soovitusi (vt õhupuuduse käsitluse algoritmi palliatiivse ravi juhendi I osa lisas 2). Praktiline soovitus |
| 33 |
|
Terminaalses seisundis õhupuudusega patsiendi puhul alustage mittefarmakoloogiliste sekkumiste ja/või opioididega ning ärevuse leevendamisega, sest need on tõhusamad sekkumised kui hapnikravi (vt õhupuuduse käsitluse algoritmi palliatiivse ravi juhendi I osa lisas 2). Tugev positiivne soovitus, väga madal tõendatuse aste |
| Palliatiivse ravi vajaduse hindamine | ||
| 34 |
|
Patsiendi palliatiivse ravi vajaduse terviklikuks käsitluseks hinnake igakordsel kohtumisel patsiendi seisundit ja sümptomeid, patsiendi ja lähedaste psühholoogilisi, sotsiaalseid ja spirituaalseid vajadusi, võimalikke stressiallikaid ning informatsiooni vajadust (vt lisa 8). Praktiline soovitus |
| 35 |
|
Patsiendi palliatiivse ravi vajaduse terviklikuks hindamiseks võite abistava töövahendina kasutada integreeritud palliatiivravi tulemusmõõdikut (ingl Integrated Palliative Care Outcome Scale, IPOS) (vt lisa 9). Nõrk positiivne soovitus, madal tõendatuse aste |
Palliatiivse ravi korraldus, meeskond ja koolitus |
||
| 36 |
|
Palliatiivse ravi korraldamiseks ja järjepidevuse tagamiseks soovitame Eestis kasutusele võtta palliatiivse ravi teenuste kolmetasandilise korralduse:
|
| 37 |
|
Palliatiivse ravi patsiendi liikumine palliatiivse ravi teenuste tasandite vahel sõltub patsiendi sümptomite ja seisundi raskusest, patsiendi ja lähedaste probleemidest ja vajadustest, palliatiivse ravi plaanist, teenuste olemasolust tasandil ja nende osutamise võimekusest. Praktiline soovitus |
| 38 |
|
Palliatiivne ravi on interdistsiplinaarne meeskonnatöö, mis lähtub patsiendi ja lähedaste vajadustest. Palliatiivse ravi põhimeeskonda peavad kuuluma arst, õde, sotsiaaltöötaja, hingehoidja/kaplan ja/ või psühholoog ning juhtumikorraldaja. Tugev soovitus, mõõdukas tõendatuse aste |
| 39 |
|
Arsti- ja õe põhiõppes soovitame suurendada palliatiivse ravi põhikoolituse mahtu. Töötavatele tervishoiutöötajatele soovitame tagada täiendkoolitused. Praktiline soovitus |
| 40 |
|
Spetsialiseeritud palliatiivse ravi teenuse osutajad peavad läbima palliatiivse ravi täiendkoolituse. Praktiline soovitus |
Ravijuhendi soovitused koos tõendusmaterjali lühikokkuvõtetega
Erakorraliste seisundite käsitlus palliatiivses ravis
Verejooksu käsitlus
Kliiniliselt olulist veritsust esineb 6–10%-l palliatiivse ravi patsientidest (11). Anatoomilistel põhjustel esineb verejooksu rohkem pea- ja kaelapiirkonna pahaloomuliste kasvajate korral, kirjanduse andmetel viimase elukuu jooksul isegi kuni 74%-l patsientidest (12). Verejooksu esineb sagedamini ka günekoloogiliste, uroloogiliste ning seedetrakti ja kopsukasvajate puhul. Massiivset verejooksu esineb kõige sagedamini kõrva-nina-kurgu pahaloomuliste kasvajate korral: kuni 4%-l patsientidest võib tekkida massiivne verejooks karotiidarteri lõhkemise tagajärjel. (13)
| 1 |
|
Patsiendil, kelle haigusspetsiifiline ravi on lõpetatud ja üldseisund ECOG skaala järgi 1–2 (vt lisa 1), on verejooksu käsitlus juhupõhine. Praktiline soovitus |
| 2 |
|
Kui patsiendil, kelle haigusspetsiifiline ravi on lõpetatud ja üldseisund ECOG skaala järgi 3–4, tekib põhihaigusega seotud verejooks, ei ole verekomponentide ülekanne ega invasiivsete ravisekkumiste rakendamine näidustatud (vt lisa 2). Praktiline soovitus |
Tõendusmaterjal verejooksu käsitlemise kohta palliatiivse ravi patsientide puhul on vähene, enamik uuringuid põhineb juhtumikirjeldustel ja eksperdiarvamustel. Ravijuhendi soovituste ja algoritmi koostamisel on kasutatud lisaks tõendusmaterjalile kirjanduse ülevaateid, palliatiivse ravi käsiraamatut ja arvestatud töörühma liikmete kliinilise kogemusega (14, 15). Palliatiivse ravi patsiendil esineva verejooksu korral tehtavad otsused sõltuvad patsiendi põhihaigusest, verejooksu asukohast, patsiendi seisundist (ECOG skaala alusel, vt lisa 1) ja ravivõimalustest. Kui patsiendi haigusspetsiifiline ravi on lõpetatud, peaksid juba varem olema koos patsiendi ja lähedastega tehtud edasist ravi puudutavad otsused. Need on vajalikud ka tervishoiutöötajatele, et otsustada patsiendi ravi ja abistamise üle. Kindlasti tuleb patsienti ja tema lähedasi informeerida verejooksu korral raske tüsistuse tekkimise võimalusest, et kaasata neid raviotsuste tegemisse ja õpetada esmast toimetulekut verejooksu tekkimisel.
Kõikidel verejooksuga patsientidel tuleb lõpetada veritsust soodustavate ravimite manustamine (antikoagulandid, antiagregandid, MSPVR-id, SSRI-d). (14, 15)
Verekomponentide ülekannete tegemise kohta ei leidunud ravijuhendites ega analüüsitud tõendusmaterjalis selgeid juhiseid, otsus on alati juhupõhine sõltuvalt patsiendi seisundist. Kui haigusspetsiifiline ravi on lõpetatud ja patsiendi üldseisund on ECOG skaala järgi 3–4, ei ole töörühma hinnangul verekomponentide ülekanne ega invasiivsete ravisekkumiste rakendamine näidustatud (vt ka soovitusi verekomponentide ülekande kohta elulõpuravis vastavas peatükis).
Invasiivsete ja haigusspetsiifiliste ravisekkumiste rakendamine sõltub patsiendi seisundist. Kui patsient saab haigusspetsiifilist ravi, tuleb konsulteerida erialaspetsialistiga, et arutada haigusspetsiifilise ravi võimalusi. Kui haigusspetsiifiline ravi on lõpetatud, kuid patsient on heas üldseisundis (ECOG 1–2), tuleb konsulteerida erialaspetsialistiga, et rääkida võimalike invasiivsete meetodite rakendamisest (kiiritusravi, endoskoopia, embolisatsioon, kirurgiline ravi) (14). Lokaalsete ravisekkumiste kasutamine verejooksu korral sõltub verejooksu asukoha ligipääsetavusest. Verejooksu vähendamiseks või peatamiseks võib sõltuvalt verejooksu asukohast kasutada külmaaplikatsioone, kompressiooni, hemostaatilisi vahendeid nii kompressiooniks kui ka loputamiseks (15). Kirjanduses on enam soovitusi traneksaamhappe kasutamise kohta nii süsteemselt kui ka lokaalselt. Võimaluse korral soovitatakse eelistada traneksaamhappe suukaudset manustamist (14, 16).
2014. aastal koostatud Cochrane’i süstemaatilises ülevaates hinnati traneksaamhappe suukaudset manustamist seedetrakti verejooksude korral. Leiti, et võrreldes platseeboga vähenes ravimi kasutamise korral patsientide suremus ja kirurgilise ravi vajadus, kuid see ei olnud statistiliselt oluline. Võrreldes traneksaamhapet lansoprasooli või tsimetidiiniga leiti, et nii verekomponentide ülekannete ja kirurgilise ravi vajadus kui ka korduvate verejooksude sagedus olid nii ravimit kui ka platseebot saanud patsientide rühmas sarnased. Samuti ei leitud erinevusi trombembooliliste tüsistuste esinemises. (16)
Veriköha puhul on võimalik kasutada traneksaamhapet nii süsteemselt kui ka lokaalselt inhaleerituna. Prudsky jt koostatud Cochrane’i süstemaatilisse ülevaatesse kaasati kaks uuringut (kokku 70 patsienti), kus hinnati suukaudselt või intravenoosselt manustatud traneksaamhappe mõju erinevate haiguste põhjustatud veriköha puhul. Leiti, et traneksaamhappe manustamine vähendas veriköha kestust oluliselt, kuid mitte selle kordumise riski. Olulisi kõrvaltoimeid ei leitud (17).
Verekomponentide ülekannete tegemise kohta ei leidunud ravijuhendites ega analüüsitud tõendusmaterjalis selgeid juhiseid, otsus on alati juhupõhine sõltuvalt patsiendi seisundist. Kui haigusspetsiifiline ravi on lõpetatud ja patsiendi üldseisund on ECOG skaala järgi 3–4, ei ole töörühma hinnangul verekomponentide ülekanne ega invasiivsete ravisekkumiste rakendamine näidustatud (vt ka soovitusi verekomponentide ülekande kohta elulõpuravis vastavas peatükis).
Invasiivsete ja haigusspetsiifiliste ravisekkumiste rakendamine sõltub patsiendi seisundist. Kui patsient saab haigusspetsiifilist ravi, tuleb konsulteerida erialaspetsialistiga, et arutada haigusspetsiifilise ravi võimalusi. Kui haigusspetsiifiline ravi on lõpetatud, kuid patsient on heas üldseisundis (ECOG 1–2), tuleb konsulteerida erialaspetsialistiga, et rääkida võimalike invasiivsete meetodite rakendamisest (kiiritusravi, endoskoopia, embolisatsioon, kirurgiline ravi) (14). Lokaalsete ravisekkumiste kasutamine verejooksu korral sõltub verejooksu asukoha ligipääsetavusest. Verejooksu vähendamiseks või peatamiseks võib sõltuvalt verejooksu asukohast kasutada külmaaplikatsioone, kompressiooni, hemostaatilisi vahendeid nii kompressiooniks kui ka loputamiseks (15). Kirjanduses on enam soovitusi traneksaamhappe kasutamise kohta nii süsteemselt kui ka lokaalselt. Võimaluse korral soovitatakse eelistada traneksaamhappe suukaudset manustamist (14, 16).
2014. aastal koostatud Cochrane’i süstemaatilises ülevaates hinnati traneksaamhappe suukaudset manustamist seedetrakti verejooksude korral. Leiti, et võrreldes platseeboga vähenes ravimi kasutamise korral patsientide suremus ja kirurgilise ravi vajadus, kuid see ei olnud statistiliselt oluline. Võrreldes traneksaamhapet lansoprasooli või tsimetidiiniga leiti, et nii verekomponentide ülekannete ja kirurgilise ravi vajadus kui ka korduvate verejooksude sagedus olid nii ravimit kui ka platseebot saanud patsientide rühmas sarnased. Samuti ei leitud erinevusi trombembooliliste tüsistuste esinemises. (16)
Veriköha puhul on võimalik kasutada traneksaamhapet nii süsteemselt kui ka lokaalselt inhaleerituna. Prudsky jt koostatud Cochrane’i süstemaatilisse ülevaatesse kaasati kaks uuringut (kokku 70 patsienti), kus hinnati suukaudselt või intravenoosselt manustatud traneksaamhappe mõju erinevate haiguste põhjustatud veriköha puhul. Leiti, et traneksaamhappe manustamine vähendas veriköha kestust oluliselt, kuid mitte selle kordumise riski. Olulisi kõrvaltoimeid ei leitud (17).
Mõõdukakvaliteediga RCT-s (47 uuritavat) võrreldiinhaleeritavatraneksaamhappe tõhusust platseeboga eri põhjusega veriköha ravis. Traneksaamhapet saanud uuritavate rühmas vähenes veriköha maht oluliselt alates teisest ravipäevast. Viiendaks ravipäevaks oli traneksaamhappe rühmas veriköha lakanud enamatel patsientidel kui platseeborühmas. Samuti oli traneksaamhapet saanud uuritavate rühma puhul keskmine haiglaravi kestus päevades lühem. (18) Traneksaamhappe kasutamine verejooksu korral on toodud verejooksu käsitlemise algoritmis lisas 2, annused ja kasutatavad ravimivormid sõltuvad verejooksu asukohast.
Massiivsete verejooksude korral peavad pingutused olema suunatud patsiendi ja lähedaste toetamisele. Lähedastele tuleb juba varem õpetada, millised on esmased võtted massiivse verejooksu tekkimisel patsiendi abistamiseks (võimaluse korral asendi muutmine, patsiendi rahustamine, verejooksu koha katmine tumedate linade või rätikutega). Farmakoloogilistest meetoditest on kasutatud võimalikult kiiret morfiini või midasolaami manustamist patsiendi sedatsiooniks, kui see on võimalik (vt verejooksu käsitluse algoritmi lisas 2). (13, 14, 15) Haiglas või hospiitsis viibiva patsiendi puhul on oluline tervishoiutöötaja juuresolek, patsienti ei tohi jätta üksi (15).
Massiivsete verejooksude korral peavad pingutused olema suunatud patsiendi ja lähedaste toetamisele. Lähedastele tuleb juba varem õpetada, millised on esmased võtted massiivse verejooksu tekkimisel patsiendi abistamiseks (võimaluse korral asendi muutmine, patsiendi rahustamine, verejooksu koha katmine tumedate linade või rätikutega). Farmakoloogilistest meetoditest on kasutatud võimalikult kiiret morfiini või midasolaami manustamist patsiendi sedatsiooniks, kui see on võimalik (vt verejooksu käsitluse algoritmi lisas 2). (13, 14, 15) Haiglas või hospiitsis viibiva patsiendi puhul on oluline tervishoiutöötaja juuresolek, patsienti ei tohi jätta üksi (15).
Intrakraniaalse rõhu tõusu ja epileptilise hoo käsitlus
Intrakraniaalse rõhu tõusu üks sümptomeid on epileptiliste hoogude esinemine, kuid esineda võivad ka peavalu, hemiparees, kognitiivsed häired, iiveldus, oksendamine, lihaste spasmid või teadvushäire. Epileptilisi hooge esineb umbes 13%-l palliatiivse ravi patsientidest, seejuures on 25–50%-l ajumetastaasid ja umbes 20–45%-l primaarne ajukasvaja. Epileptilised hood võivad tekkida ka biokeemiliste muutuste tõttu organismis või ravimite kõrvaltoimena. On leitud, et naistel esineb kaks korda suurem risk epileptiliste hoogude tekkeks.
(19) Seepärast on epileptiliste hoogude põhjuse selgitamiseks vajalik põhjalik patsiendi anamnees ja uurimine. Epileptiliste hoogude esinemine on traumeeriv nii patsiendile kui ka tema lähedastele. Tähtis on kiiresti raviga alustada, kuid kindlasti ka patsienti ja tema lähedasi õpetada. Intrakraniaalse rõhu tõusu korral tuleb kindlasti patsienti ja lähedasi teavitada võimalikust epileptiliste hoogude võimalusest ning õpetada neile esmaseid võtteid patsiendi abistamiseks. Patsient ja lähedased peavad teadma, mida teha vigastuste vältimiseks, kuidas panna patsient stabiilsesse küliliasendisse, et patsiendile ei tohi epileptilise hoo ajal midagi suhu panna. Vajaduse korral võib kasutada hapnikravi. Elulõpuravis tuleb arvestada patsiendi eelistusi ja hinnata antikonvulsantide võimalikku mõju tema elukvaliteedile.
(19) Seepärast on epileptiliste hoogude põhjuse selgitamiseks vajalik põhjalik patsiendi anamnees ja uurimine. Epileptiliste hoogude esinemine on traumeeriv nii patsiendile kui ka tema lähedastele. Tähtis on kiiresti raviga alustada, kuid kindlasti ka patsienti ja tema lähedasi õpetada. Intrakraniaalse rõhu tõusu korral tuleb kindlasti patsienti ja lähedasi teavitada võimalikust epileptiliste hoogude võimalusest ning õpetada neile esmaseid võtteid patsiendi abistamiseks. Patsient ja lähedased peavad teadma, mida teha vigastuste vältimiseks, kuidas panna patsient stabiilsesse küliliasendisse, et patsiendile ei tohi epileptilise hoo ajal midagi suhu panna. Vajaduse korral võib kasutada hapnikravi. Elulõpuravis tuleb arvestada patsiendi eelistusi ja hinnata antikonvulsantide võimalikku mõju tema elukvaliteedile.
| 3 |
|
Ajumetastaaside või primaarse ajukasvajaga palliatiivse ravi patsiendile on näidustatud deksametasooni kasutamine:
Tugev positiivne soovitus, madal tõendatuse aste
|
Glükokortikosteroide on aastakümneid kasutatud ajutuumoriga patsientide ravis. Need kuuluvad kõige efektiivsemate ravimite hulka tuumoriga seotud turse vähendamisel, samuti kiiritusravi kõrvaltoimete ja entsefalopaatia riski vähendamisel (20). Ajumetastaaside või primaarse ajutuumori korral kasutatakse epileptiliste hoogude tekke ennetamiseks ja intrakraniaalse rõhu tõusu sümptomite raviks enamasti deksametasooni. Võib kasutada ka teisi glükokortikosteroide ekvivalentsetes annustes, kuid vähese mineralokortikoidse toime ja pika toimeaja pärast eelistatakse deksametasooni (21). Deksametasooni kõrvaltoimed sõltuvad annusest ja kasutamise pikkusest. Optimaalsete deksametasooni annuste kohta on tõendusmaterjali hulk piiratud. Rykeni jt (2010) koostatud süstemaatilise ülevaate järeldustena toodi välja, et vaatamata glükokortikosteroidide sagedasele kasutamisele intrakraniaalse rõhu tõusu korral, leidub vähe uuringuid nende ravimite kasutamise kohta. Glükokortikosteroidide kasutamise kohta ajumetastaasidega patsientidel leiti kaks uuringut. Ühe uuringu tulemusi ei saanud andmete statistiliste analüüsi puudumise tõttu ülevaates kasutada. Teises uuringus hinnati 8 mg ja 16 mg deksametasooni annuste mõju intrakraniaalse rõhu tõusu tunnusteta patsientidel (n = 89) ja leiti, et Karnofsky indeks paranes mõlemas rühmas võrdselt seitsmendaks ravipäevaks. (21) Kõrvaltoimeid esines sagedamini neljanädalase ravi järel 16 mg saanud uuritavate rühmas (22).
Retrospektiivses vaatlusuuringus selgitati glükokortikosteroidide määramist ja kasutamist hospiitsis. 51% patsientidest (n = 178) said glükokortikosteroide, seejuures nendest umbes pooled patsiendid kuni elu lõpuni. 24% patsientidest said ravimit intrakraniaalse rõhu tõusu tõttu. Autorid märkisid glükokortikosteroidide pikaajalise kasutamise ühe võimaliku põhjusena adekvaatse sümptomkontrolli tagamise vajaduse. (23)
Retrospektiivses vaatlusuuringus selgitati glükokortikosteroidide määramist ja kasutamist hospiitsis. 51% patsientidest (n = 178) said glükokortikosteroide, seejuures nendest umbes pooled patsiendid kuni elu lõpuni. 24% patsientidest said ravimit intrakraniaalse rõhu tõusu tõttu. Autorid märkisid glükokortikosteroidide pikaajalise kasutamise ühe võimaliku põhjusena adekvaatse sümptomkontrolli tagamise vajaduse. (23)
Arvestades kliinilist kogemust ja tõendusmaterjali, on ilma intrakraniaalse rõhu tõusu sümptomiteta patsientidel soovitatav kasutada väiksemaid glükokortikosteroidide annuseid (4–8 mg/ööpäevas), sest see on sama tõhus kui suurem annus. Intrakraniaalse rõhu tõusu sümptomitega patsientidel on soovitatav kasutada suuremaid annuseid ja sümptomite taandumisel annust vähendada (vt intrakraniaalse rõhu tõusu ja epileptilise hoo käsitluse algoritmi lisas 3)
(21). Deksametasooni kasutamisel tuleb patsiente kindlasti jälgida võimaliku seeninfektsiooni tekke tõttu. Kuna deksametasooni soovitatakse intrakraniaalse rõhu tõusu korral palliatiivse ravi juhendites, käsiraamatutes ja ülevaateartiklites esmavaliku ravimina (15, 24, 26) ning kliinilisele kogemusele tuginedes on ravijuhendi töörühma liikmetel ravimi kasutamisega head kogemused, otsustati vaatamata vähemale tõendusele sõnastada tugev soovitus. Arvestati ka seda, et patsiendi ja tema lähedaste jaoks on intrakraniaalse rõhu tõus väga ebameeldiv ja häiriv sümptom, mis vajab kiiret sekkumist.
(21). Deksametasooni kasutamisel tuleb patsiente kindlasti jälgida võimaliku seeninfektsiooni tekke tõttu. Kuna deksametasooni soovitatakse intrakraniaalse rõhu tõusu korral palliatiivse ravi juhendites, käsiraamatutes ja ülevaateartiklites esmavaliku ravimina (15, 24, 26) ning kliinilisele kogemusele tuginedes on ravijuhendi töörühma liikmetel ravimi kasutamisega head kogemused, otsustati vaatamata vähemale tõendusele sõnastada tugev soovitus. Arvestati ka seda, et patsiendi ja tema lähedaste jaoks on intrakraniaalse rõhu tõus väga ebameeldiv ja häiriv sümptom, mis vajab kiiret sekkumist.
| 4 |
|
Palliatiivse ravi patsiendil kasutage epileptilise hoo kupeerimiseks bensodiasepiine. Veenitee puudumisel eelistage ravimi manustamist suu limaskestale, intranasaalselt (ninaaplikaatoriga) või rektaalselt (vt lisa 3). Tugev positiivne soovitus, mõõdukas tõendatuse aste |
Epileptiliste hoogude esmaseks raviks soovitatakse kasutada bensodiasepiine – lorasepaami, midasolaami või diasepaami. Ei leidunud uuringuid, mis hindaksid bensodiasepiinide tõhusust palliatiivse ravi patsientidel esinevate epileptiliste hoogude raviks. Epilepsiaga patsientide seas tehtud uuringute põhjal on lorasepaam epileptiliste hoogude kupeerimisel tõhusam kui diasepaam, teise ravimi vajadus epileptilise staatuse kupeerimisel on sel juhul väiksem. Samuti on lorasepaamil sobivamad farmakoloogilised omadused (pikem antiepileptiline aktiivsus aeglase redistributsiooni tõttu rasvkoest). (27) Haiglaeelses etapis tehtud juhuslikustatud uuringus (n = 893) leidsid autorid, et midasolaam on lorasepaamiga epileptiliste hoogude kupeerimisel sama tõhus, ka haiglasse ja intensiivravisse hospitaliseeritud uuritavate arv oli mõlemas rühmas sarnane. Samas ei ole selge, kas epileptiliste hoogude kordumissagedus erines kahe ravimirühma uuritavate vahel. (28) Selgeid soovitusi bensodiasepiinide algannuse kohta epileptiliste hoogude ennetamiseks palliatiivse ravi patsientidel ei leitud, kuid üldiselt soovitatakse kirjanduse andmetel alustada väiksema annusega, vajaduse korral võib ravimit manustada korduvalt (29). Veenitee puudumisel tuleb
eelistada manustamist nina või suu limaskesta kaudu või rektaalselt, vältida tuleb lihasesisest manustamist. Kui patsiendil esinevad lühikesed fokaalsed epileptilised hood (hoog lühem kui viis minutit ja vähem kui kolm hoogu ühe tunni jooksul), ei ole bensodiasepiinide kasutamine otstarbekas. (15, 29)
| 5 |
|
Palliatiivse ravi patsiendile epilepsiavastaste ravimite määramisel alustage väikeste annustega ja suurendage annust aeglaselt olenevalt ravitoimest ja jälgides ravimite kõrvaltoimete mõju elukvaliteedile. Praktiline soovitus |
| 6 |
|
Kui palliatiivse ravi patsiendile on näidustatud keemiaravi ja ta vajab samal ajal antikonvulsanti, kaaluge CYP-ensüüme mitteindutseerivate epilepsiavastaste ravimite kasutamist (vt lisa 3). Praktiline soovitus |
| 7 | |
Kui terminaalses seisundis patsiendil tekib epileptiline hoog, ei ole epilepsiavastase ravi alustamine näidustatud. Praktiline soovitus |
Epilepsiavastaste ravimite kasutamine epileptiliste hoogude ennetamiseks ei ole intrakraniaalse rõhu tõusu korral näidustatud. Cochrane’i süstemaatilises ülevaates, kuhu kaasati viie RCT tulemused, ei leitud vahet epilepsiavastaste ravimite ja platseebo tõhususes epileptiliste hoogude ennetamisel. Epilepsiavastastel ravimitel on ka palju kõrvaltoimeid ja koostoimeid glükokortikosteroidide ja tsütostaatikumidega. (30)
Kuna epilepsiavastastel ravimitel esineb palju kõrvaltoimeid, tuleb nende kasutamise alguses hinnata ravimite kõrvaltoimete mõju patsiendi elukvaliteedile. Ravi tuleb alustada väikeste annustega ja aeglaselt tiitrides. Kui patsient saab keemiaravi ja vajab samal ajal antikonvulsanti, tuleb kaaluda CYP-ensüüme mitteindutseerivate epilepsiavastaste ravimite kasutamist (levetiratsetaam, gabapentiin, pregabaliin, lamotrigiin) (vt lisa 3). (19)
Kuna epilepsiavastastel ravimitel esineb palju kõrvaltoimeid, tuleb nende kasutamise alguses hinnata ravimite kõrvaltoimete mõju patsiendi elukvaliteedile. Ravi tuleb alustada väikeste annustega ja aeglaselt tiitrides. Kui patsient saab keemiaravi ja vajab samal ajal antikonvulsanti, tuleb kaaluda CYP-ensüüme mitteindutseerivate epilepsiavastaste ravimite kasutamist (levetiratsetaam, gabapentiin, pregabaliin, lamotrigiin) (vt lisa 3). (19)
Ülemise õõnesveeni maliigse kompressiooni käsitlus
Ülemise õõnesveeni kompressiooni esineb 60–85%-l juhtudest seoses kasvajatega, seejuures on sageli põhjuseks bronhi kartsinoomid, eriti mitteväikerakk-kopsuvähk. Kasvaja võib sulgeda õõnesveeni nii kompressiooni
kui ka lümfisõlmede suurenemise kaudu, on kirjeldatud ka otsest läbikasvu. Mittemaliigsetest põhjustest on kõige sagedasem intravaskulaarsest kateetrist tingitud tromboos. (31)
| 8 |
|
Palliatiivse ravi patsiendil, kellel on tekkinud ülemise õõnesveeni maliigse kompressiooni kliiniline pilt, kaaluge deksametasooni ja madalmolekulaarse hepariini kasutamist ning konsulteerige onkoloogiga võimalike täiendavate ravisekkumiste selgitamiseks (vt lisa 4). Praktiline soovitus |
Ülemise õõnesveeni kompressioon võib olla haiguse esmane avaldus. Sel juhul tuleb täpse diagnoosi panemiseks ja raviplaani koostamiseks teha uuringud. Kõikide patsientide puhul tuleb konsulteerida onkoloogiga võimalike täiendavate ravisekkumiste asjus (keemia-, kiiritusravi, stentimine) (15). Tõendusmaterjal nende ravimeetodite tõhususe kohta on piiratud. 2002. aastal avaldatud süstemaatilises ülevaates jõuti järeldusele, et bronhikasvajaga patsientidel on keemia- ja kiiritusravi tõhusad 60–77%-l juhtudest, stentimine kuni 95%-l juhtudest
(32). Glükokortikosteroidide tõhususe kohta autorid tõendusmaterjali puudumise tõttu järeldusi teha ei saanud, kuid kliinilises praktikas on deksametasooni suure annuse kasutamine osutunud tõhusaks (15).
Healoomulise õõnesveeni tromboosi korral on näidustatud antikoagulantravi. Ka pahaloomulise ülemise õõnesveeni kompressiooni korral kasutatakse sageli antikoagulantravi madalmolekulaarse hepariiniga, kuid sekkumise tõhusust uuringutes tõestatud ei ole (33). 2019. aastal avaldatud retrospektiivsesse uuringusse kaasati 183 ülemise õõnesveeni kompressiooniga patsienti, kes said terapeutilises annuses antikoagulanti. Jälgimisperioodi ajal arenes tromboos 13%-l uuritavatest, kes said antikoagulantravi, ja 11%-l uuritavatest, kes seda ei saanud. Antikoagulatsiooni foonil oli stendi paneku vajadus väiksem, kuid mitte statistiliselt olulisel määral. Oluline veritsus esines seitsmel patsiendil (7%), kellest kuus said antikoagulantravi. Tromboosi teke ega antikoagulantravi kasutamine ei mõjutanud elumust. (33)
Mittefarmakoloogilistest sekkumistest soovitatakse kõrgendatud peaalust, et vähendada hüdrostaatilist rõhku peas ja kaelas, kuigi see pole uuringutega tõestatud (31).
(32). Glükokortikosteroidide tõhususe kohta autorid tõendusmaterjali puudumise tõttu järeldusi teha ei saanud, kuid kliinilises praktikas on deksametasooni suure annuse kasutamine osutunud tõhusaks (15).
Healoomulise õõnesveeni tromboosi korral on näidustatud antikoagulantravi. Ka pahaloomulise ülemise õõnesveeni kompressiooni korral kasutatakse sageli antikoagulantravi madalmolekulaarse hepariiniga, kuid sekkumise tõhusust uuringutes tõestatud ei ole (33). 2019. aastal avaldatud retrospektiivsesse uuringusse kaasati 183 ülemise õõnesveeni kompressiooniga patsienti, kes said terapeutilises annuses antikoagulanti. Jälgimisperioodi ajal arenes tromboos 13%-l uuritavatest, kes said antikoagulantravi, ja 11%-l uuritavatest, kes seda ei saanud. Antikoagulatsiooni foonil oli stendi paneku vajadus väiksem, kuid mitte statistiliselt olulisel määral. Oluline veritsus esines seitsmel patsiendil (7%), kellest kuus said antikoagulantravi. Tromboosi teke ega antikoagulantravi kasutamine ei mõjutanud elumust. (33)
Mittefarmakoloogilistest sekkumistest soovitatakse kõrgendatud peaalust, et vähendada hüdrostaatilist rõhku peas ja kaelas, kuigi see pole uuringutega tõestatud (31).
Seljaaju maliigse kompressiooni käsitlus
Seljaaju maliigne kompressioon või metastaatiline ekstraduraalne seljaaju kompressioon on erakorraline seisund, mida esineb 5–10%-l pahaloomulise kasvajaga patsientidest. Kõige sagedamini põhjustavad seda luumetastaasid lülisambas: rinnaosas (70%), nimmeosas (20%) või kaelaosas (10%). Enamikul juhtudel on seljaaju kompressioon põhjustatud kopsu-, rinna- või eesnäärmevähist ja tähendab seda, et pahaloomuline haigus on levinud, viidates halvale haiguse prognoosile, mis mõjutab patsiendi füüsilist ja psühholoogilist seisundit
(35). Seljaaju maliigne kompressioon võib põhjustada äkilist ja dramaatilist elukvaliteedi vähenemist, kui see tekib koos täieliku motoorse defitsiidi ning põie ja pärasoole sfinkteri kontrolli kadumisega (36).
Seljaaju maliigse kompressiooni raviotsuste tegemisel on oluline neuroloogilise defitsiidi ulatus ja patsiendi eelnev üldseisund ECOG skaala järgi. Ravimeetoditena on kasutusel glükokortikosteroidid, kiiritusravi ja dekompressiivne kirurgia.
(35). Seljaaju maliigne kompressioon võib põhjustada äkilist ja dramaatilist elukvaliteedi vähenemist, kui see tekib koos täieliku motoorse defitsiidi ning põie ja pärasoole sfinkteri kontrolli kadumisega (36).
Seljaaju maliigse kompressiooni raviotsuste tegemisel on oluline neuroloogilise defitsiidi ulatus ja patsiendi eelnev üldseisund ECOG skaala järgi. Ravimeetoditena on kasutusel glükokortikosteroidid, kiiritusravi ja dekompressiivne kirurgia.
| 9 |
|
Kõikidele palliatiivse ravi patsientidele, kellel on tekkinud seljaaju maliigse kompressiooni kliiniline pilt, on näidustatud deksametasooni kasutamine (vt lisa 5). Tugev positiivne soovitus, madal tõendatuse aste |
Neuroloogilise defitsiidi tekkimisel või juba tekkinud seljaaju maliigse kompressiooni kliinilise pildi korral on nii tõenduspõhiselt kui ka kliinilises praktikas saadud häid tulemusi glükokortikosteroidide (deksametasooni) kasutamisega (37, 38). Cochrane’i süstemaatilises ülevaates võrreldi glükokortikosteroidide suuri annuseid (96–100 mg) mõõdukate annustega (16– 32 mg) või platseeboga (kolm väikest uuringut, kokku 105 uuritavat). Ei leitud paremaid tulemusi üldises liikumisvõime paranemises ega pikaajalises elumuses (üle kahe aasta; madala kvaliteediga tõendus), kui võrreldi suures (96–100 mg) ja väikeses annuses (10–16 mg) glükokortikosteroide. Samas leiti, et suurte annuste korral kaasneb raskete kõrvaltoimete oht. (38) Kaasatud ravijuhendites, ülevaateartiklites ja palliatiivse ravi käsiraamatus soovitatakse seljaaju maliigse kompressiooni korral esmavalikuna manustada glükokortikosteroide, enamasti deksametasooni (15, 24, 25, 26, 39). Ka töörühma hinnangul on deksametasooniga ravi alustamine patsiendi seisundi leevendamiseks tõhus ja seetõttu sõnastatakse tugev soovitus.
| 10 |
|
Kui palliatiivse ravi patsiendil, kelle üldseisund on enne olnud ECOG skaala järgi 1–2, on tekkinud seljaaju maliigse kompressiooni kliiniline pilt, tuleb püsiva neuroloogilise kahjustuse vältimiseks teha kiiritusravi või kirurgiline dekompressioon 48 tunni jooksul sümptomite tekkest (vt lisa 5). Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 11 |
|
Kui palliatiivse ravi patsiendil, kelle üldseisund on enne olnud ECOG skaala järgi 3–4, on tekkinud seljaaju maliigse kompressiooni kliiniline pilt, alustage esimesel võimalusel deksametasooni ja valuraviga (vt lisa 5). Praktiline soovitus |
| 12 |
|
Palliatiivse ravi patsiendile seljaaju maliigse kompressiooni käsitluse raviplaani tegemiseks on vajalik valveonkoloogi konsultatsioon. Praktiline soovitus |
Muude ravisekkumiste kasutamisel tuleb arvestada haiguse levikut ja patsiendi seisundit (aluseks tuleb võtta ECOG sooritusvõime skaalal hindamine). Nii kiiritusravi kui ka kirurgiline dekompressioon on tõendusmaterjali põhjal seljaaju maliigse kompressiooni ravis tõhusad meetodid, kuid enne nende kasutamist tuleb konsulteerida erialaspetsialistiga, et koostada patsiendile sobivaim raviplaan (34, 38, 39). Nii kirurgiline ravi kui ka kiiritusravi peaksid algama
48 tunni jooksul neuroloogiliste sümptomite tekkest. Kiiritusravi võiks olla esmane ravivalik säilinud liikumisvõimega seljaaju maliigse kompressiooniga patsientide puhul ja ka neil, kes ei vasta dekompressiivkirurgia kriteeriumitele. (38, 40) Retrospektiivse uuringu kokkuvõttes leiti, et patsientide elumus on oluliselt parem kui kirurgiline ravi ja kiiritusravi tehakse enne motoorse defitsiidi teket (338 päeva vs. 150 päeva). Juba välja kujunenud neuroloogilise defitsiidiga patsientidel paranes neuroloogiline staatus, kui operatsioon tehti vähem kui 48 tunni jooksul. Hiljem tehtud operatsioon neuroloogilist staatust ei parandanud. (40)
Maliigse ja mittemaliigse pleuraefusiooni käsitlus
Maliigne pleuraefusioon on sage kliiniline probleem. 15%-l pahaloomulise kasvajaga patsientidest võib pleura maliigse infiltratsiooni tulemusena tekkida haiguse arenedes pleuraefusioon. Kopsu kompressioonist ning halvenenud
rindkere seina ja diafragma liikumisest tekib õhupuudus, mis sageli vedeliku eemaldamise järel oluliselt leeveneb (41). Maliigse pleuraefusiooni tekkel võib olla palju põhjuseid ja ravi sõltub tekkepõhjustest, sümptomaatikast, efusiooni taastekke kiirusest, kopsu laienemise võimest, patsiendi seisundist ning eelistustest (vt lisa 6) (42). Maliigse pleuraefusiooni korral kasutatavad ravisekkumised on palliatiivse iseloomuga ja nende eesmärk on parandada patsiendi elukvaliteeti. Ükski neist ravimeetoditest ei paranda elumust. Asümptomaatiline pleuraefusioon ei vaja sekkumist.
| 13 | |
Palliatiivse ravi patsiendil esinev asümptomaatiline pleuraefusioon ei vaja sekkumist. Praktiline soovitus |
| 14 |
|
Palliatiivse ravi patsiendile on sümptomaatilise maliigse pleuraefusiooni (suure valgusisaldusega) korral näidustatud pleurapunktsioon (vt lisa 6). Praktiline soovitus |
| 15 |
|
Kui palliatiivse ravi patsiendil pleurapunktsiooni järel maliigse pleuraefusiooni sümptomid leevenevad, sõltub patsiendi edasine käsitlus pleuravedeliku taastekke kiirusest, üldseisundist ja vaevuste raskusest (vt lisa 6). Praktiline soovitus |
| 16 |
|
Kui palliatiivse ravi patsiendil taastekib maliigse pleuraefusiooni korral pleuravedelik aeglaselt (30 ja enam päeva), on näidustatud korduv pleurapunktsioon. Praktiline soovitus |
| 17 |
|
Kui palliatiivse ravi patsiendil taastekib maliigse pleuraefusiooni korral pleuravedelik kiiresti (alla 30 päeva), põhjustades vaevusi, ja patsiendi üldseisund võimaldab (ECOG 1–2), kaaluge erialaspetsialisti konsultatsiooni talkpleurodeesi tegemiseks. Kui patsiendi üldseisund ei võimalda (ECOG 3–4) talkpleurodeesi, on näidustatud püsidrenaaž (võimalusel eelistage tunnelleeritud püsidreeni). Tugev positiivne soovitus, mõõdukas tõendatuse aste |
| 18 |
|
Kui pleurapunktsiooni järel maliigse pleuraefusiooni sümptomid ei leevene ja palliatiivse ravi patsiendi üldseisund ECOG skaala järgi on 3–4, jätkake mitteinvasiivse vaevusi leevendava raviga (vt õhupuuduse käsitluse algoritmi palliatiivse ravi juhendi I osa lisas 2). Praktiline soovitus |
| 19 |
Palliatiivse ravi patsiendil, kellel on mittemaliigne pleuraefusioon, mis diureetilise ravi maksimaalsete talutavate annuste foonil püsib, kaaluge pleuraõõne püsidrenaaži (võimalusel eelistage tunnelleeritud püsidreeni). Praktiline soovitus |
Maliigse pleuraefusiooni korral on esmase ravimeetodina kasutusel pleurapunktsioon. Kui punktsiooni järel sümptomid leevenevad, tuleb patsienti jälgida. Edasine sekkumine sõltub patsiendi seisundist ja pleuravedeliku taastekke kiirusest. Konkreetse ravimeetodi üle otsustamiseks tuleb võimalusel konsulteerida erialaspetsialistiga. Kiire pleuravedeliku taastekke korral on ravivõimalused pleurodees või pleura dreneerimine tunnelleeritud püsidreeniga, kuid patsiendi seisund peab seda ravisekkumist võimaldama. Kui pleuravedeliku taasteke on aeglane, patsient ei ole heas üldseisundis ja eeldatav elumus on lühike, võib pleurapunktsiooni korrata. (42) Retrospektiivse kohortuuringu põhjal vajasid pleurodeesi ja pleuradreeniga patsiendid võrreldes korduva punktsiooni saanud patsientidega vähem järgnevaid protseduure ja EMO-visiite, ka tüsistusi (nt õhkrinda) esines vähem (43). Süstemaatilises analüüsis, kuhu kaasati viis RCT-d ja milles osales 545 uuritavat, ei leitud pleurodeesi ja tunnelleeritud püsidreeni võrdlemisel erinevusi elumuses ega õhupuuduse leevenemises. Haiglasoleku aeg oli lühem ja korduvaid pleuraalseid sekkumisi vajasid vähem tunnelleeritud püsidreeniga patsiendid. Kõrvaltoimetest esines tunnelleeritud püsidreeniga patsientidel sagedamini naha aluskoe tselluliiti. (44) Püsidreeni paigaldamine on patsiendile vähem koormav.
Pleurodeesi tegemisel on talgipulbri ja -lahuse kasutamine tõhusam kui teised preparaadid (41). Pleurodeesil nii pleuradreeni kui ka torakoskoopia kaudu ja tunnelleeritud püsidreenil on sarnane mõju mitmesugustele patsiendipõhistele tulemusnäitajatele, kuid tunnelleeritud püsidreeniga patsiendid on vähem aega haiglas (41, 42). Ka mittemaliigse pleuraefusiooni korral tuleb kaaluda püsidrenaaži, juhul kui diureetiline ravi ei ole mõjus (45).
Töörühm arutas soovituste sõnastamisel, kuidas eristada ajaliselt täpsemalt pleuravedeliku kiiret ja aeglast taasteket. Kliinilisele kogemusele tuginedes otsustati, et sagedamini kui kord kuus on pleurapunktsioon patsiendile koormav ja tüsistuste tekkerisk suurem. Seetõttu tuleb nende patsientide puhul kaaluda pleurodeesi või püsidrenaaži. Mittemaliigse pleuraefusiooni kohta otsustas töörühm koostada soovituse, sest kliinilises praktikas esineb olukordi, kus patsient saab maksimaalses annuses diureetilist ravi, kuid sellele vaatamata pleuravedeliku kogus ei vähene. Kirjanduse andmetel tuleb sel juhul kaaluda edasisi ravisekkumisi (45).
Astsiit
Astsiit võib tekkida mitmel põhjusel (maksatsirroos, pahaloomulised kasvajad, metastaasid, südamepuudulikkus, neerupuudulikkus). Kõige sagedamini, kuni 60% astsiitide üldarvust, esineb astsiiti maksatsirroosiga patsientidel. Kasvajaga patsiendid moodustavad 10% astsiidi juhtudest. Astsiidi tekkimine on seotud halva prognoosi ja suure suremusega. (46, 47)
| 20 |
|
Kui palliatiivse ravi patsiendil on mittemaliigsest astsiidist tingitud vaevused, mis diureetilise ravi maksimaalsete talutavate annuste foonil püsivad, on näidustatud punktsioon (vt lisa 7). Praktiline soovitus |
| 21 |
|
Kui palliatiivse ravi patsiendil taastekib astsiidi esmase punktsiooni järel astsiit aeglaselt (30 ja enam päeva), on näidustatud korduv punktsioon. Kui esmase punktsiooni järel taastekib astsiit kiiresti (alla 30 päeva), kaaluge püsidrenaaži (vt lisa 7). Praktiline soovitus |
Mittemaliigse astsiidi ravi tuleb alustada diureetikumidega, millest uuringute põhjal on tõhusad spironolaktoon, furosemiid nii monoteraapiana kui ka kombinatsioonis ning vedeliku ja soola tarvitamise piiramine (48). Juhuslikustatud uuringus maksatsirroosiga ilma neerupuudulikkuseta mõõduka astsiidiga patsientide seas leiti, et aldosterooni antagonisti kasutamisel monoteraapiana vallandus diurees, kuid kombinatsioonis furosemiidiga saadi astsiidivedeliku vähenemisel kiiremad tulemused (48). Mittemaliigse astsiidi ravi korral on vajalik regulaarne elektrolüütide ja jääkainete jälgimine. Kui need häiruvad, tuleb diureetiline ravi katkestada. Pahaloomulisest kasvajast tingitud astsiidi korral diureetiline ravi sageli ei aita. Diureetiline toime on saavutatud patsientidel, kelle seerumi/astsiidi gradient on > 11 g/l. (46)
Kui astsiit põhjustab vaevusi, on nii maliigse kui ka mittemaliigse astsiidi korral näidustatud astsiidi punktsioon. Palliatiivse ravi patsientide seas astsiidiravi kohta tehtud uuringuid leidus vähe. Väikesemahulise uuringu tulemuste põhjal ei ole püsidreeni paigaldamine keeruline, keskmiselt püsis dreen paigal 117 päeva. Tüsistustest tekkis spontaanset bakteriaalset peritoniiti, mida sai edukalt ravida antibiootikumidega. (49) Retrospektiivses uuringus leiti, et astsiidi korral tuleb kaaluda varajast püsidreeni paigaldamist korduva punktsiooni vältimiseks. Siiski võib pankreasevähiga patsientide puhul nende lühikese eeldatava elumuse tõttu alternatiivina jätkata korduva astsiidi punktsiooniga (50). Uuringute põhjal ei ole selget soovitust, milline peab olema ühekordselt eemaldatav astsiidivedeliku kogus (26). Kui punktsiooni on vaja teha enam kui kaks korda kuus, on töörühma hinnangul näidustatud püsidreeni paigaldamine. See on patsiendile vähem koormav ja vähendab tervishoiuasutusse pöördumisi.
| 22 |
|
Albumiini ja teiste plasmaasendajate kasutamine astsiidi punktsiooni järgse arteriaalse hüpotensiooni korrigeerimiseks ei ole põhjendatud. Nõrk negatiivne soovitus, madal tõendatuse aste |
Haiglates tehakse vahel astsiidi punktsiooni järel albumiini ülekanne, et vältida tsirkulatoorne düsfunktsiooni. Varasemates uuringutes on märgitud, et albumiini manustamine vähendab suremust suuremahulise paratsenteesi järel (üle viie liitri) (51). 2019. aastal koostatud Cochrane’i süstemaatiline ülevaade seda ei toeta. Halva kvaliteediga tõendusmaterjali põhjal ei leitud erinevusi suremuse, neerupuudulikkuse tekke, astsiidi taastekke, tõsiste kõrvaltoimete esinemises vereplasma asendajate kasutamise ja mittekasutamise puhul, samuti plasma asendajaid (k.a albumiini) omavahel võrreldes (52).
Võttes arvesse tõendusmaterjali ja patsiendi võimalikke eelistusi ning kulusid tervishoiusüsteemile, sõnastas töörühm nõrga negatiivse soovituse.
Elulõpuravi sekkumised palliatiivse ravi patsiendil
Diagnostilised uuringud
Elulõpuravis tehakse patsientidele sageli uuringuid, millest paljud ei ole tegelikult patsiendi vaevuste leevendamise seisukohalt vajalikud. 2016. aastal avaldatud süstemaatilises ülevaates, kuhu oli kaasatud 38 uuringut, leiti, et haiglates tehti 33–50%-le mitteelustamise otsusega patsientidest elu lõpus ebavajalikke uuringuid. Seejuures tehti umbes 49%-le mitteelustamise otsusega patsientidest jätkuvaid vereanalüüse, 37%-le patsientidest piltdiagnostilisi uuringuid ja 25%-le patsientidest erakorralisi piltdiagnostilisi uuringuid nende viimase kolme elukuu jooksul. Ebavajalike ravisekkumiste ja uuringute tegemise põhjusteks tuuakse kaasatud uuringutele toetudes ebapiisavad võimalused elulõpuravi puudutavate otsuste arutamiseks või selliste arutelude puudumine, kommunikatsiooniprobleemid tervishoiutöötajate ja patsientide vahel. Samuti on põhjusteks tervishoiutöötajate ebapiisavad oskused ära tunda haiguse raskus, suremise protsess või vajadus ravi piiramiseks, ebakindlus haiguse prognoosis, eetilised küsimused, kultuurilised ja spirituaalsed uskumused ning hoiakud, finantsilised küsimused seoses teenuste osutamisega, seadusandluse mõju, korraliku dokumentatsiooni puudumine ravi piiramise kohta ja patsiendi tulevikujuhiste mittemõistmine. Tavaliselt märgitakse ravi ja uuringute tegemise jätkamise põhjusena tervishoiusüsteemist tingitud tegureid, kuid neid oli kaasatud uuringutes siiski harva mainitud. (53) Eetilistel põhjustel puuduvad avaldatud uuringud, milles hinnataks diagnostiliste uuringute tegemise või tegemata jätmise mõju patsiendi elukvaliteedile elulõpuravis.
| 23 |
|
Elulõpuravi saavale patsiendile tehke diagnostilisi uuringuid juhul, kui nende tulemused on vajalikud täiendavate sümptomaatilise ravi võimaluste selgitamiseks. Praktiline soovitus |
| 24 | |
Terminaalses seisundis patsiendile on diagnostiliste uuringute tegemine ebaeetiline ega ole näidustatud. Praktiline soovitus |
Töörühma hinnangul võib kaaluda uuringute tegemist, kui nende tulemused on olulised sümptomaatilise ravi otsuste tegemisel, näiteks infektsioonide põhjuste selgitamiseks või sümptomaatilise ravi tõhustamiseks, muutmiseks. Reeglipärane
uuringute tegemine ei ole siiski vajalik. Terminaalses seisundis patsiendi vaevuste leevendamist diagnostiliste uuringute tulemused ei mõjuta, tegemist on kiiresti muutuva seisundiga. Seega on tegemist ebaeetilise sekkumisega, millest ei ole patsiendile kasu, vaid pigem kahju (liigutamine, analüüside võtmine, valu tegemine, ebamugavuse põhjustamine).
Antibakteriaalne ravi
Vaatlusuuringud on näidanud, et elulõpuravis kasutatakse sageli antibakteriaalset ravi, ka surmaeelsetel nädalatel (54, 55, 56, 57). Antibakteriaalne ravi jätkub tihti ka peale otsust jätkata vaid toetava raviga. Umbes veerand haiglas viibivatest palliatiivse ravi patsientidest saab viimastel elunädalatel antibakteriaalset ravi. (58)
Kuna antibakteriaalne ravi tundub mõne teise sekkumisega (nt intubeerimine, dialüüsravi) võrreldes ohutu, siis seda ravi pigem jätkatakse. Ravi lõpetamise põhjusteks on ühes uuringus toodud üldseisundi halvenemine (41%), ravi mittetoimimine (26%) ja patsiendi soov (14%). On näidatud, et antibakteriaalse ravi alustamine on enamasti lihtsam kui lõpetamine. Ravi alustab enamasti raviarst üksi, kuid lõpetamise otsuse tegemiseks kaasatakse suurem meeskond (59).
Kuna antibakteriaalne ravi tundub mõne teise sekkumisega (nt intubeerimine, dialüüsravi) võrreldes ohutu, siis seda ravi pigem jätkatakse. Ravi lõpetamise põhjusteks on ühes uuringus toodud üldseisundi halvenemine (41%), ravi mittetoimimine (26%) ja patsiendi soov (14%). On näidatud, et antibakteriaalse ravi alustamine on enamasti lihtsam kui lõpetamine. Ravi alustab enamasti raviarst üksi, kuid lõpetamise otsuse tegemiseks kaasatakse suurem meeskond (59).
| 25 |
|
Elulõpuravi saavale patsiendile tehke antibakteriaalset ravi infektsiooni korral, kui see leevendab infektsioonist põhjustatud häirivaid sümptomeid ja parandab eeldatavalt patsiendi elukvaliteeti. Praktiline soovitus |
| 26 |
Terminaalses seisundis patsiendile ei ole olenemata põletikumarkerite tõusust antibakteriaalse ravi tegemine põhjendatud. Praktiline soovitus |
Antibakteriaalse ravi kasutamise kasu kohta elu lõpus on vähe andmeid ja ei ole tehtud ühtegi juhuslikustatud uuringut. Selle kohta, kas antibakteriaalne ravi pikendab elu, on tulemused vastuolulised. Pigem on leitud, et antibakteriaalne ravi ei pikenda elu (60). Kuna antibakteriaalse raviga kaasneb antimikroobse resistentsuse väljakujunemise risk ja kõrvaltoimed (nt Clostridium difficile infektsioon), tuleb elulõpuravi saavate patsientide puhul kaaluda antibakteriaalse
ravi alustamist vaid siis, kui sellel võiks olla haiguse sümptomeid leevendav mõju
(61). Näiteks leevendab uroinfektsioonide ravi düsuuria sümptomeid ja söögitoru kandidoosi ravi vähendab düsfaagiat, kuid tõenduspõhisus antibakteriaalse ravi mõju kohta hingamisteede infektsioonide sümptomite leevendamisele on vastuoluline (62, 63).
Antibakteriaalse ravi kasud ja kahjud tuleb alati juhupõhiselt läbi arutada ning vajaduse korral ka lähedastele selgitada. Lähtuma peab patsiendi soovidest ja elukvaliteedi paranemise tõenäosusest. Elu lõpus olevate patsientide antibakteriaalse ravi alustamise otsus ei tohiks põhineda vaid laborianalüüside tulemustel (põletikumarkerite tõus). Soome palliatiivse ravi juhendi soovituste põhjal tuleb antibakteriaalset ravi elu lõpus kaaluda juhupõhiselt ja kasutada siis, kui see on tõesti vajalik infektsioonisümptomite leevendamiseks, eelistatult suukaudselt (nt kuseteede infektsioonid). Kui ravivastust ei saada, tuleb antibakteriaalne ravi lõpetada. (26, 64)
(61). Näiteks leevendab uroinfektsioonide ravi düsuuria sümptomeid ja söögitoru kandidoosi ravi vähendab düsfaagiat, kuid tõenduspõhisus antibakteriaalse ravi mõju kohta hingamisteede infektsioonide sümptomite leevendamisele on vastuoluline (62, 63).
Antibakteriaalse ravi kasud ja kahjud tuleb alati juhupõhiselt läbi arutada ning vajaduse korral ka lähedastele selgitada. Lähtuma peab patsiendi soovidest ja elukvaliteedi paranemise tõenäosusest. Elu lõpus olevate patsientide antibakteriaalse ravi alustamise otsus ei tohiks põhineda vaid laborianalüüside tulemustel (põletikumarkerite tõus). Soome palliatiivse ravi juhendi soovituste põhjal tuleb antibakteriaalset ravi elu lõpus kaaluda juhupõhiselt ja kasutada siis, kui see on tõesti vajalik infektsioonisümptomite leevendamiseks, eelistatult suukaudselt (nt kuseteede infektsioonid). Kui ravivastust ei saada, tuleb antibakteriaalne ravi lõpetada. (26, 64)
Verekomponentide ülekanded
Tõendusmaterjali vähesuse ja piiratuse tõttu pole võimalik selgelt hinnata, kas elulõpuravil olevad patsiendid võiksid saada kasu verekomponentide ülekannetest. Pigem on leitud, et kasu on minimaalne ning subjektiivne elukvaliteedi paranemine vähene ja lühiajaline. Arvestada tuleb ka verekomponentide ülekannete võimalikke riske ja täiendavat rahalist kulu tervishoiusüsteemile. Seni avaldatud uuringutesse on kaasatud peamiselt kaugelearenenud pahaloomuliste kasvajatega patsiendid, seega ei saa väheste avaldatud uuringute tulemusi üldistada kõigile elulõpuravil olevatele patsientidele.
| 27 |
|
Väljendunud aneemia sümptomite puhul võite elulõpuravi saavale patsiendile, kelle üldseisund ECOG skaala järgi on 1–2, teha verekomponentide ülekande, kui see parandab lühiajaliselt tema elukvaliteeti. Kui verekomponentide ülekanne ei vähenda patsiendi vaevusi, ärge korrake seda. Nõrk positiivne soovitus, väga madal tõendatuse aste |
| 28 |
Terminaalses seisundis patsiendile ei ole verekomponentide ülekanne näidustatud, ka mitte vaevuste leevendamiseks. Praktiline soovitus |
2012. aastal avaldatud Cochrane’i süstemaatilise ülevaate eesmärk oli hinnata verekomponentide ülekannete kasutamist kaugelearenenud vähiga patsientidel
(65). Uurijad ei leidnud ühtegi juhuslikustatud kontrollitud uuringut. Kaasati 12 vaatlusuuringut (kokku 653 osalejat), milles näidati subjektiivset ravivastust 31–70%-l uuritavatest. Viies uuringus hinnati ravivastust väsimuse hindamise skaalade põhjal, mis näitasid kohest verekomponentide ülekande järgset väsimuse vähenemist, mis püsis samal tasemel kuni kaks nädalat. Sarnased tulemused leiti ka õhupuuduse leevenemises. Elumus varieerus 2–293 päevani, kuid kolmandik patsientidest (23–35%) suri kahe nädala jooksul pärast verekomponentide ülekannet. Ülevaate koostajad järeldasid, et seniste vaatlusuuringute põhjal pole võimalik hinnata, kas ja millised elulõpuravil olevad patsiendid võiksid verekomponentide ülekannetest kasu saada. (65)
Retrospektiivses uuringus võrreldi terminaalses seisundis kaugelearenenud vähiga patsiente (kokku 398 uuritavat), kellest osa sai verekomponentide ülekannet ja teised mitte. Täpsemalt uuriti ülekande mõju patsientide elumusele. 90%-l uuritavatest leiti viimasel hospitaliseerimisel aneemia, neist 38% said erütrotsüütide suspensiooni ülekandeid. Elumus oli pikem erütrotsüütide suspensiooni ülekannet saanud uuritavatel (15 päeva vs. 8 päeva), samas viibisid need patsiendid ka pikemalt haiglas (16 päeva vs. 10 päeva). (66) Retrospektiivses uuringus vaadeldi 14 voodikohaga hospiitsi patsiente 54 kuu jooksul, et hinnata verekomponentide ülekannete põhjuseid ning dokumenteeritud tõendusi ravisekkumise kasu ja tulemuslikkuse kohta. Kokku tehti 46 ülekannet 39 patsiendile. Leiti, et verekomponentide ülekannete tegemine ei olnud sage. Põhiline ülekande näidustus oli väsimus, kasu protseduurist dokumenteeriti 39%-l patsientidest ja 50% patsientidest suri nelja nädala jooksul pärast verekomponentide ülekande saamist. Autorid hindasid tulemusi sarnasteks varasemate uuringutega, kus on näidatud elulõpuravis tehtavate verekomponentide ülekannete vähest kasu ja vähest elumust verekomponentide ülekande järel. (67)
Kliinilises praktikas on nähtud väsimuse vähenemist aneemiaga patsientidel, kellele on tehtud erütrotsüütide suspensiooni ülekanne. Kindlasti ei peaks verekomponentide ülekanne olema kasutusel regulaarse ravisekkumisena kõikide aneemiaga patsientide puhul, kuid kokkuleppel patsiendiga, kelle üldseisund on stabiilne, võib seda soovitada. Terminaalses seisundis patsiendile ei ole verekomponentide ülekanne vajalik. Sekkumine võib olla isegi kahjulik, sest on patsiendile koormav ja ka kulude mõttes otstarbetu. Terminaalses seisundis patsiendi puhul ei ole vaja aneemia esinemist hinnata.
(65). Uurijad ei leidnud ühtegi juhuslikustatud kontrollitud uuringut. Kaasati 12 vaatlusuuringut (kokku 653 osalejat), milles näidati subjektiivset ravivastust 31–70%-l uuritavatest. Viies uuringus hinnati ravivastust väsimuse hindamise skaalade põhjal, mis näitasid kohest verekomponentide ülekande järgset väsimuse vähenemist, mis püsis samal tasemel kuni kaks nädalat. Sarnased tulemused leiti ka õhupuuduse leevenemises. Elumus varieerus 2–293 päevani, kuid kolmandik patsientidest (23–35%) suri kahe nädala jooksul pärast verekomponentide ülekannet. Ülevaate koostajad järeldasid, et seniste vaatlusuuringute põhjal pole võimalik hinnata, kas ja millised elulõpuravil olevad patsiendid võiksid verekomponentide ülekannetest kasu saada. (65)
Retrospektiivses uuringus võrreldi terminaalses seisundis kaugelearenenud vähiga patsiente (kokku 398 uuritavat), kellest osa sai verekomponentide ülekannet ja teised mitte. Täpsemalt uuriti ülekande mõju patsientide elumusele. 90%-l uuritavatest leiti viimasel hospitaliseerimisel aneemia, neist 38% said erütrotsüütide suspensiooni ülekandeid. Elumus oli pikem erütrotsüütide suspensiooni ülekannet saanud uuritavatel (15 päeva vs. 8 päeva), samas viibisid need patsiendid ka pikemalt haiglas (16 päeva vs. 10 päeva). (66) Retrospektiivses uuringus vaadeldi 14 voodikohaga hospiitsi patsiente 54 kuu jooksul, et hinnata verekomponentide ülekannete põhjuseid ning dokumenteeritud tõendusi ravisekkumise kasu ja tulemuslikkuse kohta. Kokku tehti 46 ülekannet 39 patsiendile. Leiti, et verekomponentide ülekannete tegemine ei olnud sage. Põhiline ülekande näidustus oli väsimus, kasu protseduurist dokumenteeriti 39%-l patsientidest ja 50% patsientidest suri nelja nädala jooksul pärast verekomponentide ülekande saamist. Autorid hindasid tulemusi sarnasteks varasemate uuringutega, kus on näidatud elulõpuravis tehtavate verekomponentide ülekannete vähest kasu ja vähest elumust verekomponentide ülekande järel. (67)
Kliinilises praktikas on nähtud väsimuse vähenemist aneemiaga patsientidel, kellele on tehtud erütrotsüütide suspensiooni ülekanne. Kindlasti ei peaks verekomponentide ülekanne olema kasutusel regulaarse ravisekkumisena kõikide aneemiaga patsientide puhul, kuid kokkuleppel patsiendiga, kelle üldseisund on stabiilne, võib seda soovitada. Terminaalses seisundis patsiendile ei ole verekomponentide ülekanne vajalik. Sekkumine võib olla isegi kahjulik, sest on patsiendile koormav ja ka kulude mõttes otstarbetu. Terminaalses seisundis patsiendi puhul ei ole vaja aneemia esinemist hinnata.
Toitmisravi ja vedelikravi
Elulõpuravil olevad patsiendid kogevad sageli suukuivust, kuid harva nälga ja janu, seetõttu ei ole alati vaja vedelikku ja toitu manustada. Elu lõpus toitmisravi ja vedelikravi alustades tuleb hinnata suukuivuse võimalikke põhjusi, kaaluda sekkumiste riske ja kasu ning võimaluse korral teha otsused koos patsiendiga. Suukuivus ja janu võivad tekkida ka ravimite kõrvaltoimena, hapnikravi, suu kaudu hingamise või ärevuse ja depressiooni tagajärjel. Harva võib dehüdratsioon põhjustada deliiriumit. Sel juhul võib kaaluda vedelikravi, kuid selle tõhusus on terminaalses seisundis patsiendi puhul küsitav.
| 29 |
Elulõpuravis otsustage toitmisravi ja vedelikravi juhupõhiselt, arvestades patsiendi eeldatavat elupikkust, oodatavat elukvaliteedi paranemist ja tahet. Lõpetage toitmisravi ja vedelikravi, kui sekkumised enam patsiendi enesetunnet ei paranda. Praktiline soovitus |
|
| 30 | |
Terminaalses seisundis patsiendile ei ole toitmisravi ega vedelikravi näidustatud, need võivad halvendada tema seisundit. Praktiline soovitus |
| 31 |
Terminaalses seisundis patsiendi suukuivuse leevendamiseks jätkake suuhoolduse ja väikeste vedelikukoguste andmisega (lonksu kaupa), kui patsient suudab veel ise neelata. Praktiline soovitus |
Süstemaatilises kirjanduse ülevaates, mis hindas vedelikravi ja toitmisravi mõju vähiga patsientide häirivatele sümptomitele elu viimastel päevadel, ei leitud mõju sümptomite leevenemisele ega ka elu pikenemisele (68). Cochrane’i süstemaatilise ülevaate eesmärk oli hinnata vedelikravi mõju palliatiivse ravi patsientide elukvaliteedile ja -pikkusele. Leiti kolm RCT-d ja kolm prospektiivset uuringut, nende kvantitatiivset analüüsi ei olnud võimalik teha. Autorid jõudsid järeldusele, et praegu puudub piisav hea kvaliteediga tõendusmaterjal vedelikravi mõju kohta palliatiivse patsientide ravis ja seetõttu ei ole võimalik selgeid praktilisi soovitusi anda. Ülevaates pöörati tähelepanu ka vedelikraviga seotud riskidele, nagu intravenoosse kanüüli kasutamisega seotud infektsioonioht, liigne vedelikukoormus ja sellest tulenev pleuraefusioon, astsiit ja anasarka ning eelnevast põhjustatud valu, õhupuudus ja füüsilise aktiivsuse vähenemine. Parenteraalne vedelike manustamine ei leevenda ilmtingimata janu. (69)
2014. aastal avaldati Cochrane’i süstemaatiline ülevaade, mille eesmärk oli hinnata toitmisravi mõju palliatiivse ravi patsientide elukvaliteedile ja -pikkusele. Leiti viis teemakohast prospektiivset uuringut (k.a üks kvalitatiivne uuring). Autorite hinnangul ei leidunud piisavalt hea kvaliteediga uuringuid, et anda soovitusi kliinilise praktika jaoks toitmisravi kohta palliatiivse ravi patsientide puhul. Tervishoiutöötajad peavad need otsused tegema patsiendi seisundi ja olukorra põhjal, kaaludes toitmisravi kasu ja kahju. (70) ESPEN-i ravijuhendis on toitmisravi ja vedeliku andmise eetiliste aspektide teemal terminaalses seisundis patsientide kohta öeldud, et otsused tuleb teha individuaalselt (71).
Ka eetilistest küsimustest tingituna ei leidu terminaalses seisundis patsientide vedelik- ja toitmisravi kohta piisavalt hea kvaliteediga tõendusmaterjali (72, 73, 74, 75). NICE-i ravijuhend surija viimaste päevade hoolduse kohta annab soovitusi, kuidas vedeliku tarvitamist säilitada. Soovitatakse toetada patsienti ise joomisel, kui ta seda soovib ja suudab (jälgides võimalikke takistusi) ning tagada sage ja piisav suuhooldus. Võimaluse korral tuleb surija vedelikuga varustatust hinnata iga päev ja kaaluda vajaduse korral vedelikravi alustamist. Vedelikravi alustamine tuleb otsustada juhupõhiselt, arvestades mitmesuguseid tegureid. Muuhulgas tuleb arvestada patsiendi soove ja eelistusi, st kas ta on avaldanud soovi või olnud vastu vedelikravi tegemisele; kas tal on olemas tulevikujuhised, kus vedelikravi kohta on dokumenteeritud soovid; patsiendi teadvuse taset, neelamisraskuste esinemist. Vedelikravi alustamisel tuleb patsienti regulaarselt jälgida ja jätkata sekkumisega, kui see on tulemuslik, või katkestada, kui on näha kahju surijale või patsient seda ise enam ei soovi. Lähedastega tuleb arutada surija vajadusi seoses vedelikutarbimisega (joomisega) ning vedelikravi võimalikku kasu ja riske. Vajaduse korral tuleb õpetada lähedasi surijale ohutult vedelikku andma. (76)
Tegemist on olulise eetilise küsimusega, mis kerkib palliatiivses ravis tihti esile. Patsiendi lähedased võivad tungivalt soovida toitmist ja vedelikravi ka siis, kui patsiendi seisund neid sekkumisi enam ei nõua. Lähedastele selgitamine ja õige info jagamine on väga oluline. Töörühma liikmete kliinilise kogemuse põhjal võib toitmisravi ja/või vedelikravi (10 ml/kg iv, sc 0,9% NaCl) elulõpuravis mõnel juhul patsiendi enesetunnet parandada, kuid otsus tuleb teha juhupõhiselt ja seejuures peab arvestama patsiendi eelistusi. Vedelikravi võib häirivaid sümptomeid vähendada, kuid samas põhjustada patsiendile muid probleeme (nt tursete tekkimine, õhupuudus, astsiit), mistõttu tuleb vedelikravi korral patsienti pidevalt jälgida. Terminaalses seisundis patsientidele ei ole vedelikravi ega toitmisravi vajalikud, need on pigem ebaeetilised sekkumised. Et ennetada
Ka eetilistest küsimustest tingituna ei leidu terminaalses seisundis patsientide vedelik- ja toitmisravi kohta piisavalt hea kvaliteediga tõendusmaterjali (72, 73, 74, 75). NICE-i ravijuhend surija viimaste päevade hoolduse kohta annab soovitusi, kuidas vedeliku tarvitamist säilitada. Soovitatakse toetada patsienti ise joomisel, kui ta seda soovib ja suudab (jälgides võimalikke takistusi) ning tagada sage ja piisav suuhooldus. Võimaluse korral tuleb surija vedelikuga varustatust hinnata iga päev ja kaaluda vajaduse korral vedelikravi alustamist. Vedelikravi alustamine tuleb otsustada juhupõhiselt, arvestades mitmesuguseid tegureid. Muuhulgas tuleb arvestada patsiendi soove ja eelistusi, st kas ta on avaldanud soovi või olnud vastu vedelikravi tegemisele; kas tal on olemas tulevikujuhised, kus vedelikravi kohta on dokumenteeritud soovid; patsiendi teadvuse taset, neelamisraskuste esinemist. Vedelikravi alustamisel tuleb patsienti regulaarselt jälgida ja jätkata sekkumisega, kui see on tulemuslik, või katkestada, kui on näha kahju surijale või patsient seda ise enam ei soovi. Lähedastega tuleb arutada surija vajadusi seoses vedelikutarbimisega (joomisega) ning vedelikravi võimalikku kasu ja riske. Vajaduse korral tuleb õpetada lähedasi surijale ohutult vedelikku andma. (76)
Tegemist on olulise eetilise küsimusega, mis kerkib palliatiivses ravis tihti esile. Patsiendi lähedased võivad tungivalt soovida toitmist ja vedelikravi ka siis, kui patsiendi seisund neid sekkumisi enam ei nõua. Lähedastele selgitamine ja õige info jagamine on väga oluline. Töörühma liikmete kliinilise kogemuse põhjal võib toitmisravi ja/või vedelikravi (10 ml/kg iv, sc 0,9% NaCl) elulõpuravis mõnel juhul patsiendi enesetunnet parandada, kuid otsus tuleb teha juhupõhiselt ja seejuures peab arvestama patsiendi eelistusi. Vedelikravi võib häirivaid sümptomeid vähendada, kuid samas põhjustada patsiendile muid probleeme (nt tursete tekkimine, õhupuudus, astsiit), mistõttu tuleb vedelikravi korral patsienti pidevalt jälgida. Terminaalses seisundis patsientidele ei ole vedelikravi ega toitmisravi vajalikud, need on pigem ebaeetilised sekkumised. Et ennetada
ja leevendada suukuivust, tuleb kindlasti jätkata suuhoolduse ning huulte niisutamisega. Kui patsient suudab neelata, võib talle anda lonksu kaupa vett.
Kui palliatiivse ravi patsient ei saa määratud ravimeid enam manustada (nt neelamis- või teadvushäire korral), tuleb hinnata, kas ravimite manustamise jätkamine on vajalik. Vajaduse korral kaasatakse meeskonda proviisor, kes vaatab raviskeemi üle ja annab soovitused ravimivormide muutmiseks.
Kui palliatiivse ravi patsient ei saa määratud ravimeid enam manustada (nt neelamis- või teadvushäire korral), tuleb hinnata, kas ravimite manustamise jätkamine on vajalik. Vajaduse korral kaasatakse meeskonda proviisor, kes vaatab raviskeemi üle ja annab soovitused ravimivormide muutmiseks.
Õhupuuduse ravi
Elulõpuravi saavatel patsientidel esineb sageli õhupuudust ja see vajab kindlasti leevendust. Süstemaatilises ülevaates, kus hinnati sümptomite esinemist viie eri diagnoosiga elu lõpule lähenevate patsientide seas (pahaloomulised kasvajad, AIDS, südamehaigused, KOK, neeruhaigused) leiti, et õhupuudust esines enam kui 50%-l patsientidest (77). Sõltumata diagnoosist, sageneb õhupuuduse esinemine ja süveneb selle raskus viimastel elukuudel (78, 79).
| 32 |
|
Elulõpuravi saava õhupuudusega patsiendi puhul järgige õhupuuduse ravi soovitusi (vt õhupuuduse käsitluse algoritmi palliatiivse ravi juhendi I osa lisas 2). Praktiline soovitus |
| 33 |
|
Terminaalses seisundis õhupuudusega patsiendi puhul alustage mittefarmakoloogiliste sekkumiste ja/või opioididega ning ärevuse leevendamisega, sest need on tõhusamad sekkumised kui hapnikravi (vt õhupuuduse käsitluse algoritmi palliatiivse ravi juhendi I osa lisas 2). Tugev positiivne soovitus, väga madal tõendatuse aste |
Elulõpuravi saavate patsientide õhupuudus on mitmetahuline probleem ja selle leevendamise meetodid peavad olema individuaalsed (80). Prospektiivses uuringus hinnati hapnikravi ja opioidide mõju ventilatsiooni paranemisele ja õhupuuduse leevenemisele terminaalse vähi või muu terminaalse ravimatu haigusega hüpokseemilistel või mittehüpokseemilistel patsientidel, kellel esines rahulolekus õhupuudus (n = 46). Uuringu tulemuste põhjal on nii hüpokseemiliste kui ka mittehüpokseemiliste patsientide puhul õhupuuduse ravis opioidide kasutamine oluliselt tõhusam kui hapnikravi. Autorite hinnangul tuleb hapnikku kasutada näidustatud ravimina õhupuuduse leevendamiseks, mitte valida seda vaid eeldatava kasu korral. (81) Vaatlusuuringus hinnati hapnikravi kasu elu
lõpule lähenevatel patsientidel (n = 32). Leiti, et enamik patsiente ei saanud hapniku manustamisest kasu. Ei ilmnenud olulisi muutusi patsientide hingamise mugavuses, ka mitte siis, kui muudeti hapniku pealevoolu. Selle põhjal järeldasid autorid, et tegemist on mittevajaliku sekkumisega. (82) NICE-i ravijuhendis soovitatakse terminaalses seisundis patsientide puhul alustada õhupuuduse ravi mittefarmakoloogiliste sekkumiste ja opioidide või bensodiasepiinidega või nende kombineerimisega. Hapnikravi ei soovitata alustada rutiinselt, vaid kasutada seda ainult patsientidel, kel on teadaolevalt või kliiniliselt hinnatuna sümptomaatiline hüpokseemia. (76)
Elulõpuravi saavate patsientide õhupuuduse ravis tuleb järgida üldisi õhupuuduse ravi soovitusi (vt õhupuuduse käsitluse algoritmi palliatiivse ravi juhendi I osa lisas 2). Leitud uuringute tulemused näitavad, et hapnikraviga alustamine ei ole terminaalses seisundis patsientide õhupuuduse vähendamiseks tõhus. Tegemist on nii patsiendi, lähedaste kui ka tervishoiutöötajate jaoks keerulise sümptomiga. Terminaalses seisundis patsiendi õhupuudus vajab kiiret sekkumist vaevuse leevendamiseks ning patsiendi ja lähedaste hirmu vähendamiseks. Kaaludes sekkumistest saadavat kasu, otsustas töörühm vaatamata hea kvaliteediga tõendusmaterjali puudumisele sõnastada tugeva soovituse. Opioidide manustamine ja ärevuse leevendamine koos võimalusel mittefarmakoloogiliste sekkumistega on ka kliinilise kogemuse põhjal tõhusad terminaalses seisundis patsiendi õhupuuduse leevendamiseks.
Palliatiivse ravi vajaduse hindamine
Ravijuhendites on öeldud, et palliatiivse ravi vajaduse esmase hindamise käigus tuleb vestelda patsiendi, lähedaste, raviarsti ja vajaduse korral teiste patsiendi ravi ja hooldusega seotud spetsialistidega (83, 84). Esmane arutelu peab sõltuvalt patsiendi probleemidest toimuma koos interdistsiplinaarse meeskonna ühe või mitme liikmega. Hinnatakse patsiendi seisundit, sümptomite esinemist, raskust ja mõju patsiendi elukvaliteedile ning toimetulekule, haiguse kulgu, ravivõimalusi ja -eesmärke. Patsiendi palliatiivse ravi vajaduse terviklikuks hindamiseks kasutatavad abistavad teemad on toodud lisas 8. Hindamise tulemused dokumenteeritakse ja nende alusel koostatakse koos patsiendi ja võimaluse korral lähedastega palliatiivse ravi plaan.
| 34 |
|
Patsiendi palliatiivse ravi vajaduse terviklikuks käsitluseks hinnake igakordsel kohtumisel patsiendi seisundit ja sümptomeid, patsiendi ja lähedaste psühholoogilisi, sotsiaalseid ja spirituaalseid vajadusi, võimalikke stressiallikaid ning informatsiooni vajadust (vt lisa 8). Praktiline soovitus |
| 35 |
|
Patsiendi palliatiivse ravi vajaduse terviklikuks hindamiseks võite abistava töövahendina kasutada integreeritud palliatiivravi tulemusmõõdikut (ingl Integrated Palliative Care Outcome Scale, IPOS) (vt lisa 9). Nõrk positiivne soovitus, madal tõendatuse aste |
Leidub palju palliatiivse ravi patsientide seisundi, sümptomite ja probleemide hindamise mõõdikuid. Mõõdikud on eri mahuga, hõlmavad mitut valdkonda ja sisaldavad nii sõnalisi kui ka numbrilisi skaalasid. Ühes ravijuhendis ja Euroopa Palliatiivse Ravi Assotsiatsiooni palliatiivse ravi tulemuste hindamist käsitlevas dokumendis soovitatakse palliatiivse ravi vajaduse hindamiseks kasutada valideeritud mõõdikut, kuid ühtegi konkreetset mõõdikut esile ei tooda (83, 85). Mõõdikute kasutamine aitab hinnata patsiendi seisundit ja muutusi, patsiendi ja lähedaste probleeme eri valdkondades, muutusi, koostada palliatiivse ravi plaani ning teha raviotsuseid, samuti võrrelda ravitulemusi ja -kvaliteeti teiste riikidega
(86). Hindamise tulemusi peab kindlasti järjepidevalt dokumenteerima.
Uuringute tulemuste põhjal ei ole võimalik soovitada ühe kindla multidimensioonilise mõõdiku kasutamist. Aslakson jt (2017) esitasid kiirraporti
tulemuste põhjal peamise probleemina selle, et mõõdikud ei sisalda kultuuriga seotud teemasid ja puudus on mõõdikutest, mis hindaksid patsiendi kogemust tema enda vaatenurgast. Samuti tuleb teha rohkem uuringuid mõõdikute kasutamise kohta kliinilises praktikas. Uuringu tulemusena (kokkuvõte tehti varasemas süstemaatilises ülevaates analüüsitud 28 mõõdiku põhjal) leiti, et ükski uuringusse kaasatud mõõdikutest ei olnud adekvaatselt testitud kõikide psühhomeetriliste omaduste osas. (87, 88) Sarnaselt on süstemaatilise ülevaate tulemusena leitud, et mõõdikutes on sageli kaetud füüsilised, psühholoogilised ja sotsiaalsed probleemid, kuid muud palliatiivses ravis olulised aspektid (ravi ja hooldusega seotud kultuurilised aspektid, ravi struktuur, protsess ja järjepidevus) on jäänud tähelepanuta. Seega ei asenda mõõdiku kasutamine kindlasti patsiendi kliinilist hindamist ja vestlust patsiendi/lähedastega. (89)
Eestis on vähene kliiniline kogemus mõõdikute Palliative care Outcome Scale (POS) ja Edmonton Symptom Assessment Scale (ESAS) kasutamisel. Samuti on ESAS skaala kliinilise kogemuse põhjal patsiendi jaoks keeruline täita. Mõne mõõdiku puhul ei ole kasutamise ulatus kliinilises praktikas selge (nt Memorial Symptom Assessment Scale-Short Form, MSAS-SF). Osa mõõdikutest on mahukad ja vajavad täitmiseks/hindamiseks palju aega (nt InterRAI Palliative Care Instrument, InterRAI PC), sisaldavad vaid sümptomeid või on liiga üldised (European Organization for Research and Treatment of Cancer Quality of Life Questionnaire Core 15 Palliative Questionnaire, EORTC QLQ-C15-PAL; Cambridge Palliative Assessment Schedule, CAMPAS-R; NCCN Distress Thermomether and Problem List of Patients).
Mõõdiku Integrated Palliative care Outcome Scale (IPOS) lõi POS-i arendusmeeskond Suurbritannias (https://pos-pal.org/). Mõõdik on arendatud koostöös kasutajatega. IPOS-i koostamisel integreeriti kõige olulisemaid küsimusi mõõdikutest Palliative care Outcome Scale (POS), Palliative care Outcome Sale – Symptoms (POS-S) ja African Palliative Care Association Palliative care Outcome Scale (APCA-POS). IPOS sisaldab küsimusi patsiendi probleemide ja murede esinemise ning psühhosotsiaalsete probleemide kohta, samuti selle kohta, kui palju on sümptomid patsienti häirinud (vt tulemusmõõdiku näidist lisas 9). Mõõdikul on erinevad versioonid, mis võimaldavad hinnata probleemide esinemist viimase kolme päeva või nädala jooksul. Olemas on nii patsiendi kui ka personali versioonid. IPOS on tõlgitud mitmesse keelde (mh saksa, rootsi, kreeka, türgi, prantsuse, tšehhi ja itaalia keelde) ning kultuuriliselt adapteeritud. IPOS-i psühhomeetrilisi omadusi on testitud ja on leitud, et nii patsiendi kui ka personali versioonid annavad kliiniliselt olulisi tulemusi, on hea valiidsuse, reliaabluse
Eestis on vähene kliiniline kogemus mõõdikute Palliative care Outcome Scale (POS) ja Edmonton Symptom Assessment Scale (ESAS) kasutamisel. Samuti on ESAS skaala kliinilise kogemuse põhjal patsiendi jaoks keeruline täita. Mõne mõõdiku puhul ei ole kasutamise ulatus kliinilises praktikas selge (nt Memorial Symptom Assessment Scale-Short Form, MSAS-SF). Osa mõõdikutest on mahukad ja vajavad täitmiseks/hindamiseks palju aega (nt InterRAI Palliative Care Instrument, InterRAI PC), sisaldavad vaid sümptomeid või on liiga üldised (European Organization for Research and Treatment of Cancer Quality of Life Questionnaire Core 15 Palliative Questionnaire, EORTC QLQ-C15-PAL; Cambridge Palliative Assessment Schedule, CAMPAS-R; NCCN Distress Thermomether and Problem List of Patients).
Mõõdiku Integrated Palliative care Outcome Scale (IPOS) lõi POS-i arendusmeeskond Suurbritannias (https://pos-pal.org/). Mõõdik on arendatud koostöös kasutajatega. IPOS-i koostamisel integreeriti kõige olulisemaid küsimusi mõõdikutest Palliative care Outcome Scale (POS), Palliative care Outcome Sale – Symptoms (POS-S) ja African Palliative Care Association Palliative care Outcome Scale (APCA-POS). IPOS sisaldab küsimusi patsiendi probleemide ja murede esinemise ning psühhosotsiaalsete probleemide kohta, samuti selle kohta, kui palju on sümptomid patsienti häirinud (vt tulemusmõõdiku näidist lisas 9). Mõõdikul on erinevad versioonid, mis võimaldavad hinnata probleemide esinemist viimase kolme päeva või nädala jooksul. Olemas on nii patsiendi kui ka personali versioonid. IPOS on tõlgitud mitmesse keelde (mh saksa, rootsi, kreeka, türgi, prantsuse, tšehhi ja itaalia keelde) ning kultuuriliselt adapteeritud. IPOS-i psühhomeetrilisi omadusi on testitud ja on leitud, et nii patsiendi kui ka personali versioonid annavad kliiniliselt olulisi tulemusi, on hea valiidsuse, reliaabluse
ning tundlikkusega. Peale pahaloomulise kasvajaga patsientide oli valimis mitteonkoloogiliste haigustega patsiente (15% valimist) (90). On leitud, et ka teistesse keeltesse tõlgitud mõõdiku versioonid on valiidsed ja usaldusväärsed. Portugalikeelset versiooni on testitud nii pahaloomulise kasvajaga kui ka vähesel määral muu haigusega patsientide seas, jaapanikeelset versiooni on testitud pahaloomulise kasvajaga patsientide seas (91, 92). Tšehhikeelne versioon on hea usaldusväärsusega, kuid vajab veel lisauuringuid sisulise valiidsuse testimiseks (93).
M. Laissaar on magistritöö raames tõlkinud IPOS-e eesti keelde (neli versiooni), kohandanud kultuuriliselt Eestis kasutamiseks ning testinud mõõdiku sisu- ja näivvaliidsust (94). Mõõdik tõlgiti ja valideeriti koostöös Tallinna Tehnikaülikooli, SA Põhja-Eesti Regionaalhaigla ja SA Tartu Ülikooli Kliinikumiga. Nii tervishoiutöötajate kui ka patsientide hinnangul on tegemist sobiliku mõõdikuga. Mõõdiku kasutamiseks on olemas autorite luba. Mõõdiku eestikeelne versioon vajab edaspidi psühhomeetrilist testimist, kuid on praegu võimalik võtta kasutusele kliinilises praktikas. Kuna tegemist on lühikese, lihtsalt täidetava ja ülevaatliku mõõdikuga, soovitab ravijuhendi töörühm kasutada mõõdikut abistava vahendina patsiendi palliatiivse ravi vajaduse terviklikul hindamisel. Mõõdiku kasutamine ei saa olla ainus patsiendi hindamise meetod. Tuleb koguda anamneesi, tutvuda varasema haiguslooga, hinnata objektiivselt patsiendi seisundit, arvestada kaasuvate haigustega ja vestelda patsiendi ning lähedastega. Patsiendi vajadused ja probleemid võivad muutuda ning vajada kiiret reageerimist. Samas võib mõõdik aidata palliatiivse ravi osutajal pöörata tähelepanu vajalikele aspektidele, eriti juhul, kui kogemust valdkonnas on veel vähe. Töörühm koostab soovituse selle kohta, millele tuleb pöörata tähelepanu patsiendi igakordsel hindamisel, samuti koostatakse abistavad küsimused (vt lisa 8).
Patsiendi hindamisele peab järgnema palliatiivse ravi plaani koostamine. Palliatiivse ravi plaani koostab vajaduse korral kõikidel teenuse osutamise tasanditel sel ajal patsiendiga tegelev arst või eriti komplitseeritud juhtudel palliatiivse ravi meeskond. Palliatiivse ravi plaan peab olema dokumentatsiooni (epikriisi) osa. Haigusspetsiifilise ravi lõpetamise otsus peab olema palliatiivse ravi plaanis selgelt dokumenteeritud. Parimate ravitulemuste jaoks tuleb terviklikult arvestada haigestumise ja raviga kaasnevaid aspekte, kaasata patsient ja lähedased ning arvestada nende väärtuste, ootuste, murede ja soovidega palliatiivse ravi otsuste tegemisel, samuti tagada palliatiivse ravi teenuste kättesaadavus. Viimane eeldab, et alati on võimalus konsulteerida spetsialiseeritud palliatiivse ravi meeskonnaga või suunata patsient teistel tasanditel osutatavatele teenustelele.
M. Laissaar on magistritöö raames tõlkinud IPOS-e eesti keelde (neli versiooni), kohandanud kultuuriliselt Eestis kasutamiseks ning testinud mõõdiku sisu- ja näivvaliidsust (94). Mõõdik tõlgiti ja valideeriti koostöös Tallinna Tehnikaülikooli, SA Põhja-Eesti Regionaalhaigla ja SA Tartu Ülikooli Kliinikumiga. Nii tervishoiutöötajate kui ka patsientide hinnangul on tegemist sobiliku mõõdikuga. Mõõdiku kasutamiseks on olemas autorite luba. Mõõdiku eestikeelne versioon vajab edaspidi psühhomeetrilist testimist, kuid on praegu võimalik võtta kasutusele kliinilises praktikas. Kuna tegemist on lühikese, lihtsalt täidetava ja ülevaatliku mõõdikuga, soovitab ravijuhendi töörühm kasutada mõõdikut abistava vahendina patsiendi palliatiivse ravi vajaduse terviklikul hindamisel. Mõõdiku kasutamine ei saa olla ainus patsiendi hindamise meetod. Tuleb koguda anamneesi, tutvuda varasema haiguslooga, hinnata objektiivselt patsiendi seisundit, arvestada kaasuvate haigustega ja vestelda patsiendi ning lähedastega. Patsiendi vajadused ja probleemid võivad muutuda ning vajada kiiret reageerimist. Samas võib mõõdik aidata palliatiivse ravi osutajal pöörata tähelepanu vajalikele aspektidele, eriti juhul, kui kogemust valdkonnas on veel vähe. Töörühm koostab soovituse selle kohta, millele tuleb pöörata tähelepanu patsiendi igakordsel hindamisel, samuti koostatakse abistavad küsimused (vt lisa 8).
Patsiendi hindamisele peab järgnema palliatiivse ravi plaani koostamine. Palliatiivse ravi plaani koostab vajaduse korral kõikidel teenuse osutamise tasanditel sel ajal patsiendiga tegelev arst või eriti komplitseeritud juhtudel palliatiivse ravi meeskond. Palliatiivse ravi plaan peab olema dokumentatsiooni (epikriisi) osa. Haigusspetsiifilise ravi lõpetamise otsus peab olema palliatiivse ravi plaanis selgelt dokumenteeritud. Parimate ravitulemuste jaoks tuleb terviklikult arvestada haigestumise ja raviga kaasnevaid aspekte, kaasata patsient ja lähedased ning arvestada nende väärtuste, ootuste, murede ja soovidega palliatiivse ravi otsuste tegemisel, samuti tagada palliatiivse ravi teenuste kättesaadavus. Viimane eeldab, et alati on võimalus konsulteerida spetsialiseeritud palliatiivse ravi meeskonnaga või suunata patsient teistel tasanditel osutatavatele teenustelele.
Perearstil või õendusabiteenuse osutajal peab olema võimalus pöörduda oma piirkonna juhtumikorraldaja poole patsiendile ja vajaduse korral lähedastele vajaliku teenuse leidmiseks, kui esimese tasandi võimalused on ammendunud. Palliatiivse ravi võrgustikus peavad konsultatsiooni saamiseks olema kättesaadavad kõik vajalikud kontaktid (nii tervishoiuteenused, psühholoogiline nõustamine, hingehoid kui ka sotsiaalteenuste osutajad). Praegu on palliatiivse ravi süsteemi loomise peamine takistus see, et puudub järjepidevus patsiendi liikumisel ühelt tervishoiusüsteemi tasandilt teisele. See viib aga sageli liigse erakorralise meditsiini osakondade ja kiirabi kasutamiseni.
Palliatiivse ravi plaan on aluseks raviotsuste tegemisel, seda hinnatakse ja muudetakse olenevalt patsiendi ja lähedaste vajaduste muutumisest kogu raviteekonna kestel, kaasa arvatud elulõpuravis. Patsiendil ja lähedastel peab olema informatsioon (kontaktid), kelle poole pöörduda. Kui ei ole teisiti kokku lepitud, tuleb erakorraliste olukordade puhul helistada perearsti nõuandetelefonile või kutsuda kiirabi.
Individuaalse palliatiivse ravi plaani koostamine hõlmab:
- regulaarset ravieesmärkide hindamist;
- ravivõimaluste selgitamist;
- patsiendi ja lähedaste informeerimist;
- sümptomite leevendamise võimalusi;
- raviskeemi koostamist koos ravimiannuste, manustamiskordade ja juhistega;
- psühhosotsiaalset abi / nõustamist;
- vajalike teenuste koordineerimist;
- regulaarset ravitulemuste hindamist;
- raviplaani regulaarset ülevaatamist ja muutmist olenevalt patsiendi ja lähedaste vajadustest;
- meeskonna tegevuse ja otsuste dokumenteerimist, kommunikatsiooni teiste tasandite spetsialistidega (83, 84).
Palliatiivse ravi korraldus, meeskond ja koolitus
Palliatiivse ravi korraldus
| 36 |
|
Palliatiivse ravi korraldamiseks ja järjepidevuse tagamiseks soovitame Eestis kasutusele võtta palliatiivse ravi teenuste kolmetasandilise korralduse:
Praktiline soovitus
|
| 37 |
|
Palliatiivse ravi patsiendi liikumine palliatiivse ravi teenuste tasandite vahel sõltub patsiendi sümptomite ja seisundi raskusest, patsiendi ja lähedaste probleemidest ja vajadustest, palliatiivse ravi plaanist, teenuste olemasolust tasandil ja nende osutamise võimekusest. Praktiline soovitus |
Palliatiivset ravi vajavate patsientide vajadused võivad üksteisest palju erineda ja seepärast tuleb kindlustada palliatiivse ravi teenuste osutamine igal tervishoiusüsteemi tasandil (vt joonis 2).
Palliatiivse ravi teenused hõlmavad teenuseid kodus, perearstikeskuses, eriarstiabis, haiglas (palliatiivse ravi meeskonna poolt), aktiivse palliatiivse ravi osakondi, hospiitsi ja palliatiivset päevaravi. Nii praegu kui ka tulevikus osutatakse suurem osa palliatiivsest ravist mittespetsialiseeritud teenustena perearstiabis ja õendusabis. Kindlasti peab nendel tervishoiutöötajatel olema vajaduse korral võimalus konsulteerida palliatiivse ravi spetsialistiga (interdistsiplinaarse palliatiivse ravi meeskonnaga). Selleks on vaja luua palliatiivse ravi võrgustik, mis ühendab ja koordineerib asutusi ja teenuseid ning parandab palliatiivse ravi kättesaadavust, ravikvaliteeti ja järjepidevust.
Palliatiivse ravi võrgustikus on
Palliatiivse ravi teenused hõlmavad teenuseid kodus, perearstikeskuses, eriarstiabis, haiglas (palliatiivse ravi meeskonna poolt), aktiivse palliatiivse ravi osakondi, hospiitsi ja palliatiivset päevaravi. Nii praegu kui ka tulevikus osutatakse suurem osa palliatiivsest ravist mittespetsialiseeritud teenustena perearstiabis ja õendusabis. Kindlasti peab nendel tervishoiutöötajatel olema vajaduse korral võimalus konsulteerida palliatiivse ravi spetsialistiga (interdistsiplinaarse palliatiivse ravi meeskonnaga). Selleks on vaja luua palliatiivse ravi võrgustik, mis ühendab ja koordineerib asutusi ja teenuseid ning parandab palliatiivse ravi kättesaadavust, ravikvaliteeti ja järjepidevust.
Palliatiivse ravi võrgustikus on
- kokku lepitud palliatiivse ravi teenuse eesmärgid ja kvaliteedistandardid;
- ühtsed palliatiivse ravi teenusele suunamise ja teenuselt lahkumise tingimused kõikidel tasanditel (teenuste koordineerimine);
- ühised hindamismeetodid;
- ühised tõenduspõhised ravistrateegiad (95)
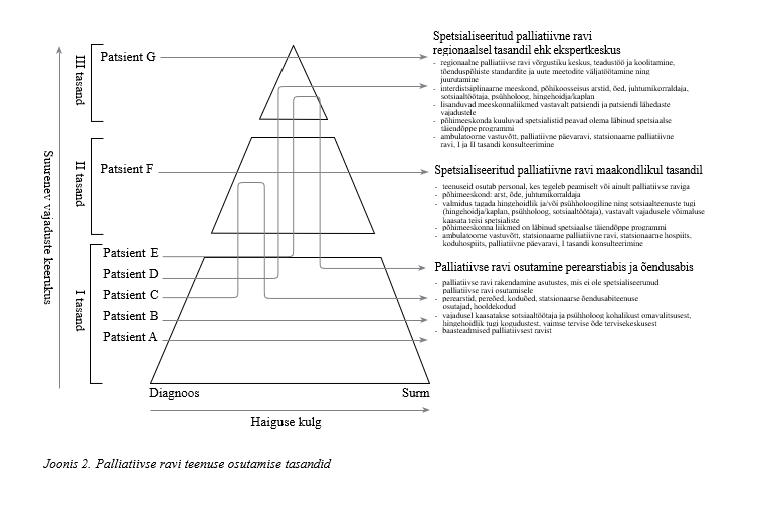
Uuringutes on leitud, et palliatiivse ravi teenused on tõhusad, parandavad sümptomkontrolli ja patsiendi elukvaliteeti, vähendavad hospitaliseerimise vajadust, suurendavad lähedaste rahulolu teenusega ning vähendavad tervishoiukulusid (96, 97, 98, 99, 100). EAPC dokumendis on palliatiivsele ravile ja hospiitsile seatud standardite ning normide kohta märgitud, et palliatiivset ravi saab osutada mitmel tervishoiutasandil, kuid seda tuleb osutada vähemalt kahel tasandil: esmane palliatiivne ravi (ingl palliative care approach) ja spetsialiseeritud palliatiivne ravi (ingl specialist palliative care). Esmast palliatiivset ravi rakendatakse asutustes ja teenustel, kus ravitakse aeg- ajalt palliatiivse ravi patsiente. Spetsialiseeritud palliatiivne ravi vajab piisavalt koolitatud arstide, õdede, sotsiaaltöötajate, hingehoidjate/kaplanite ja teiste ekspertide meeskonda, et tagada elu ohustava või kurnava kroonilise haigusega patsiendi elukvaliteet. (1) Ka Euroopa Komisjoni soovituste kohaselt peab tegema vahet mittespetsialiseeritud ja spetsialiseeritud palliatiivse ravi teenuste vahel. Mittespetsialiseeritud teenustel osutatakse palliatiivset ravi paralleelselt muude teenustega, see ei ole teenuseosutajate peamine valdkond (nt perearstid, koduõed, iseseisev statsionaarne õendusabi). Sageli osutavad palliatiivset ravi just need spetsialistid. Spetsialiseeritud palliatiivse ravi teenuseid osutab selleks koolitatud meeskond, kelle peamine tegevusvaldkond ongi palliatiivne ravi. Nende ülesanne on toetada ja aidata esmaseid palliatiivse ravi teenuse osutajaid ning tegeleda keerulisemate seisundite ja sümptomitega patsientidega. Nende juurde peab olema alati võimalik patsiente suunata. (95) Ka teiste riikide ravijuhendites ja palliatiivse ravi korralduslikes juhendites on esitatud astmeline palliatiivse ravi korraldus (101). Toetudes mitmele dokumendile, koostas ravijuhendi töörühm soovitused koos tegevuste ja vajalike ressursside kirjeldusega palliatiivse ravi teenuste süsteemi arendamiseks Eestis.
I tasand. Perearstiabis ja õendusabis osutatav palliatiivne ravi
I tasand on palliatiivse ravi meetodite ja sekkumiste rakendamine asutustes, mis ei ole spetsialiseerunud palliatiivse ravi osutamisele (esmane palliatiivne ravi). See sisaldab lisaks sümptomite raviks kasutatavatele mittefarmakoloogilistele ja farmakoloogilistele sekkumistele suhtlemist patsiendi ja lähedastega ning teiste tervishoiutöötajatega, samuti otsuste tegemist ja eesmärkide seadmist palliatiivse ravi põhimõtete järgi.
Tegevused
- sümptomite ja seisundi esmane hindamine, sümptomaatiline ravi
- füüsiliste, psühholoogiliste, sotsiaalsete ja spirituaalsete probleemide märkamine, hindamine ning nendega võimaluse korral tegelemine
- vajaduse korral palliatiivse ravi plaani koostamine ja/või plaani rakendamine
- suhtlemine patsiendi ja lähedastega, informatsiooni jagamine
- patsiendi ja lähedaste toimetuleku toetamine, sotsiaalsete probleemide korral edasi suunamine
- vajaduse korral maakondliku palliatiivse ravi meeskonna või ekspertkeskuse (regionaalse tasandi spetsialiseeritud palliatiivne ravi) konsultatsioon ja/või patsiendi ja lähedaste suunamine spetsialiseeritud palliatiivse ravi teenusele
Vajalikud ressursid, teenuseosutajad
- perearstid, pereõed, koduõed (vastavalt oma pädevusele ja teenuse osutamise tingimustele), statsionaarse õendusabiteenuse osutajad, hooldekodud, kelle peamine tegevusvaldkond ei ole palliatiivne ravi
- teenuseosutajatel peavad olema põhiteadmised palliatiivsest ravist (omandatud põhiõppes)
- ei ole vajalik palliatiivse ravi meeskonna loomine
- ei vaja eraldi struktuuri ega ressursse
- vajaduse korral tuleb kaasata sotsiaaltöötaja ja psühholoog kohalikust omavalitsusest, hingehoidlik tugi kogudustest, vaimse tervise õde tervisekeskusest
IItasand. Maakondlikul tasandil osutatav spetsialiseeritud palliatiivne ravi
Osal elu ohustava haigusega patsientidest võib esineda episoodiline valu, muude sümptomite süvenemine või keerulised psühhosotsiaalsed probleemid. Neil võivad ajutiselt tekkida suuremad vajadused, mis nõuavad spetsialiseeritud palliatiivse ravi meeskonna teenuseid ja/või konsultatsiooni.
Tegevused
- füüsiliste, psühholoogiliste, sotsiaalsete ja spirituaalsete probleemide esinemise hindamine ja nendega tegelemine
- palliatiivse ravi plaani koostamine ja rakendamine, ravi koordineerimine
- patsiendi ja lähedaste toimetulekut oluliselt halvendava sotsiaalse või emotsionaalne stressi, sotsiaalsete probleemidega tegelemine
- patsiendi ja lähedaste ajutiselt suurenenud vajaduste lahendamine, mis nõuavad spetsialiseeritud palliatiivse ravi teenuseid ning mida ei osutata perearsti- ja õendusabis
- psühhosotsiaalne nõustamine, hingehoidlik abi patsiendile ja lähedastele, leinanõustamine
- vajaduse korral konsulteerimine regionaalsel tasandil osutatava spetsialiseeritud palliatiivse ravi spetsialistiga ja/või patsiendi suunamine regionaalsele tasandile
- perearsti- ja tervisekeskuste, iseseisva statsionaarse õendusabi osakondade, hooldekodude, samuti vajaduse korral maakonna teiste erialaspetsialistide konsulteerimine palliatiivse ravi osutamisel
Vajalikud ressursid, teenuseosutajad
- palliatiivse ravi põhimeeskonda kuuluvad arst, õde ja juhtumikorraldaja, samuti on valmidus tagada hingehoidlik ja/või psühholoogiline ning sotsiaalteenuste tugi (hingehoidja/kaplan, psühholoog, sotsiaaltöötaja), vajaduse korral kaasatakse võimalusel teisi spetsialiste
- teenuseid osutab personal, kes tegeleb peamiselt või ainult spetsialiseeritud palliatiivse ravi osutamisega
- teenuseosutajad (arst, õde ja juhtumikorraldaja) on läbinud spetsiaalse täiendõppeprogrammi ja neil on palliatiivse ravi kogemus
- teenust osutatakse üldhaiglates, keskhaiglates, elulõpuravi hospiitsides
- teenused: palliatiivse ravi meeskonna ambulatoorne vastuvõtt, statsionaarse palliatiivse ravi voodipäeva teenus, statsionaarse hospiitsi voodipäeva teenus, koduse palliatiivse ravi teenus, palliatiivne päevaravi
IIItasand. Regionaalsel tasandil osutatav spetsialiseeritud palliatiivne ravi ehk ekspertkeskused
Ekspertide hinnangul peab spetsialiseeritud palliatiivse ravi üksus olema regionaalse palliatiivse ravi võrgustiku keskus (1, 95, 102). Palliatiivse ravi teenuste osutamine teistes asutustes, k.a üldhaiglates ja kogukondades, põhineb sellel üksusel või peavad asutusel olema ametlikud kokkulepped selle üksusega. Selline keskus kindlustab meeskondade toetuse ja jätkuva koolitamise ning parandab ravi järjepidevust (95, 102).
Tegevused
- sümptomite ja seisundi hindamine, kiirelt muutuvaid ja keerulisi sümptomeid leevendavad sekkumised, ravi
- palliatiivse ravi plaani koostamine, rakendamine, patsiendi liikumise koordineerimine
- keeruliste füüsiliste, sotsiaalsete, psühholoogiliste ja/või spirituaalsete probleemidega patsientide ja lähedastega tegelemine, mis vajab interdistsiplinaarse meeskonna sekkumist
- patsiendi ja lähedaste informeerimine
- psühholoogiline, hingehoidlik abi patsiendile ja lähedastele
- teiste tasandite konsulteerimine
- teadustöö ja koolitamine palliatiivse ravi teemal
- tõenduspõhiste standardite ja uute meetodite väljatöötamine ja juurutamine
Vajalikud ressursid, teenuseosutajad
- interdistsiplinaarne meeskond, mille põhikoosseisus on palliatiivse ravi spetsialiseeritud täiendkoolitusega arstid, õed, juhtumikorraldaja, sotsiaaltöötaja, psühholoog, hingehoidja/kaplan (interdistsiplinaarse meeskonna liikmete rollid, v.a arst ja õde, on lisas 10). Lisanduvad meeskonnaliikmed olenevalt patsiendi ja patsiendi lähedaste vajadustest: toitumisnõustaja, füsioterapeut, tegevusterapeut, logopeed, kogemusnõustaja, haavaõde, stoomiõde, diabeediõde jne (täis- või osatööajaga)
- meeskonda kuuluvad spetsialistid peavad olema läbinud spetsiaalse täiendõppeprogrammi ja neil peab olema kogemus palliatiivses ravis
- konsultatsiooniteenus on kättesaadav ööpäev läbi seitse päeva nädalas
- teenust osutatakse regionaalhaiglates spetsialiseeritud palliatiivne ravi üksustes
- teenused:
- interdistsiplinaarse palliatiivse ravi meeskonna ambulatoorne teenus
- palliatiivse päevaravi teenus (sümptomaatiline ravi, nõustamine, protseduurid, infusioonid, väikesed protseduurid, nt astsiidi punktsioon; kestus maksimaalselt kuus tundi päevas)
- statsionaarse palliatiivse ravi voodipäeva teenus, sümptomaatilise ravi tõhustamine, et patsient saaks pöörduda tagasi koju või õendusabiteenusele
EAPC dokumendi hinnangul on miljoni inimese kohta vaja 80–100 palliatiivse ravi ja hospiitsi voodikohta. Osakonna optimaalne suurus on 8–12 voodikohta.
(103) Euroopa Komisjoni soovituste kohaselt tuleb voodikohtade arvu määramisel siiski arvestada piirkonna demograafilist sotsiaalmajanduslikku konteksti ja muu eriala voodikohtade ja palliatiivse ravi teenuste (nt õendusabi, kodune palliatiivne ravi) olemasolu (95).
(103) Euroopa Komisjoni soovituste kohaselt tuleb voodikohtade arvu määramisel siiski arvestada piirkonna demograafilist sotsiaalmajanduslikku konteksti ja muu eriala voodikohtade ja palliatiivse ravi teenuste (nt õendusabi, kodune palliatiivne ravi) olemasolu (95).
Interdistsiplinaarne meeskond
| 38 |
|
Palliatiivne ravi on interdistsiplinaarne meeskonnatöö, mis lähtub patsiendi ja lähedaste vajadustest. Palliatiivse ravi põhimeeskonda peavad kuuluma arst, õde, sotsiaaltöötaja, hingehoidja/kaplan ja/või psühholoog ning juhtumikorraldaja. Tugev soovitus, mõõdukas tõendatuse aste |
Tõendusmaterjal põhineb peamiselt „National Consensus Project Clinical Practice Guidelines for Quality Palliative Care 2018“ aluseks oleval süstemaatilisel ülevaatel, kuhu on kaasatud 139 süstemaatilist ülevaadet ja lisaotsinguga leitud üks uuem ülevaade. Uuringutes olid esindatud eri koosseisuga ja eri teenuseid/ võimalusi pakkuvad meeskonnad, osalesid nii kasvajaga kui ka mittemaliigse haigusega patsiendid.
Seitsme süstemaatilise ülevaate kokkuvõttes leiti, et interdistsiplinaarsel lähenemisel on vähene positiivne mõju patsiendi elukvaliteedile, enam mõjutas see väljendunud kasvajaga patsiente (104). Ühes ülevaates leiti, et elukvaliteeti mõjutas enim meeskonna koosseis, niisiis on oluline mitme eriala esindatus
(105). Samale järeldusele jõudsid ka Bajwah jt oma 2020. aasta ülevaates (106).
Palliatiivse ravi meeskonna kaasamine parandab sümptomaatilise ravi kvaliteeti, suurendab patsiendi heaolu ja vähendab füüsiliste sümptomite avaldumist (104, 106). Uuringutes on hinnatud ka palliatiivse ravi meeskonna mõju psüühilistele sümptomitele. Enamasti on märgitud, et meeskonna kaasamine, toimetulekuoskuste õpetamine ja juhtumipõhine lähenemine vähendavad patsientide depressiooni ja ärevust. Palliatiivse ravi meeskondade kaasamine suurendab tõenäosust, et patsiendid surevad kodus. (104, 106) Mõju lähedaste/ hooldajate rahulolule ja koormusele ei ole selge. Uuringute tulemused on vasturääkivad, kuid lähedaste depressioon vähenes, kui meeskonna osalusel pakuti nõustamist, oskuste treenimist ja/või teraapiat (104).
Kahes ülevaates hinnati ainult koduse palliatiivse ravi tõhusust. Leiti, et mõju füüsiliste sümptomite avaldumisele, elukvaliteedile ja patsiendi rahulolule oli vastukäiv. Meeskonna kaasamine suurendas tõenäosust, et patsient sureb kodus. (104) Neli süstemaatilist ülevaadet hindasid palliatiivse ravi meeskonna mõju tulevikujuhiste koostamisele ja raviotsuste tegemisele haiglas olevate patsientide (nii aktiivravil, EMO-sse saabunud kui ka nt õendushaiglas viibivad patsiendid) poolt. Leiti, et meeskonna kaasamisel suureneb tõenäosus
Seitsme süstemaatilise ülevaate kokkuvõttes leiti, et interdistsiplinaarsel lähenemisel on vähene positiivne mõju patsiendi elukvaliteedile, enam mõjutas see väljendunud kasvajaga patsiente (104). Ühes ülevaates leiti, et elukvaliteeti mõjutas enim meeskonna koosseis, niisiis on oluline mitme eriala esindatus
(105). Samale järeldusele jõudsid ka Bajwah jt oma 2020. aasta ülevaates (106).
Palliatiivse ravi meeskonna kaasamine parandab sümptomaatilise ravi kvaliteeti, suurendab patsiendi heaolu ja vähendab füüsiliste sümptomite avaldumist (104, 106). Uuringutes on hinnatud ka palliatiivse ravi meeskonna mõju psüühilistele sümptomitele. Enamasti on märgitud, et meeskonna kaasamine, toimetulekuoskuste õpetamine ja juhtumipõhine lähenemine vähendavad patsientide depressiooni ja ärevust. Palliatiivse ravi meeskondade kaasamine suurendab tõenäosust, et patsiendid surevad kodus. (104, 106) Mõju lähedaste/ hooldajate rahulolule ja koormusele ei ole selge. Uuringute tulemused on vasturääkivad, kuid lähedaste depressioon vähenes, kui meeskonna osalusel pakuti nõustamist, oskuste treenimist ja/või teraapiat (104).
Kahes ülevaates hinnati ainult koduse palliatiivse ravi tõhusust. Leiti, et mõju füüsiliste sümptomite avaldumisele, elukvaliteedile ja patsiendi rahulolule oli vastukäiv. Meeskonna kaasamine suurendas tõenäosust, et patsient sureb kodus. (104) Neli süstemaatilist ülevaadet hindasid palliatiivse ravi meeskonna mõju tulevikujuhiste koostamisele ja raviotsuste tegemisele haiglas olevate patsientide (nii aktiivravil, EMO-sse saabunud kui ka nt õendushaiglas viibivad patsiendid) poolt. Leiti, et meeskonna kaasamisel suureneb tõenäosus
tulevikujuhiste vormistamiseks; südamepuudulikkusega patsientide puhul paranes dokumentatsiooni täitmine (elulõpuravi otsused, mitteelustamise otsused jne); paranes teadlikkus haigusest ja prognoosist, suurenes opioidide kasutus ja muutusid raviotsused. (107) Fieldi jt (2014) koostatud ülevaates märgiti, et meeskonna kaasamine käsitlusse patsiendi haiglasse sattumisel ja/või seisundi muutumisel suurendas edasiste raviotsuste tegemist või ümbervaatamist (108).
Uuritud on ka palliatiivse ravi meeskonna kaasamist intensiivravi osakonnas. Suremuse suhtes vahet ei leitud. Meeskonna kaasamine ei suurendanud lähedaste rahulolu, aga erimeelsused tervishoiutöötajate ja lähedaste vahel raviotsuste tegemisel vähenesid olulisel määral. Samuti vähendas meeskonna kaasamine olulisel määral lähedaste ärevust ja posttraumaatilist stressihäiret. (109, 110)
Kahes süstemaatilises ülevaates hinnati juhtumikorraldaja (ingl case management; case coordinator) mõju. Tulemused on heterogeensed, konkreetsed viisid juhtumi käsitlemisel olid erinevad. Gorini jt ülevaatesse kaasati ainult kasvajaga patsiendid ja leiti, et 81%-l kaasatud uuringutes (kokku 57 uuringut) oli juhtumikorraldaja kaasamisel positiivne mõju patsiendi tulemusnäitajatele, elukvaliteedile mõju ei leitud. Leiti ka, et juhtumikorralduse juurutamine parandas üldiselt patsientide eest hoolitsemise protsessi. Uuringutes hinnati ka mõju ravi agressiivsusele (nt keemiaravi 60 päeva enne surma), tulemused on vastukäivad. Leiti, et juhtumikorraldus parandas ressursside kasutamist kõikidel tasanditel (esmatasandil, hospiitsis, aktiivravis, EMO-s ja intensiivravis). (111) Thomasi jt ülevaatesse kaasati elu lõpus olevad patsiendid sõltumata nende haigusest. Autorid järeldasid, et juhtumikorraldus võib elulõpuravis suurendada patsientide ja nende omaste rahuolu, parandada elukvaliteeti ning vähendada sümptomite koormust ja hospitaliseerimiste arvu. (112)
Juhtumikorraldaja saab tagada patsiendile ja lähedastele õigel ajal õiged teenused, samuti olla ühenduslüliks teenuste ja teenuse osutamise tasandite vahel. Juhtumikorraldaja toetub oma tegevuses palliatiivse ravi plaanile ja seal määratud eesmärkidele. Juhtumikorraldaja peab vajaduse korral olema ka ühendav meeskonnaliige patsiendi ja lähedaste ning interdistsiplinaarse meeskonna vahel, et tagada suhtlemise, informeerimise ja teenuste osutamise järjepidevus.
Uuritud on ka palliatiivse ravi meeskonna kaasamist intensiivravi osakonnas. Suremuse suhtes vahet ei leitud. Meeskonna kaasamine ei suurendanud lähedaste rahulolu, aga erimeelsused tervishoiutöötajate ja lähedaste vahel raviotsuste tegemisel vähenesid olulisel määral. Samuti vähendas meeskonna kaasamine olulisel määral lähedaste ärevust ja posttraumaatilist stressihäiret. (109, 110)
Kahes süstemaatilises ülevaates hinnati juhtumikorraldaja (ingl case management; case coordinator) mõju. Tulemused on heterogeensed, konkreetsed viisid juhtumi käsitlemisel olid erinevad. Gorini jt ülevaatesse kaasati ainult kasvajaga patsiendid ja leiti, et 81%-l kaasatud uuringutes (kokku 57 uuringut) oli juhtumikorraldaja kaasamisel positiivne mõju patsiendi tulemusnäitajatele, elukvaliteedile mõju ei leitud. Leiti ka, et juhtumikorralduse juurutamine parandas üldiselt patsientide eest hoolitsemise protsessi. Uuringutes hinnati ka mõju ravi agressiivsusele (nt keemiaravi 60 päeva enne surma), tulemused on vastukäivad. Leiti, et juhtumikorraldus parandas ressursside kasutamist kõikidel tasanditel (esmatasandil, hospiitsis, aktiivravis, EMO-s ja intensiivravis). (111) Thomasi jt ülevaatesse kaasati elu lõpus olevad patsiendid sõltumata nende haigusest. Autorid järeldasid, et juhtumikorraldus võib elulõpuravis suurendada patsientide ja nende omaste rahuolu, parandada elukvaliteeti ning vähendada sümptomite koormust ja hospitaliseerimiste arvu. (112)
Juhtumikorraldaja saab tagada patsiendile ja lähedastele õigel ajal õiged teenused, samuti olla ühenduslüliks teenuste ja teenuse osutamise tasandite vahel. Juhtumikorraldaja toetub oma tegevuses palliatiivse ravi plaanile ja seal määratud eesmärkidele. Juhtumikorraldaja peab vajaduse korral olema ka ühendav meeskonnaliige patsiendi ja lähedaste ning interdistsiplinaarse meeskonna vahel, et tagada suhtlemise, informeerimise ja teenuste osutamise järjepidevus.
Palliatiivse ravi teenuse osutajate koolitus
| 39 |
Arsti- ja õe põhiõppes soovitame suurendada palliatiivse ravi põhikoolituse mahtu. Töötavatele tervishoiutöötajatele soovitame tagada täiendkoolitused. Praktiline soovitus |
|
| 40 | |
Spetsialiseeritud palliatiivse ravi teenuse osutajad peavad läbima palliatiivse ravi täiendkoolituse. Praktiline soovitus |
Arstide palliatiivse ravi erialase spetsialiseerumise puudumine, vähestes arstide ja õdede õppeprogrammides palliatiivse ravi valdkonna kaasamine ja palliatiivse ravi professorite vähesus on enim esile toodud probleemid palliatiivse ravi koolituses (113, 114). Kogu Euroopas on umbes pooltes riikides olemas ametlik palliatiivse ravi arstide akrediteerimise protsess (3).
Palliatiivse ravi põhiteadmised peavad olema enam integreeritud arstide ja õdede põhiõppes. Need sisaldavad teadmisi ja oskusi palliatiivse ravi põhimõtetest, valu ja muude sümptomite hindamisest ja ravist, psühhosotsiaalsetest ja õiguslikest aspektidest, suhtlemisest, eneserefleksioonist. Praegu on Eestis arstide põhiõppes kohustuslikud kursused: kolmandal kursusel kolm akadeemilist tundi (suhtlemine) ja viiendal kursusel seitse akadeemilist tundi (põhimõtted, korraldus, vaevuse ravi põhimõtted). Peremeditsiini residentidele on kohustuslik koolitus vaevuste ravi põhimõtetest (kaheksa akadeemilist tundi). Lisaks on arsti põhiõppe tudengitele olemas valikaine (52 akadeemilist tundi). EAPC soovitatud maht on põhiõppes 40 tundi (115). Samuti on vajalik praktika, mis on praegu Eestis probleem, sest napib palliatiivse raviga tegelevaid praktikabaase, kuhu tudengeid saata.
Spetsialiseeritud täiendkoolitust (täiendõppeprogramm) peavad pakkuma ülikoolid ja tervishoiukõrgkoolid. See hõlmab süvendatud sümptomaatilise ravi teadmisi ja oskusi ning psühhosotsiaalse nõustamise/abi andmise oskusi. Programmi läbimise eeldus on kliinilise töö kogemus. Eriala arengu eeldus on teadustöö tegemine.
Palliatiivse ravi põhiteadmised peavad olema enam integreeritud arstide ja õdede põhiõppes. Need sisaldavad teadmisi ja oskusi palliatiivse ravi põhimõtetest, valu ja muude sümptomite hindamisest ja ravist, psühhosotsiaalsetest ja õiguslikest aspektidest, suhtlemisest, eneserefleksioonist. Praegu on Eestis arstide põhiõppes kohustuslikud kursused: kolmandal kursusel kolm akadeemilist tundi (suhtlemine) ja viiendal kursusel seitse akadeemilist tundi (põhimõtted, korraldus, vaevuse ravi põhimõtted). Peremeditsiini residentidele on kohustuslik koolitus vaevuste ravi põhimõtetest (kaheksa akadeemilist tundi). Lisaks on arsti põhiõppe tudengitele olemas valikaine (52 akadeemilist tundi). EAPC soovitatud maht on põhiõppes 40 tundi (115). Samuti on vajalik praktika, mis on praegu Eestis probleem, sest napib palliatiivse raviga tegelevaid praktikabaase, kuhu tudengeid saata.
Spetsialiseeritud täiendkoolitust (täiendõppeprogramm) peavad pakkuma ülikoolid ja tervishoiukõrgkoolid. See hõlmab süvendatud sümptomaatilise ravi teadmisi ja oskusi ning psühhosotsiaalse nõustamise/abi andmise oskusi. Programmi läbimise eeldus on kliinilise töö kogemus. Eriala arengu eeldus on teadustöö tegemine.
Lisad
Lisade suuremaks vaateks kliki paremal dokumendisektsioonil
Lisa 1. ECOG sooritusvõime staatuse skaala
| Kirjeldus | Skaala skoor |
| Aktiivne, võimeline sooritama kõiki haiguse-eelseid tegevusi ilma piiranguteta | 0 |
| Piirangud füüsilise pingutusega seotud tegevustes, kuid aktiivne ja võimeline tegema kergemat või istuva iseloomuga tööd, näiteks kergemaid koduseid töid, kontoritööd | 1 |
| Aktiivne ja võimeline täielikuks enesehoolduseks, kuid ei ole suuteline töötama, aktiivne rohkem kui 50% ärkvelolekuajast | 2 |
| Võimeline ainult piiratud ulatuses enesehoolduseks, voodi- või ratastoolikeskne rohkem kui 50% ärkvelolekuajast | 3 |
| Täielikult abitu, ei ole ise võimeline mingiks enesehoolduseks, täielikult voodi- või ratastoolikeskne | 4 |
| Surnud | 5 |
Skaala lõi Eastern Cooperative Oncology Group (ECOG; nüüd osa ECOG- ACRIN Cancer Research Group’ist) ja see avaldati 1982. aastal. Skaala on üleval avalikul veebilehel ja on kättesaadav avalikuks kasutamiseks (https://ecog-acrin. org/resources/ecog-performance-status).
Lisa 2. Verejooksu käsitluse algoritm

Lisa 3. Intrakraniaalse rõhu tõusu ja epileptilise hoo käsitluse algoritm
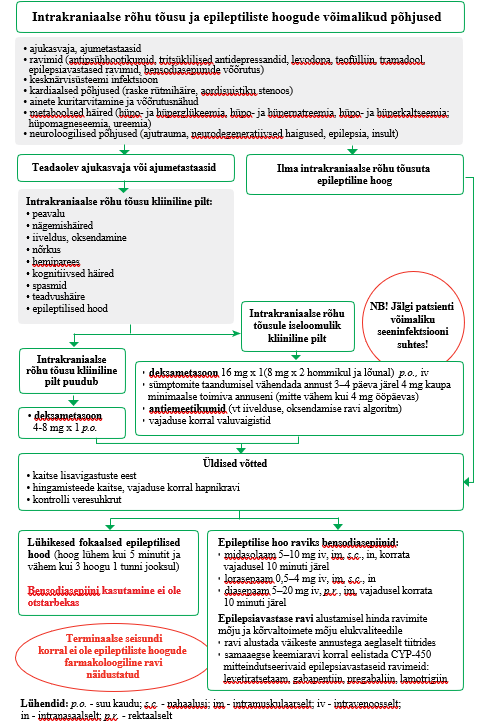
Lisa 4. Ülemise õõnesveeni kompressiooni käsitlus
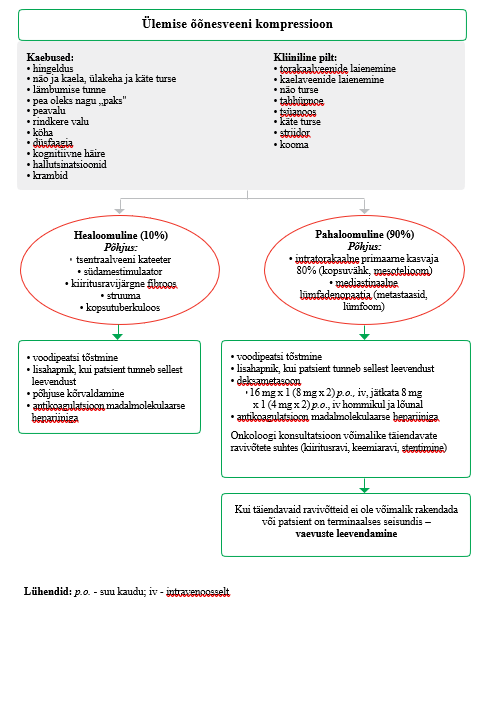
Lisa 5. Seljaaju maliigse kompressiooni käsitlus
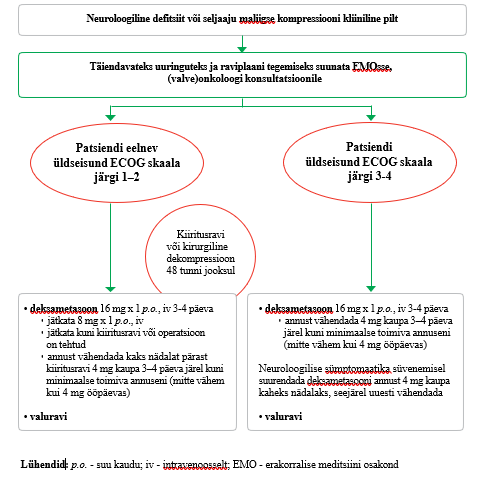
Lisa 6. Maliigse ja mittemaliigse pleuraefusiooni käsitlus
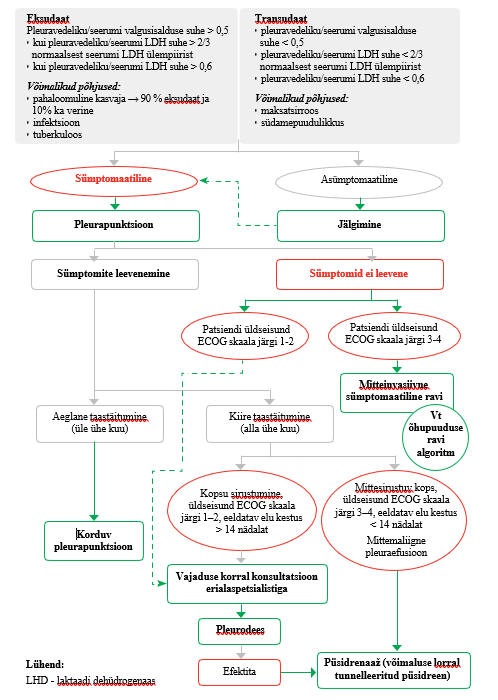
Lisa 7. Astsiidi käsitluse algoritm
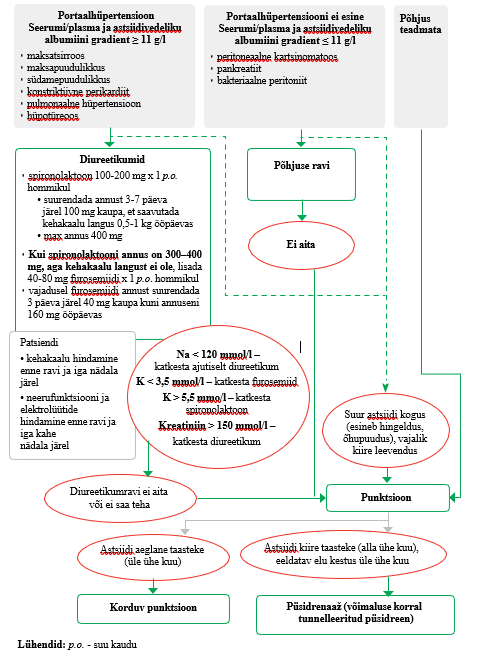
Lisa 8. Abistavad teemad palliatiivse ravi patsiendi seisundi ja vajaduste hindamiseks
Palliatiivse ravi patsiendi seisundi ja patsiendi ning lähedaste probleemide ja vajaduste hindamiseks arutage nendega järgmistel teemadel:
- patsiendi ja lähedaste arusaam haiguse raskusest, ravieesmärkidest, ravieelistustest ning vajaduse korral allkirjastatud tulevikujuhiste ülevaatamine (kui need on olemas);
- patsiendi otsustusvõime hindamine või patsiendi seadusliku esindaja selgitamine;
- patsiendi seisundi objektiivne hindamine, sh sümptomite esinemine, raskus ja mõju patsiendile, funktsionaalne seisund;
- haiguse anamneesi, haiguslooga (analüüsid, uuringud, tehtud ja soovitatud ravi, prognoos) põhjalik tutvumine;
- kaasuvate haiguste ja probleemide hindamine (ka kognitiivse seisundi muutused);
- ravimite kasutamine (ka käsimüügiravimid);
- patsiendi ja lähedaste sotsiaalne toimetulek, ka finantsilised küsimused, elamistingimused (ka geograafiline asukoht), toitumine, turvalisus, suhted, transpordivõimalused;
- sotsiaalsed ja kultuurilised tegurid ning lähedaste toetus, k.a lähedaste soov ja võimalused patsienti toetada ja tema vajadusi rahuldada;
- patsiendi ja lähedaste emotsionaalsed, eksistentsiaalsed ja spirituaalsed küsimused, mured;
- patsiendi, lähedaste ja tervishoiutöötajate suutlikkus üksteisega efektiivselt suhelda, k.a keel, kuulmine, kirjaoskus, kultuurilised normid;
- patsiendi ja lähedaste vajadused seoses läheneva leina ja kaotusega, k.a perekonna hindamine pikaleveninud leina suhtes.
Lisa 9. IPOS, patsiendi versioon, hindamine viimase nädala kohta (näidis)
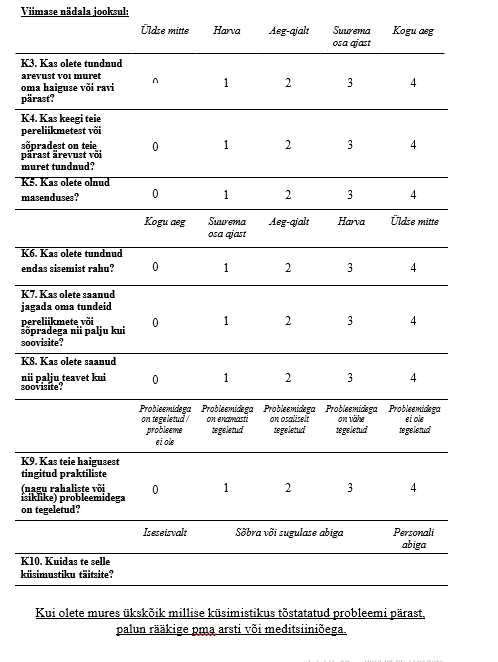
Lisa 10. Interdistsiplinaarse meeskonna liikmete roll
Juhtumikorraldaja ülesanded/roll:
- hindab, planeerib ja koordineerib patsiendile ja lähedastele vajalikke tervishoiu- ja sotsiaalteenuseid;
- toetab ja annab informatsiooni patsiendile ja lähedastele;
- teeb koostööd teiste palliatiivse ravi osutamise tasandite spetsialistidega;
- koordineerib palliatiivse ravi teenuste osutamise protsessi, korraldab teenuse osutamist (kus ja millal teenust osutatakse);
- koordineerib väljaspool tervishoiuvaldkonda osutatavate teenuste saamist;
- hindab teenuste tõhusust;
- jälgib patsiendi ja tema lähedaste toimetulekut ning vajaduse korral sekkub.
Hingehoid on inimese toetamine haigustest, õnnetustest, leinast või elusituatsioonist põhjustatud psüühilise kriisi korral. Lähtudes abivajaja vajadustest ja veendumustest, keskendutakse spirituaalsetele, eksistentsiaalsetele ja religioossetele teemadele. Hingehoidja töötab nii üksi kui ka meeskonnas ja teeb koostööd nii kolleegide kui ka teiste erialade spetsialistidega.
Hingehoidja ülesanded/roll:
Hingehoidja ülesanded/roll:
- toetab patsiendi ja lähedase toimetulekut, hingelise ja vaimse tasakaalu leidmist;
- toetab religioosseid, spirituaalseid ja eksistentsiaalseid vajadusi;
- toetab surijaid ja lähedasi leinaprotsessis;
- toetab patsiendi eneseväärikust;
- peab või korraldab soovi korral jumalateenistusi ja usulisi talitusi;
- toetab ja nõustab töötajaid kriisiolukorraga toimetulekul, surma ja leinateemadel;
- nõustab konfliktsituatsioonides;
- nõustab eetiliselt ja moraalselt tundlikes küsimustes;
- korraldab hingehoiukoolitusi (patsiendi ja lähedase toetamine, raskete sõnumite edastamine, kriisinõustamine, leinanõustamine, läbipõlemise ennetamine ja toimetulek jm).
Sotsiaaltöötaja ülesanded/roll:
- määratleb patsiendi ja lähedase psühhosotsiaalsed probleemid;
- toetab psühhosotsiaalset toimetulekut;
- teavitab sotsiaaltoetustest ja teenustest ning nõustab sel teemal;
- teavitab õendusabi- ja hooldusteenuste võimalustest kodus ja haiglas;
- teavitab töövõime hindamise taotluse, puude raskusastme tuvastamise ja ravikindlustuse taotlemisega seotud toimingutest ning abivahendite taotlemise võimalustest, nõustab nendel teemadel;
- nõustab ja annab infot muudes sotsiaalvaldkonda puudutavates küsimustes
- kaasab vajaduse korral teised interdistsiplinaarse meeskonna liikmed;
- teeb patsiendi ja lähedaste parima võimaliku elukvaliteedi saavutamiseks koostööd teiste spetsialistidega.
Psühholoogi ülesanded/roll:
- hindab patsiendi ja lähedase vajadusi, vaimse tervise seisundit, psühhosotsiaalset toimetulekut ja ressursse;
- aitab mõista ja üle elada kriisietapid;
- toetab psühholoogilist heaolu ja enesetõhusust;
- nõustab, kuidas kaotatud meelerahu tagasi saada, kuidas leida jõuvarusid hingeliseks toimetulekuks, kuidas muutunud elukorraldusega toime tulla;
- aitab mõtestada lahti haigusega kaasnevaid tundeid (väärtusetus, lootusetus, süütunne ja suitsiidimõtted jt) ning nendega toime tulla;
- teeb patsiendi ja lähedaste parima võimaliku elukvaliteedi saavutamiseks koostööd teiste spetsialistidega.
Kasutatud kirjandus
- Radbruch, L., Payne, S. White paper on standards and norms for hospice and palliative care in Europe: Part 1. Recommendations from the European Association for Palliative Care. European Journal of Palliative Care; 2009.
- Hoerger, M., Wayser, G.R., Schwing, G., Suzuki, A., Perry, L.M. Impact of Interdisciplinary Outpatient Specialty Palliative Care on Survival and Quality of Life in Adults With Advanced Cancer: A Meta-Analysis of Randomized Controlled Trials. Annals of Behavioral Medicine; 2019.
- Arias-Casais, N., Garralda, E., Rhee, J.Y., Lima, L. de, Pons, J.J., Clark, D., Hasselaar, J., Ling, J., Mosoiu, D., Centeno, C. EAPC Atlas of Palliative Care in Europe 2019. Vilvoorde: EAPC Press; 2019.
- Morin, L., Aubry, R., Frova, L., et al. Estimating the need for palliative care at the population level: A cross-national study in 12 countries. Palliative Medicine; 2016.
- Connor, S.R. (Ed). Global Atlas of Palliative Care. 2nd Edition. Worldwide Hospice Palliative Care Alliance; 2020.
- Fromme, E.K. Ethical issues in palliative care. Tsiteeritud 28.12.2020. https://www. uptodate.com/contents/ethical-issues-in-palliative-care; 2020.
- Declaration of Geneva. Tsiteeritud 28.12.2020. https://www.wma.net/what-we-do/ medical-ethics/declaration-of-geneva/.
- Pérez Mdel, V., Macchi, M.J., Agranatti, A.F. Advance directives in the context of end-of-life palliative care. Current Opinion in Supportive and Palliative Care; 2013.
- Schofield, G., Baker, I., Bullock, R., Clare, H., Clark, P., Willis, D., Gannon, C., George, R. Palliative opioid use, palliative sedation and euthanasia: reaffirming the distinction. Journal of Medical Ethics; 2020.
- Eesti ravijuhendite koostamise käsiraamat. Tsiteeritud 04.01.2021.https://meditsiiniteadused.ut.ee/sites/default/files/www_ut/rj_kasiraamat_ tooversioon_2017.pdf; 2017.
- Prommer, E. Management of bleeding in the terminally ill patient. Hematology; 2005.
- Shuman, A.G., Yang, Y., Taylor, J.M.G., Prince, M.E. End-of-life care among head and neck cancer patients. Otolaryngology - Head and Neck Surgery; 2011.
- Harris, D.G. & Noble, S.I.R. Management of terminal hemorrhage in patients with advanced cancer: a systematic literature review. Journal of Pain and Symptom Management; 2009.
- Sood, R., Mancinetti, M, Betticher, D., Cantin, B., Ebneter, A. Management of bleeding in palliative care patients in the general internal medicine ward: a systematic review. Annals of Medicine and Surgery; 2019.
- Twycross, R., Wilcock, A. (Eds). Introducing Palliative Care. 5th Edition.Pharmaceutical Press. London, UK.; 2016.
- Bennett, C., Klingenberg, S.L., Langholz, E., Gluud, L.L. Tranexamic acid for upper gastrointestinal bleeding. Cochrane Database of Systematic Reviews; 2014.
- Prutsky, G., Domecq, J.P., Salazar, C.A., Accinelli, R. Antifibrinolytic therapy to reduce haemoptysis from any cause. Cochrane Database of Systematic Reviews; 2016.
- Wand, O., Guber, E., Guber, A., Epstein Shochet, G., Israeli-Shani, L., Shitrit, D. Inhaled tranexamic acid for hemoptysis treatment: a randomized controlled trial. Chest; 2018.
- Tradounsky, G. Seizures in palliative care. Canadian Family Physician; 2013.
- Dietrich, J., Rao, K., Pastorino, S., Kesari, S. Corticosteroids in brain cancer patients: benefits and pitfalls. Expert Review of Clinical Pharmacology; 2011.
- Ryken, T.C., McDermott, M., Robinson, P.D., et al. The role of steroids in the management of brain metastases: a systematic review and evidence-based clinical practice guideline. Journal of Neuro-Oncology; 2010.
- Vecht, C.J., Hovestadt, A., Verbiest, H.B., van Vliet, J.J., van Putten, W.L. Dose- effect relationship of dexamethasone on Karnofsky performance in metastatic brain tumors: a randomized study of doses of 4, 8, and 16 mg per day. Neurology; 1994.
- Gannon, C., McNamara, P. A Retrospective Observation of Corticosteroid Use at the End of Life in a Hospice. Journal of Pain and Symptom Management; 2002.
- Shih, A, Jackson, K.C. Role of Corticosteroids in Palliative Care. Journal of Pain & Palliative Care Pharmacotherapy; 2007.
- West of Scotland Cancer Consultant Nurses. West of Scotland Guidelines for Malignant Spinal Cord Compression. Version 2.0. Tsiteeritud 27.12.2020. https:// www.woscan.scot.nhs.uk/wp-content/uploads/2013/08/Final-Published-WoS- Guidelines-for-Malignant-Spinal-Cord-Compression-v2.0.pdf; 2013.
- Suomalaisen Lääkäriseuran, Duodecimin ja Suomen Palliatiivisen Lääketieteen yhdistyksen asettama työryhma. Palliatiivinen hoito ja saattohoito. Käypä hoito- suositus. Helsinki: Suomalainen Lääkäriseura Duodecim; 2018.
- Prasad, M., Krishnan, P.R., Sequeira, R., Al-Roomi, K. Anticonvulsant therapy for status epilepticus. Cochrane Database of Systematic Reviews; 2014.
- Silbergleit, R., Durkalski, V., Lowenstein, D., Conwit, R., Pancioli, A., Palesch, Y., & Barsan, W. Intramuscular versus intravenous therapy for prehospital status epilepticus. New England Journal of Medicine; 2012.
- Grönheit, W., Popkirov, S., Wehner, T., Schlegel, U., Wellmer, J. Practical Management of Epileptic Seizures and Status Epilepticus in Adult Palliative Care Patients. Frontiers in Neurology; 2018.
- Tremont-Lukats, I.W., Ratilal, B.O., Armstrong, T., Gilbert, M.R. Antiepileptic drugs for preventing seizures in people with brain tumors. Cochrane Database of Systematic Reviews; 2008.
- Lepper, P.M., Ott, S.R., Hoppe, H., et al. Superior Vena Cava Syndrome in Thoracic Malignancies. Respiratory Care; 2011.
- Rowell, N.P., Gleeson, F.V. Steroids, radiotherapy, chemotherapy and stents for superior vena caval obstruction in carcinoma of the bronchus: a systematic review. Clinical Oncology; 2002.
- Ratzon, R., Tamir, S., Friehmann, T., et al. Thrombosis, anticoagulation and outcomes in malignant superior vena cava syndrome. Journal of Thrombosis and Thrombolysis; 2019.
- Lee, C.H., Kwon, J.-W., Lee, J., Hyun, S.-J., Kim, K.-J., Jahng, T.-A., Kim, H.-J.Direct decompressive surgery followed by radiotherapy versus radiotherapy alone for metastatic epidural spinal cord compression: a meta-analysis. SPINE; 2014.
- Lowey, S.E. Spinal cord compression: an oncologic emergency associated with metastatic cancer: evaluation and management for the home health clinician. Home Healthcare Nurse; 2006.
- Huang, J., Jatoi, A. M.D. Morbidity and mortality in patients with cancer who become nonambulatory after spinal cord compression: a case series on end-of-life care. Journal of Palliative Medicine; 2009.
- Kumar, A., Weber, M.H., Gokaslan, Z., et al. Metastatic Spinal Cord Compression and Steroid Treatment: A Systematic Review. Clinical Spine Surgery; 2017.
- George, R., Sundararaj, J.J., Govindaraj, R., Chacko, A.G., Tharyan, P. Interventions for the treatment of metastatic extradural spinal cord compression in adults. Cochrane Database of Systematic Reviews; 2015.
- Lawton, A.J, Lee, K.A, Cheville, A. L., Rades, M.L, Ferrone, D, Balboni, T.A, Abrahm, J.L. Assessment and Management of Patients With Metastatic Spinal Cord Compression: A Multidisciplinary Review. Journal of Clinical Oncology; 2018.
- Lo, W.-Y., Yang, S.-H. Metastatic spinal cord compression (MSCC) treated with palliative decompression: Surgical timing and survival rate. PloS One; 2017.
- Dipper, A., Jones, H.E., Bhatnagar, R., Preston, N.J., Maskell, N., Clive, A.O. Interventions for the management of malignant pleural effusions: a network meta- analysis. Cochrane Database of Systematic Reviews; 2020.
- Koegelenberg, C.F.N., Shaw, J.A., Irusen, E.M., Lee, Y.C.G. Contemporary best practice in the management of malignant pleural effusion. Therapeutic Advances in Respiratory Disease; 2018.
- Ost, D.E., Niu, J., Zhao, H., Grosu, H.B., Giordano, S.H. Quality Gaps and Comparative Effectiveness of Management Strategies for Recurrent Malignant Pleural Effusions. Chest; 2018.
- Iyer, N.P., Reddy, C.B., Wahidi, M.M., et al. Indwelling Pleural Catheter versus Pleurodesis for Malignant Pleural Effusions. A Systematic Review and Meta- Analysis. Annals of the American Thoracic Society; 2019.
- Srour, N., Potechin, R., Amjadi, K. Use of indwelling pleural catheters for cardiogenic pleural effusions. Chest; 2013.
- Stukan, M. Drainage of malignant ascites: patient selection and perspectives.Cancer Management and Research; 2017.
- Garbuzenko, D.V., Arefyev, N.O. Current approaches to the management of patients with cirrhotic ascites. World Journal of Gastroenterology; 2019.
- Angeli, P., Fasolato, S., Mazza, E., et al. Combined versus sequential diuretic treatment of ascites in non-azotaemic patients with cirrhosis: results of an open randomised clinical trial. Gut; 2010.
- Reinglas, J., Amjadi K., Petrcich, B., Momoli, F., Shaw-Stiffel, T. The Palliative Management of Refractory Cirrhotic Ascites Using the PleurX© Catheter. Canadian Journal of Gastroenterology & Hepatology; 2016.
- Korpi, S., Salminen, V.V., Piili, R.P., Paunu, N., Luukkaala, T., Lehto, J.T. Therapeutic Procedures for Malignant Ascites in a Palliative Care Outpatient Clinic. Journal of Palliative Medicine; 2018.
- Bernardi, M., Caraceni, P., Navickis, R.J., Wilkes, M.M. Albumin infusion in patients undergoing large-volume paracentesis: a meta-analysis of randomized trials. Hepatology; 2012.
- Simonetti, R.G., Perricone, G., Nikolova, D., Bjelakovic, G., Gluud, C. Plasma expanders for people with cirrhosis and large ascites treated with abdominal paracentesis. Cochrane Database of Systematic Reviews; 2019.
- Cardona-Morrell, M., Kim, J., Turner, R.M., Anstey, M., Mitchell, I.A., Hillman,K. Non-beneficial treatments in hospital at the end of life: a systematic review on extent of the problem. International Journal of Quality in Health Care; 2016.
- Broom, J., Broom, A., Good, P., Lwin, Z. Why is optimisation of antimicrobial use difficult at the end of life? Internal Medicine Journal; 2019.
- Oh, D.Y., Kim, J.H., Kim, D.W., et al. Antibiotic use during the last days of life in cancer patients. European Journal of Cancer Care; 2006.
- Albrecht, J.S., McGregor, J.C., Fromme, E.K., Bearden, D.T., Furuno, J.P. A nationwide analysis of antibiotic use in hospice care in the final week of life. Journal of Pain and Symptom Management; 2013.
- Thompson, A.J., Silveira, M.J., Vitale, C.A., Malani, P.A. Antimicrobial use at the end of life among hospitalized patients with advanced cancer. The American Journal of Hospice & Palliative Care; 2012.
- Juthani-Mehta, M., Allore, H.G. Design and analysis of longitudinal trials of antimicrobial use at the end of life: to give or not to give? Therapeutic Advances in Drug Safety; 2019.
- Stiel, S., Krumm, N., Pestinger, M., et al. Antibiotics in palliative medicine—results from prospective epidemiological investigation from the HOPE survey. Supportive Care in Cancer; 2012.
- Macedo, F., Nunes, C., Ladeira, K., Pinho, F., Saraiva, N., Bonito, N., Pinto, L., Gonçalves, F. Antimicrobial therapy in palliative care: an overview. Supportive Care in Cancer; 2018.
- Mitchell, S.L., Shaffer, M.L., Loeb, M.B., Givens, J.L., Habtemariam, D., Kiely, D.K., D’Agata, E. Infection management and multidrug-resistant organisms in nursing home residents with advanced dementia. JAMA Internal Medicine; 2014.
- Givens, J.L., Jones, R.N., Shaffer, M.L., Kiely, D.K., Mitchell, S.L. Survival and comfort after treatment of pneumonia in advanced dementia. Archives of Internal Medicine; 2010.
- van der Steen, J.T., Ooms, M.E., van der Wal, G., Ribbe, M.W. Pneumonia: The demented patient's best friend? Discomfort after starting or withholding antibiotic treatment. Journal of the American Geriatrics Society; 2002.
- Barlam, T.F., Cosgrove, S.E., Abbo, L.M., MacDougall, C. Implementing an Antibiotic Stewardship Program: Guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clinical Infectious Diseases; 2016.
- Preston, N.J., Hurlow, A., Brine, J., Bennett, M.I. Blood transfusions for anaemia in patients with advanced cancer. Cochrane Database of Systematic Reviews; 2012.
- Goksu, S.S., Gunduz, S., Unal, D., et al. Use of blood transfusion at the end of life: does it have any effects on survival of cancer patients? Asian Pacific Journal of Cancer Prevention: APJCP; 2014.
- Woodwark, C., Dean, A. Do blood transfusions make a difference when you are dying? Progress in Palliative Care; 2017.
- Raijmakers, L., van Zuylen, M., Costantini, M., et al. Artificial nutrition and hydration in the last week of life in cancer patients. A systematic literature review of practices and effects. Annals of Oncology; 2011.
- Good, P., Richard, R., Syrmis, W., Jenkins-Marsh, S., Stephens, J. Medically assisted hydration for adult palliative care patients. Cochrane Database of Systematic Reviews; 2014.
- Good, P., Richard, R., Syrmis, W., Jenkins-Marsh, S., Stephens, J. Medically assisted nutrition for adult palliative care patients. Cochrane Database of Systematic Reviews; 2014.
- Druml, C., Ballmer, P.E., Druml, W., et al. ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clinical Nutrition; 2016.
- Lokker, M.E., van der Heide, A., Oldenmenger, W.H., van der Rijt, C.C.D., van Zuylen, L. Hydration and symptoms in the last days of life. BMJ Supportive & Palliative Care; 2019.
- Baumstarck, K., Boyer, L., Pauly, V., Orleans, V., Marin, A., Fond, G., Morin, L., Auquier, P., Salas, S. Use of artificial nutrition near the end of life: Results from a French national population-based study of hospitalized cancer patients. Cancer Medicine; 2020.
- Suchner, U., Reudelsterz, C., Gog, C. How to manage terminal dehydration. Der Anaesthesist; 2019.
- Hui, D., Bruera, E. The Last Days of Life: Symptom Burden and Impact on Nutrition and Hydration in Cancer Patients. Current Opinion in Supportive and Palliative Care; 2015.
- National Institute for Health and Care Excellence. Care of dying adults in the last days of life (Clinical guideline NG31). Tsiteeritud 28.12.2020. https://www.nice. org.uk/guidance/ng31; 2015.
- Solano, J.P., Gomes, B., Higginson, I.J. A comparison of symptom prevalence in far advanced cancer, AIDS, heart disease, chronic obstructive pulmonary disease and renal disease. Journal of Pain and Symptom Management; 2006.
- Seow, H., Barbera, L., Sutradhar, R., et al. Trajectory of performance status and symptom scores for patients with cancer during the last six months of life. Journal of Clinical Oncology; 2011.
- Campbell, M.L., Kiernan, J.M., Strandmark, J., Yarandi, H.N. Trajectory of dyspnea and respiratory distress among patients in the last month of life. Journal of Palliative Medicine; 2018.
- O'Driscoll, B.R., Howard, L.S., Earis, J., Mak, V. British Thoracic Society Guideline for oxygen use in adults in healthcare and emergency settings. Thorax; 2017.
- Clemens, K.E., Quednau, I, Klaschik, E. Use of oxygen and opioids in the palliation of dyspnoea in hypoxic and non-hypoxic palliative care patients: a prospective study. Supportive Care in Cancer; 2009.
- Campbell, M.L., Yarandi, H., Dove-Medows, E. Oxygen is nonbeneficial for most patients who are near death. Journal of Pain and Symptom Management; 2013.
- McCusker, M., Ceronsky, L., Crone, C., et al. Palliative Care for Adults. Updated November 2013. Institute for Clinical Systems Improvement; 2013.
- National Consensus Project for Quality Palliative Care. Clinical Practice Guidelines for Quality Palliative Care, 4th edition. Richmond, VA: National Coalition for Hospice and Palliative Care; 2018.
- Bausewein, C., Daveson, B.A., Currow, D.C., et al. EAPC White Paper on outcome measurement in palliative care: Improving practice, attaining outcomes and delivering quality services – Recommendations from the European Association for Palliative Care (EAPC) Task Force on Outcome Measurement. Palliative Medicine; 2016.
- Bausewein, C., Daveson, B., Benalia, H., Simon, S.T., Higginson, I.J. Outcome Measurement in Palliative Care: The Essentials. 2011.
- Albers, G., Echteld, M.A., de Vet, H.C.W., Onwuteaka-Philipsen, B.D., van der Linden, M.H.M., Deliens, L. Evaluation of quality-of-life measures for use in palliative care: a systematic review. Palliative Medicine; 2010.
- Aslakson, R., Dy, S.M., Wilson, R.F., Waldfogel, J.M., Zhang, A., Isenberg, S.R., Blair, A., Sixon, J., Robinson, K.A. Assessment Tools for Palliative Care. Technical Brief No. 30 (Prepared by Johns Hopkins University under Contract No. 290-2015- 00006-I). AHRQ Publication No. 14-17-EHC007-EF. Rockville, MD: Agency for Healthcare Research and Quality; 2017.
- Hanson, L.C., Scheunemann, L.P., Zimmerman, S., Rokoske, F.S., Schenck, A.P. The PEACE Project Review of Clinical Instruments for Hospice and Palliative Care. Journal of Palliative Medicine; 2010.
- Murtagh, F.E.M., Ramsenthaler, C., Firth, A. A brief, patient- and proxy-reported outcome measure in advanced illness: Validity, reliability and responsiveness of the Integrated Palliative care Outcome Scale (IPOS). Palliative Medicine; 2019.
- Antunes, B., Ferreira, P.L. Validation and cultural adaptation of the Integrated Palliative care Outcome Scale (IPOS) for the Portuguese population. BMC Palliative Care; 2020.
- Sakurai, H., Miyashita, M., Imai, K., Miyamoto, S., Otani, H., Oishi, A., Kizawa, Y., Matsushima, E. Validation of the Integrated Palliative care Outcome Scale (IPOS) – Japanese Version. Japanese Journal of Clinical Oncology; 2019.
- Vlckova, K., Hoschlova, E., Chroustova, E., Loucka, M. Psychometric properties of the Czech Integrated Palliative Outcome Scale: reliability and content validity analysis. BMC Palliative Care; 2020.
- Laissaar, M. (juhendaja Hallik, R.). Integreeritud palliatiivravi tulemusmõõdiku (IPOS) tõlkimine ja kultuuriline kohandamine Eestis. Tervisetehnoloogiate instituut, Infotehnoloogia teaduskond, Tallinna Tehnikaülikool; 2020.
- Recommendation Rec (2003) 24 of the Committee of Ministers to member states on the organisation of palliative care. Adopted by the Committee of Ministers on 12 November 2003 at the 860th meeting of the Ministers’ Deputies; 2003.
- Brereton, L., Clark, J., Ingleton, C., Gardiner, C., Preston, L., Ryan, T., Goyder, E. What do we know about different models of providing palliative care? Findings from a systematic review of reviews. Palliative Medicine; 2017.
- Diop, M.S., Rudolph, J.L., Zimmerman, K.M., Richter, M.A., Skarf, L.M. Palliative care interventions for patients with heart failure: a systematic review and meta- analysis. Journal of Palliative Medicine; 2017.
- Gaertner, J., Siemens, W., Meerpohl, J.J., et al. Effect of specialist palliative care services on quality of life in adults with advanced incurable illness in hospital,hospice, or community settings: systematic review and meta-analysis. BMJ; 2017.
- Solari, A., Giordano, A., Patti, F., et al. Randomized controlled trial of a home- based palliative approach for people with severe multiple sclerosis.. Multiple Sclerosis; 2018.
- Fulton, J.J., LeBlanc, T.W., Cutson, T.M., et al. Integrated outpatient palliative care for patients with advanced cancer: A systematic review and meta-analysis. Palliative Medicine; 2019.
- German Guideline Programme in Oncology (German Cancer Society, German Cancer Aid,AWMF). Palliative care for patients with incurable cancer, short version 1.1, 2015 AWMF-registration number 128/001OL. 2015.
- Mid-Western Health Board. Report of the National Advisory Committee on Palliative Care. Department of Health and Children; 2001.
- Radbruch, L., Payne, S. White Paper on standards and norms for hospice and palliative care in Europe: part 2. Recommendations from the European Association for Palliative Care. European Journal of Palliative Care; 2010.
- Ahluwalia, S.C., Chen, C., Raaen, L., et al. A Systematic Review in Support of the National Consensus Project Clinical Practice Guidelines for Quality Palliative Care, Fourth Edition. Journal of Pain and Symptom Management; 2018.
- Phongtankuel, V., Meador, L., Adelman, R.D., et al. Multi-component palliative care interventions in advanced chronic diseases: a systematic review. The American Journal Hospice & Palliative Care; 2018.
- Bajwah, S., Oluyase, A.O., Yi, D., Gao, W., Evans, C.J., Grande, G., Todd, C., Costantini, M., Murtagh, F.E., Higginson, I.J. The effectiveness and cost- effectiveness of hospital-based specialist palliative care for adults with advanced illness and their caregivers. Cochrane Database of Systematic Reviews; 2020.
- Yang, G.M., Neo, S.H., Lim, S.Z., Krishna, L.K. Effectiveness of hospital palliative care teams for cancer inpatients: a systematic review. Journal of Palliative Medicine; 2016.
- Field, R.A., Fritz, Z., Baker, A., Grove, A., Perkins, G.D. Systematic review of interventions to improve appropriate use and outcomes associated with do-not- attempt-cardiopulmonary-resuscitation decisions. Resuscitation; 2014.
- Martins, B., Oliveira, R.A., Cataneo, A.J.M. Palliative care for terminally ill patients in the intensive care unit: systematic review and metaanalysis. Palliative and Supportive Care; 2017.
- Aslakson, R., Cheng, J., Vollenweider, D., Galusca, D., Smith, T.J., Pronovost, P.J. Evidence-Based Palliative Care in the Intensive Care Unit: A Systematic Review of Interventions. Journal of Palliative Medicine; 2014.
- Gorin, S.S., Haggstrom, D., Han, P.K.J., Fairfield, K.M., Krebs, P., Clauser, S.B. Cancer care coordination: a systematic review and meta-analysis of over 30 years of empirical studies. Annals of Behavioral Medicine; 2017.
- Thomas, R.E., Wilson, D.M., Birch, S., Woytowich, B. Examining end-of-life case management: systematic review. Nursing Research and Practice; 2014.
- Centeno, C., Bolognesi, D., Biasco, G. Comparative analysis of specialization in palliative medicine processes within the World Health Organization European region. Journal of Pain and Symptom Management; 2015.
- Carrasco, J.M., Lynch, T.L., Garralda, E., et al. Palliative Care Medical Education in European Universities: A Descriptive Study and Numerical Scoring System Proposal for Assessing Educational Development. Journal of Pain and Symptom Management; 2015.
- Recommendations of the European Association for Palliative Care (EAPC) For the Development of Undergraduate Curricula in Palliative Medicine At European Medical Schools. Report of the EAPC Steering Group on Medical Education and Training in Palliative Care; 2013.
- Oken, M.M., Creech, R.H., Tormey, D.C., Horton, J., Davis, T.E., McFadden, E.T., Carbone, P.P. Toxicity and response criteria of the Eastern Cooperative Oncology Group. American Journal of Clinical Oncology; 1982.