Kodade virvendusarütmia (KVA) ravi- ja käsitlusjuhend
Juhend on uuendamisel alates 2023a III kvartalistRavijuhendi koostajad
Töörühm
Sekretariaat
| Jüri Voitk (töörühma juht), kardioloog | Põhja-Eesti Regionaalhaigla, Eesti Kardioloogide Selts |
| Katrin Martinson (töörühma kaasjuht), perearst | Linnamõisa Perearstikeskus, Eesti Perearstide Selts |
| Žanna Abel, rütmihäirete õde | Põhja-Eesti Regionaalhaigla |
| Märt Elmet, kardioloog | Tartu Ülikooli Kliinikum, Eesti Kardioloogide Selts |
| Priit Kampus, kardioloog | Põhja-Eesti Regionaalhaigla, Eesti Kardioloogide Selts |
| Heli Kaljusaar, kardioloog | Ida-Tallinna Keskhaigla, Eesti Kardioloogide Selts, Tromboosiühing |
| Eve Kivistik, perearst | Linnamõisa Perearstikeskus, Eesti Perearstide Selts |
| Rein Kolk, kardioloog | Tartu Ülikooli Kliinikum, Eesti Kardioloogide Selts |
| Janika Kõrv, neuroloog | Tartu Ülikooli Kliinikum, L. Puusepa nim Neuroloogide ja Neurokirurgide Selts |
| Erki Laidmäe | Eesti Haigekassa |
| Ilja Lapidus, kardioloog | Lääne-Tallinna Keskhaigla, Eesti Kardioloogide Selts |
| Argo Lätt, perearst | Rapla Perearstikeskus, Eesti Perearstide Selts |
| Vassili Novak, erakorralise meditsiini arst | Põhja-Eesti Regionaalhaigla, Eesti Erakorralise Meditsiini Arstide Selts |
| Arkadi Popov, erakorralise meditsiini arst | Põhja-Eesti Regionaalhaigla, Eesti Erakorralise Meditsiini Arstide Selts |
| Kaarel Puusepp, kardioloog | Pärnu Haigla, Eesti Kardioloogide Selts |
| Merike Toomik, sisearst | Lõuna-Eesti Haigla, Eesti Sisearstide Ühendus |
| Riina Vettus, kardioloog | Põhja-Eesti Regionaalhaigla, Eesti Kardioloogide Selts |
| Alar Irs (sekretariaadi juht), kardioloog | Tartu Ülikooli Kliinikum, Eesti Kardioloogide Selts |
| Malle Helmdorf, kardioloog | Põhja-Eesti Regionaalhaigla, Eesti Kardioloogide Selts |
| Katrin Lätt, perearst | Perearst Külvi Peterson, Eesti Perearstide Selts |
| Priit Pauklin, kardioloog | Tartu Ülikooli Kliinikum, Eesti Kardioloogide Selts |
| Anneli Truhanov | Eesti Haigekassa |
| Kärt Veliste |
Eesti Haigekassa |
Lühendid ja mõisted
Lühendid
Mõisted
| AHA | Ameerika Südameassotsiatsioon, ingl American Heart Association |
| AKE | angiotensiini konverteeriv ensüüm |
| ALAT | alaniini aminotransferaas |
| ARB | angiotensiini AT1 retseptori blokaator |
| ASAT | aspartaadi aminotransferaas |
| BNP | B‑tüüpi natriureetiline peptiid |
| CRP‑hs | C‑reaktiivne valk (kõrgtundlik) |
| eGFR (CKD‑EPI) | hinnanguline glomerulaarfiltratsiooni kiirus, mis on leitud Chronic Kidney Disease Epidemiology Collaboration’i neljaparameetrilise valemi abil |
| EHRA | Euroopa Südamerütmi Assotsiatsioon, ingl European Heart Rhythm Association |
| EKG | elektrokardiogramm, elektrokardiograafia |
| HbA1c | glükohemoglobiin |
| HR | riskitiheduste suhe, ingl hazard ratio |
| ITT | uuringutulemuste analüüs ravikavatsuse alusel, ingl intention to treat |
| KVA | kodade virvendusarütmia |
| LDL‑C | LDL‑kolesterool |
| LS | vatsakeste löögisagedus |
| MET | metaboolne ühik (koormuse kirjeldamisel) |
| NICE | Ühendkuningriigi tervishoiu kvaliteediga tegelev asutus, ingl National Institute for Health and Care Excellence |
| NIHSSS | USA Riikliku Terviseinstituudi insuldi raskusastme hindamise skaala, ingl National Institute of Health Stroke Scale |
| NT‑proBNP | B‑tüüpi natriureetilise propeptiidi N‑fragment |
| NYHA | New Yorgi Südameühing, ingl New York Heart Association |
| OSAK | otsese toimega suukaudsed antikoagulandid |
| TIA | transitoorne isheemiline atakk |
| TSH | kilpnääret stimuleeriv hormoon |
| TTE | transtorakaalne ehhokardiograafia |
| TTR | aeg, mil INR‑i väärtus on eesmärkvahemikus, ingl time in therapeutic range |
| ÄKS | äge koronaarsündroom |
| Krüptogeenne ajuinfarkt | Ajuinfarkt, mille puhul vaatamata põhjalikule uurimisele ei leita tõenäolist põhjust (tavaliste vaskulaarsete, kardiaalsete ja laboratoorsete uuringutega ei ole leitud kardiaalse emboli allikat, suurte arterite ateroskleroosi ega väikeste arterite haigust). |
| Mittedihüdropüridiinsed kaltsiumikanali blokaatorid | Verapamiil ja diltiaseem. |
| Rütmivalvur | Implanteeritav rütmihäireid salvestav seade (ingl loop recorder). |
Sissejuhatus
Ravijuhendi vajadus
Kodade virvendusarütmia (KVA) on sagedasim südame rütmihäire, mille levimusmäär maailmas on ligikaudu 2% (3, 4, 5). Haiguse esinemine sõltub vanusest, alla 60‑aastaste seas on levimus alla 1%, 80‑aastaste ja vanemate seas 7...9%. Eestis võib levimusnäitajate alusel olla kuni 26 000 KVA‑ga inimest (6), ravikindlustuse andmetel veelgi enam.
KVA tekib sageli hüpertensioonist, isheemiast või klapipatoloogiast tingitud südamekahjustusest, ent võib esineda ka iseseisvalt.
KVA suurendab suremusriski ja vähendab elukvaliteeti (7). KVA‑ga kaasneb arteriaalse trombemboolia risk, sellega seotud kõige ohtlikum tüsistus on ajuinfarkt, mis esineb sagedusega viis juhtu 100 patsientaasta kohta. Ajuinfarkti risk suureneb vanuse kasvades. Haigekassa andmete alusel on 10...19% patsiendi hospitaliseerimist vajavatest ajuinfarktidest Eestis seotud virvendusarütmiaga ning aastas haigestub ajuinfarkti 2,8% KVA‑ga patsientidest (6). Epidemioloogiliste uuringute alusel leitakse KVA 30% esmase insuldiga patsientidest (71). KVA teine oluline tüsistus on südamepuudulikkus, mis tekib südame kiire löögisageduse tõttu. KVA‑ga patsientidel esineb südamepuudulikkuse dekompensatsiooni kolm korda sagedamini kui elanikkonnas üldiselt (8).
KVA‑ga puutuvad kokku paljude erialade spetsialistid. Hiljuti tehtud auditi (9) tulemustest selgus, et selle rütmihäire käsitlus varieerub ja tõenduspõhised ravivõimalused on sageli kasutamata jäänud. Eesti ravijuhend aitab tagada, et KVA diagnoositakse õigel ajal ning patsiendid saavad haiguse kohta piisavalt teavet ja oma riskiprofiilile vastavat tänapäevast ravi.
KVA tekib sageli hüpertensioonist, isheemiast või klapipatoloogiast tingitud südamekahjustusest, ent võib esineda ka iseseisvalt.
KVA suurendab suremusriski ja vähendab elukvaliteeti (7). KVA‑ga kaasneb arteriaalse trombemboolia risk, sellega seotud kõige ohtlikum tüsistus on ajuinfarkt, mis esineb sagedusega viis juhtu 100 patsientaasta kohta. Ajuinfarkti risk suureneb vanuse kasvades. Haigekassa andmete alusel on 10...19% patsiendi hospitaliseerimist vajavatest ajuinfarktidest Eestis seotud virvendusarütmiaga ning aastas haigestub ajuinfarkti 2,8% KVA‑ga patsientidest (6). Epidemioloogiliste uuringute alusel leitakse KVA 30% esmase insuldiga patsientidest (71). KVA teine oluline tüsistus on südamepuudulikkus, mis tekib südame kiire löögisageduse tõttu. KVA‑ga patsientidel esineb südamepuudulikkuse dekompensatsiooni kolm korda sagedamini kui elanikkonnas üldiselt (8).
KVA‑ga puutuvad kokku paljude erialade spetsialistid. Hiljuti tehtud auditi (9) tulemustest selgus, et selle rütmihäire käsitlus varieerub ja tõenduspõhised ravivõimalused on sageli kasutamata jäänud. Eesti ravijuhend aitab tagada, et KVA diagnoositakse õigel ajal ning patsiendid saavad haiguse kohta piisavalt teavet ja oma riskiprofiilile vastavat tänapäevast ravi.
Ravijuhendi käsitlusala ja sihtrühm
Ravijuhend käsitleb täiskasvanud patsientidel KVA avastamist, diagnoosimist, trombemboolia ennetust, südame löögisageduse kontrolli all hoidmist ja siinusrütmi säilitavat ravi.
Lisaks toob juhend välja ablatsioonravi näidustused ning annab käsitlusjuhendi KVA‑ga tegelemiseks perearsti juures, kiirabis ja erakorralise meditsiini osakonnas.
Ravijuhendis ei käsitleta harvu ja spetsialiseeritud sekkumisi ega antikoagulatsiooni üldteemasid:
Lisaks toob juhend välja ablatsioonravi näidustused ning annab käsitlusjuhendi KVA‑ga tegelemiseks perearsti juures, kiirabis ja erakorralise meditsiini osakonnas.
Ravijuhendis ei käsitleta harvu ja spetsialiseeritud sekkumisi ega antikoagulatsiooni üldteemasid:
- elektrofüsioloogiliste ja kardiokirurgiliste sekkumiste detailid
- vasaku koja kõrvakese sulgurseadme kasutamine
- periprotseduraalne antikoagulatsioon ja sildamine
- veritsuste ravi
Nende teemade käsitlemisel soovitame aluseks võtta Euroopa Kardioloogide Seltsi ja Euroopa Südamerütmi Assotsiatsiooni ravijuhendid (7, 10).
Ravijuhendi soovitused põhinevad teaduslikel andmetel, millest esitatakse juhendis kokkuvõtted. Teadaolevalt puudulike teaduslike andmete korral piirdutakse mõnel juhul töörühma kogemusest tulenevate praktiliste soovitustega.
Seos rahastamisotsuste, ravimite müügilubade ja arsti eralase otsustsuvabadusega
Ravijuhendit välja töötades ja soovitusi sõnastades lähtus töörühm sekkumiste tõenduspõhisest kliinilisest kasust ja ka kulutõhususe andmetest.
Juhendi rakendamiseks võivad olla vajalikud rahastamisotsused, mis tehakse selleks ette nähtud korras (tervise- ja tööministri määrus nr 59, 19.12.2017, sotsiaalministri määrus nr 301, 24.09.2002).
Ravijuhend ei anna detailset teavet ravimite kohta ning praktikas tuleb lähtuda ravimi omaduste kokkuvõttest (www.ravimiamet.ee). Teatud ravimite puhul on võimalik, et vastavasisuliste teadusandmete olemasolul kasutatakse neid väljaspool kinnitatud näidustust. Ravijuhendit koostades on lähtutud kõigist ajakohastest andmetest, mitte ainult ravimite kinnitatud näidustustest. Ravimite kasutamisel väljaspool kinnitatud näidustusi või kasutamistingimusi tuleb patsiente sellest teavitada.
Patsiendi ravis ravijuhendi soovitusi rakendades tuleb alati arvesse võtta kliinilist konteksti, patsiendi eripära ja eelistusi. Kõik soovitused ei pruugi sobida kõigile patsientidele.
Juhendi rakendamiseks võivad olla vajalikud rahastamisotsused, mis tehakse selleks ette nähtud korras (tervise- ja tööministri määrus nr 59, 19.12.2017, sotsiaalministri määrus nr 301, 24.09.2002).
Ravijuhend ei anna detailset teavet ravimite kohta ning praktikas tuleb lähtuda ravimi omaduste kokkuvõttest (www.ravimiamet.ee). Teatud ravimite puhul on võimalik, et vastavasisuliste teadusandmete olemasolul kasutatakse neid väljaspool kinnitatud näidustust. Ravijuhendit koostades on lähtutud kõigist ajakohastest andmetest, mitte ainult ravimite kinnitatud näidustustest. Ravimite kasutamisel väljaspool kinnitatud näidustusi või kasutamistingimusi tuleb patsiente sellest teavitada.
Patsiendi ravis ravijuhendi soovitusi rakendades tuleb alati arvesse võtta kliinilist konteksti, patsiendi eripära ja eelistusi. Kõik soovitused ei pruugi sobida kõigile patsientidele.
Peamised soovitused
Sõelumine ja diagnoosimine
| 1 | Kõigil 65‑aastastel ja vanematel inimestel, kellel ei ole teada KVA‑d, katsuge igal arsti- või õevisiidil pulssi. Kui see on ebaregulaarne, korraldage EKG tegemine ja nõustage patsienti edasiste tegevuste asjus. Töörühma praktiline soovitus. |
|
| 2 | Õpetage kõiki 65‑aastaseid ja vanemaid inimesi ning nooremaid, kellel on südame rütmihäire kahtlus, endal pulssi katsuma ja selle regulaarsust hindama. Töörühma praktiline soovitus. |
|
| 3 | Pärast krüptogeenset ajuinfarkti, TIA‑d või arteriaalset trombembooliat jälgige paroksüsmaalse KVA avastamiseks südamerütmi vähemalt 24 tunni jooksul. Tugev soovitus, kõrge tõendatus. |
|
| 4 | Kui 24‑tunnisel jälgimisel pärast krüptogeenset ajuinfarkti, TIA‑d või arteriaalset trombembooliat KVA‑d ei tuvastata, jälgige südamerütmi 72 tunni jooksul. Tugev soovitus, kõrge tõendatus. |
|
| 5 | Paroksüsmaalse KVA kahtlusega patsiendil, kellele võib olla näidustatud antikoagulantravi ja kellel 24‑tunnise rütmijälgimise jooksul virvendusarütmiat ei tuvastata, võite diagnoosimiseks kasutada 72‑tunnist ambulatoorset rütmijälgimist, pikemaajalist ambulatoorset jälgimist EKG salvesti või implanteeritava rütmivalvuri abil. Nõrk soovitus, kõrge tõendatus. |
|
| 6 | Südamestimulaatori regulaarsel kontrollimisel dokumenteerige kodade kiire sageduse episoodid ning nõustage patsienti edasiste tegevuste asjus. Töörühma praktiline soovitus. |
|
| 7 | Kui südamestimulaatoriga patsiendi puhul on varem diagnoosimata KVA kahtlus, sh kui on esinenud krüptogeenne ajuinfarkt, TIA või arteriaalne trombemboolia, suunake patsient stimulaatori kontrolli. Töörühma praktiline soovitus. |
|
| 8 | Kui diagnoosite patsiendil KVA esimest korda, dokumenteerige kliinilised andmed ja tehke uuringud ning analüüsid vähemalt tabelis 4 näidatud ulatuses. Tehke sama juhul, kui patsiendil on KVA varem diagnoositud, ent neid andmeid ei ole seni dokumenteeritud. Töörühma praktiline soovitus. |
|
| 9 | Kui diagnoosite patsiendil KVA esimest korda ja plaanite siinusrütmi taastavat/säilitavat ravi või kahtlustate struktuurset südamehaigust või südamepuudulikkust, korraldage TTE‑uuring, kui seda ei ole viimase aasta jooksul tehtud. Tugev soovitus, madal tõendatus.. |
|
| 10 |
KVA diagnoosi vormistamisel:
Töörühma praktiline soovitus.
|
KVA riskitegurite mõjutamine
| 11 | Selgitage välja kõik patsiendil esinevad KVA‑d soodustavad elustiilitegurid (ülekaal, vähene füüsiline aktiivsus, alkoholitarbimine, suitsetamine), mida on võimalik mõjutada. Leppige kokku plaan nende mõjutamiseks ning eesmärgid. Tugev soovitus, madal tõendatus. |
|
| 12 | Kontrollige, kas patsiendil on kaasuvaid haigusi, mis soodustavad KVA teket (ülekaal, obstruktiivne uneapnoe, kõrgvererõhktõbi, suhkurtõbi, hüpertüreoos), ja vajaduse korral optimeerige nende ravi. Töörühma praktiline soovitus. |
|
| 13 | Sümptomaatilise KVA‑ga, hästimotiveeritud patsientidel võite lisaks kasutada riskitegurite ja kaasuvate haiguste intensiivset kompleksset mõjutamist elustiilimuudatuste, farmakoteraapia jt sekkumiste abil (vt joonis 1). Nõrk soovitus, madal tõendatus. |
Trombemboolia ennetus
| 14 | KVA‑ga patsiendi trombemboolia riski hindamiseks kasutage CHA2DS2‑VASc skoori (vt lisa 8). Tugev soovitus, kõrge tõendatus. |
|
| 15 | Hinnake KVA‑ga patsiendi verejooksuriski enne antikoagulantravi alustamist ja regulaarselt ravi ajal, dokumenteerige, korrigeerige mõjutatavaid riskitegureid. Töörühma praktiline soovitus. |
|
| 16 | KVA‑ga patsiendi verejooksuriski hindamiseks võite kasutada HAS‑BLED‑i skoori (vt lisa 9). Nõrk soovitus, madal tõendatus. |
|
| 17 | Kui CHA2DS2‑VASc ≥ 2, määrake KVA‑ga patsiendile trombemboolia vältimiseks antikoagulantravi. Tugev soovitus, kõrge tõendatus. |
|
| 18 | Kui CHA2DS2‑VASc = 1, kaaluge KVA‑ga patsiendile trombemboolia vältimiseks antikoagulantravi määramist, võttes arvesse verejooksuriski. Nõrk soovitus, madal tõendatus. |
|
| 19 | Ärge määrake pikaajalist antikoagulantravi trombemboolia riskiteguriteta KVA‑ga patsiendile (kui CHA2DS2‑VASc = 0). Tugev soovitus, kõrge tõendatus. |
Antikoagulandi valik
| 20 | Tutvustage patsiendile kõiki antikoagulante ja ravimit valides võtke arvesse patsiendi eelistust. Töörühma praktiline soovitus. |
|
| 21 | KVA‑ga patsiendile antikoagulanti valides võite veritsuste väiksema riski tõttu eelistada OSAK‑it (trombiini või Xa‑faktori inhibiitorit). Nõrk soovitus, tugev tõendatus. |
|
| 22 | Kui KVA‑ga patsient saab juba ravi K‑vitamiini antagonistiga (varfariin) ja ≥ 70% kontrollimistest vastab INR eesmärkväärtusele, ei ole vaja ravi vahetada. Töörühma praktiline soovitus. |
|
| 23 | Mehaanilise klapiproteesi või hemodünaamiliselt olulise mitraalstenoosi puhul kasutage KVA‑ga patsiendil antikoagulatsiooniks K‑vitamiini antagoniste (nt varfariini). Tugev soovitus, kõrge tõendatus. |
|
| 24 | Ärge kasutage mehaanilise klapiproteesi puhul KVA‑ga patsiendil antikoagulatsiooniks OSAK‑it (trombiini või Xa‑faktori inhibiitorit). Tugev soovitus, mõõdukas tõendatus. |
|
| 25 | Ärge kasutage KVA‑ga patsiendil trombemboolia profülaktikaks antiagregantravi, kui selle kasutamiseks ei ole muid näidustusi. Tugev soovitus, mõõdukas tõendatus. |
Südamelöögi sageduse esmane vähendamine
| 26 | Kui diagnoosite KVA ja patsiendil on vaja vähendada südame löögisagedust, kasutage beetaadrenoblokaatorit või mittedihüdropüridiinset kaltsiumikanali blokaatorit. Tugev soovitus, madal tõendatus. |
|
| 27 | Kui KVA‑ga patsiendil on südamepuudulikkus või teadaolevalt langenud vasaku vatsakese süstoolne funktsioon, kasutage südame löögisageduse esmaseks vähendamiseks beetaadrenoblokaatorit, digoksiini või vajadusel nende kombinatsiooni. Tugev soovitus, madal tõendatus. |
|
| 28 | Ärge kasutage dekompenseerunud südamepuudulikkusega ja KVA‑ga patsiendil südame löögisageduse vähendamiseks mittedihüdropüridiinset kaltsiumikanali blokaatorit. Tugev soovitus, mõõdukas tõendatus. |
|
| 29 | Kriitiliselt haigel või vasaku vatsakese raskelt langenud süstoolse funktsiooniga KVA‑ga patsiendil, kellel tahhükardia põhjustab hemodünaamika ebastabiilsust, võite südame löögisageduse vähendamiseks kasutada intravenoosset amiodarooni. Nõrk soovitus, madal tõendatus. |
Südame löögisageduse pikaajaline kontrolli all hoidmine
| 30 | Saavutage KVA‑ga patsiendil südame löögisagedus alla 110 x/min rahuolekus. Tugev soovitus, madal tõendatus. |
|
| 31 | Kui KVA‑ga patsiendil esinevad pärast südame löögisageduse eesmärkväärtuse < 110 x/min saavutamist vatsakeste suurest löögisagedusest tulenevad sümptomid, vähendage südame löögisagedust alla 80 x/min. Tugev soovitus, madal tõendatus. |
|
| 32 | Kui arstivisiidil on KVA‑ga patsiendi südame löögisagedus eesmärgile vastav, ent sümptomid püsivad, võite kasutada südame löögisageduse 24‑tunnist jälgimist. Töörühma praktiline soovitus. |
|
| 33 | Kasutage südame löögisageduse vähendamist vajaval KVA‑ga patsiendil esmalt monoteraapiat beetaadrenoblokaatori või mittedihüdropüridiinse kaltsiumikanali blokaatoriga. Valige ravim patsiendi sümptomite, südame löögisageduse, kaasuvate haiguste ja patsiendi eelistuse järgi (vt tabel 12). Tugev soovitus, madal tõendatus. |
|
| 34 | Kui monoteraapia KVA sümptomeid ei leevenda ja sümptomid on arvatavasti tingitud vatsakeste suurest löögisagedusest, kaaluge ravimite kombineerimist (beetaadrenoblokaator, mittedihüdropüridiinne kaltsiumikanali blokaator, digoksiin), võttes arvesse koostoimest tulenevaid ohte (vt tabel 12). Nõrk soovitus, madal tõendatus. |
|
| 35 | Ärge kasutage permanentse KVA‑ga patsientidel südame löögisageduse vähendamiseks I ja III klassi antiarütmikume. Tugev soovitus, mõõdukas tõendatus. |
|
| 36 | Kui KVA‑ga patsiendil on südamepuudulikkus või teadaolevalt langenud vasaku vatsakese süstoolne funktsioon (väljutusfraktsioon ≤ 40%), kasutage südame löögisageduse vähendamiseks beetaadrenoblokaatorit või digoksiini. Tugev soovitus, mõõdukas tõendatus. |
Siinusrütmi taastav ja säilitav ravi
| 37 | Kui KVA põhjustab patsiendi hemodünaamika ebastabiilsust, tehke kohe elektriline kardioversioon. Tugev soovitus, madal tõendatus. |
|
| 38 | Kui KVA põhjustab patsiendi hemodünaamika ebastabiilsust ja elektrilist kardioversiooni ei saa teha, võite siinusrütmi taastamiseks kasutada intravenoosset amiodarooni. Nõrk soovitus, madal tõendatus. |
|
| 39 | Kaaluge siinusrütmi taastamist KVA‑ga patsientidel, kellel peale südame löögisageduse eesmärgi saavutamist sümptomid püsivad või kellel sageduse eesmärki ei õnnestu saavutada. Nõrk soovitus, madal tõendatus. |
|
| 40 | Alla 48 tunni kestnud KVA puhul võite siinusrütmi taastamiseks kasutada nii elektrilist kui ka farmakoloogilist kardioversiooni (vt tabel 13). Meetodi valikul arvestage oma kogemuse ja patsiendi eelistusega. Nõrk soovitus, mõõdukas tõendatus. |
|
| 41 | Üle 48 tunni kestnud KVA puhul eelistage siinusrütmi taastamiseks elektrilist kardioversiooni. Tugev soovitus, mõõdukas tõendatus. |
|
| 42 | Kardioversiooni järel määrake patsiendile neljaks nädalaks antikoagulatsioon ka siis, kui ei esine trombemboolia riskitegureid. Trombemboolia suurenenud risk kaasneb nii farmakoloogilise kui ka elektrilise kardioversiooniga ja püsib esimeste nädalate jooksul peale kardioversiooni. Töörühma praktiline soovitus. |
|
| 43 | Siinusrütmi tohib hemodünaamiliselt stabiilsel, antikoaguleerimata, KVA‑ga haigel taastada juhul, kui on kindel, et KVA on kestnud alla 48 tunni. Arvestage, et KVA võib olla asümptomaatiline ja patsient võib selle tekkimise aega valesti hinnata, eriti normofrekventse KVA puhul. Töörühma praktiline soovitus. |
|
| 44 | Siinusrütmi tohib hemodünaamiliselt stabiilsel KVA‑ga patsiendil taastada juhul, kui patsient on olnud adekvaatselt antikoaguleeritud vähemalt kolm nädalat või söögitorukaudse ehhokardiograafilise uuringuga on välistatud trombid südameõõntes. Töörühma praktiline soovitus. |
|
| 45 | Harvade sümptomaatiliste paroksüsmidega KVA‑ga patsiendile, kellel siinusrütm ise ei taastu ning kellel on varem sama ravimit haiglas siinusrütmi taastamiseks edukalt ja ohutult kasutatud, võite soovitada siinusrütmi taastamiseks propafenooni (450...600 mg) või flekainiidi (200...300 mg) ühekordse suukaudse annuse kasutamist (nn tablett-taskus-strateegia, ingl pill-in-the-pocket approach). Kui patsient ei saa püsiravi beetaadrenoblokaatori ega mittedihüdropüridiinse kaltsiumikanali blokaatoriga, tuleb koos antiarütmikumiga võtta beetaadrenoblokaatorit. Nõrk soovitus, mõõdukas tõendatus. |
|
| 46 | Kui sümptomaatiliste paroksüsmidega KVA puhul on koostöös patsiendiga valitud siinusrütmi säilitav ravistrateegia, kasutage esimese siinusrütmi säilitava ravimina beetaadrenoblokaatorit. Tugev soovitus, mõõdukas tõendatus. |
|
| 47 | Kui sümptomaatiliste paroksüsmidega KVA puhul on koostöös patsiendiga valitud siinusrütmi säilitav ravistrateegia ja beetablokaatori kasutamine on vastunäidustatud või see ei ole tõhus, valige antiarütmikum, lähtudes ohutusest ning kaasuvatest haigustest (vt tabel 14). Tugev soovitus, väga madal tõendatus. |
|
| 48 | Ärge kasutage IC‑klassi antiarütmikume (flekainiid, propafenoon) südame isheemiatõve ja struktuurse südamehaigusega patsientidel. Tugev soovitus, mõõdukas tõendatus. |
|
| 49 | Ärge kasutage amiodarooni pikaajaliselt, välja arvatud juhul, kui on kindel vajadus siinusrütmi säilitava ravi järele ja muud antiarütmikumid ei ole efektiivsed või on vastunäidustatud. Tugev soovitus, kõrge tõendatus. |
|
| 50 | Sagedaste sümptomaatiliste paroksüsmidega KVA korral kaaluge patsiendi suunamist kateeterablatsioonile. Töörühma praktiline soovitus. |
|
| 51 | Kasutage südamepuudulikkuse ja langenud väljutusfraktsiooniga patsientidel KVA uue paroksüsmi tekke ennetamiseks angiotensiini konverteeriva ensüümi inhibiitorit (või selle talumatuse korral angiotensiini retseptori blokaatorit) ja beetablokaatorit. Tugev soovitus, mõõdukas tõendatus. |
KVA definitsioon ja klassifikatsioon
KVA on supraventrikulaarne rütmihäire, mida iseloomustab ebaregulaarne südametöö. KVA diagnoosimise aluseks on rütmihäire tuvastamine elektrokardiogrammil, kus on näha ebaregulaarne R‑R‑intervall ja puuduvad selgelt eristatavad P‑sakid. KVA diagnoosimiseks peab selline rütmihäire kestma üle 30 sekundi või kogu EKG salvestamise aja.
Tabel 1. KVA klassifikatsioon (7)
| KVA vorm | Selgitus |
| Esmakordselt diagnoositud KVA | Varem diagnoosimata KVA olenemata rütmihäire kestusest ja sellega seotud sümptomite esinemisest ja raskusest. |
| Paroksüsmaalne KVA | KVA episood, mis kestab kuni seitse päeva ja möödub ise. Paroksüsmaalseteks peetakse ka seitsme päeva jooksul kardioverteeritavaid KVA episoode. |
| Persisteeruv KVA | KVA episood, mis kestab kauem kui seitse päeva, sh kui siinusrütm on kardioversiooniga taastatud rohkem kui seitsme päeva möödumisel rütmihäire algusest. |
| Pikalt persisteeruv KVA | KVA kestusega üks aasta või rohkem, kui otsustatakse kasutada siinusrütmi säilitavat ravi. |
| Permanentne KVA | KVA, mille püsimisega patsient (ja arst) on leppinud. Siinusrütmi taastavaid ega säilitavaid raviviise ei kasutata. Kui otsustatakse siinusrütm taastada, klassifitseeritakse rütmihäire ümber pikalt persisteeruvaks KVA‑ks. |
KVA‑d diagnoosides hinnatakse, kas see põhjustab sümptomeid. Lisaks sümptomite olemasolu dokumenteerimisele ja kirjeldusele võib kasutada EHRA modifitseeritud skoori (11).
Tabel 2. KVA klassifikatsioon sümptomite esinemise alusel (EHRA modifitseeritud skoor)
Tabel 2. KVA klassifikatsioon sümptomite esinemise alusel (EHRA modifitseeritud skoor)
| Skoor | Süptomid | Kirjeldus |
| 1 | Puuduvad | KVA ei põhjusta mingeid sümptomeid. |
| 2a | Kerged | KVA sümptomid ei mõjuta igapäevast tegevust. |
| 2b | Mõõdukad | KVA sümptomid ei mõjuta igapäevast tegevust, kuid häirivad patsienti. |
| 3 | Rasked | KVA sümptomid mõjutavad igapäevast tegevust. |
| 4 | Invaliidistavad | Igapäevane tegevus on oluliselt häiritud või ei ole võimalik. |
Sõelumine ja diagnoosimine
| 1 | Kõigil 65‑aastastel ja vanematel inimestel, kellel ei ole teada KVA‑d, katsuge igal arsti- või õevisiidil pulssi. Kui see on ebaregulaarne, korraldage EKG tegemine ja nõustage patsienti edasiste tegevuste asjus. Töörühma praktiline soovitus. |
|
| 2 | Õpetage kõiki 65‑aastaseid ja vanemaid inimesi ning nooremaid, kellel on südame rütmihäire kahtlus, endal pulssi katsuma ja selle regulaarsust hindama. Töörühma praktiline soovitus |
KVA on sage rütmihäire, mille ohtlik tüsistus on trombemboolia, sh ajuinfarkt. Nii rütmihäire levimus kui ka trombemboolia risk suurenevad vanusega . Rütmihäire avastamisel saab trombembooliat ennetada, seetõttu soovitab töörühm kõigil tervishoiutöötajatel hinnata eakatel patsientidel pulsi regulaarsust. Samuti peab töörühm oluliseks õpetada eakaid ja rütmihäire kahtlusega inimesi ise oma pulssi hindama.
Pulsi palpeerimise sensitiivsus KVA tuvastamisel on 94% (12), ent spetsiifilisus vaid 72%, seetõttu on vaja KVA kahtluse korral teha EKG.
Töörühm arutas ka mobiilirakenduste kasutamist KVA tuvastamiseks, ent loobus soovituse andmisest, kuna andmed nende usaldusväärsuse kohta kliinilise diagnoosi alusena on vastukäivad (13, 14). Kui patsient soovib mobiilirakendust kasutada, on soovitatav eelistada selliseid, mis salvestavad lisaseadme abil EKG.
Pulsi palpeerimise sensitiivsus KVA tuvastamisel on 94% (12), ent spetsiifilisus vaid 72%, seetõttu on vaja KVA kahtluse korral teha EKG.
Töörühm arutas ka mobiilirakenduste kasutamist KVA tuvastamiseks, ent loobus soovituse andmisest, kuna andmed nende usaldusväärsuse kohta kliinilise diagnoosi alusena on vastukäivad (13, 14). Kui patsient soovib mobiilirakendust kasutada, on soovitatav eelistada selliseid, mis salvestavad lisaseadme abil EKG.
| 3 | Pärast krüptogeenset ajuinfarkti, TIA‑d või arteriaalset trombembooliat jälgige paroksüsmaalse KVA avastamiseks südamerütmi vähemalt 24 tunni jooksul. Tugev soovitus, kõrge tõendatus |
|
| 4 | Kui 24‑tunnisel jälgimisel pärast krüptogeenset ajuinfarkti, TIA‑d või arteriaalset trombembooliat KVA‑d ei tuvastata, jälgige südamerütmi 72 tunni jooksul. Tugev soovitus, kõrge tõendatus. |
|
| 5 | Paroksüsmaalse KVA kahtlusega patsiendil, kellele võib olla näidustatud antikoagulantravi ja kellel 24‑tunnise rütmijälgimise jooksul virvendusarütmiat ei tuvastata, võite diagnoosimiseks kasutada 72‑tunnist ambulatoorset rütmijälgimist, pikemaajalist ambulatoorset jälgimist EKG salvesti või implanteeritava rütmivalvuri abil. Nõrk soovitus, kõrge tõendatus. |
|
| 6 | Südamestimulaatori regulaarsel kontrollimisel dokumenteerige kodade kiire sageduse episoodid ning nõustage patsienti edasiste tegevuste asjus. Töörühma praktiline soovitus. |
|
| 7 | Kui südamestimulaatoriga patsiendi puhul on varem diagnoosimata KVA kahtlus, sh kui on esinenud krüptogeenne ajuinfarkt, TIA või arteriaalne trombemboolia, suunake patsient stimulaatori kontrolli. Töörühma praktiline soovitus. |
KVA põhjustatud ajuinfarkti suurt riski arvestades on oluline rütmihäire diagnoosida ka nendel patsientidel, kellel esineb südamekloppimist harva. Ka krüptogeense ajuinfarkti ja TIA patsientide puhul on rütmihäire diagnoosimine ravi valimisel tähtis.
Vähemalt kord ööpäevas esineva KVA puhul on kasutatav 24‑ tunnine ambulatoorne või statsionaarne rütmijälgimine, harvem esineva KVA puhul saab kasutada pikemaajalist ambulatoorset või statsionaarset rütmijälgimist, patsiendi käivitatavat või automaatselt rütmihäiret salvestavat seadet või implanteeritavat rütmivalvurit.
Teadusuuringuis on erinevate jälgimiskestuste ja -meetodite tõhusust KVA tuvastamisel hinnatud põhiliselt krüptogeense ajuinfarktiga patsientidel (15, 16, 17). On mõned randomiseeritud uuringud, mis näitavad, et krüptogeense ajuinfarktiga patsientidel, kellel standardmeetodil KVA‑d ei leita, võidakse rütmihäire diagnoosida pikemaajalisel/korduval jälgimisel.
Tabel 3. KVA krüptogeense ajuinfarkti patsientide rütmi jälgimisel, kui esmane EKG ja 24‑tunnine rütmijälgimine ei näidanud KVA‑d
Vähemalt kord ööpäevas esineva KVA puhul on kasutatav 24‑ tunnine ambulatoorne või statsionaarne rütmijälgimine, harvem esineva KVA puhul saab kasutada pikemaajalist ambulatoorset või statsionaarset rütmijälgimist, patsiendi käivitatavat või automaatselt rütmihäiret salvestavat seadet või implanteeritavat rütmivalvurit.
Teadusuuringuis on erinevate jälgimiskestuste ja -meetodite tõhusust KVA tuvastamisel hinnatud põhiliselt krüptogeense ajuinfarktiga patsientidel (15, 16, 17). On mõned randomiseeritud uuringud, mis näitavad, et krüptogeense ajuinfarktiga patsientidel, kellel standardmeetodil KVA‑d ei leita, võidakse rütmihäire diagnoosida pikemaajalisel/korduval jälgimisel.
Tabel 3. KVA krüptogeense ajuinfarkti patsientide rütmi jälgimisel, kui esmane EKG ja 24‑tunnine rütmijälgimine ei näidanud KVA‑d
| Kestus | 7päeva | 30päeva | 1 aasta (implateeritav) |
| KVA | 6% | 11...23% | 27...28% |
Ühendkuningriigis tehtud uuringust (18) selgus, et ajuinfarkti järgne seitsmepäevane EKG monitooring oli efektiivsem kui standardmeetod (18% vs. 2%; p < 0,05) ning suurendas oluliselt suukaudsete antikoagulantide kasutamist.
Uuringus EMBRACE (N = 572, 19) jaotati hiljutise krüptogeense ajuinfarktiga patsiendid, kellel tavapärasel uuringul KVA‑d ei leitud, 24 tunni rütmijälgimise ning EKG‑d 30 päeva jooksul automaatselt registreeriva seadme rühma. 30‑päevase monitooringu rühmas leiti oluliselt rohkem KVA juhte (16% vs. 3%; p < 0,001) ning suukaudsete antikoagulantide kasutus kahekordistus.
Uuringus CRYSTAL AF (N = 441, 20) randomiseeriti krüptogeense ajuinfarktiga patsiendid pärast 24‑tunnist EKG jälgimist implanteeritava rütmivalvuri ja standardkäsitluse rühma.
Sekkumise rühmas leiti kuue kuuga rohkem KVA‑ga patsiente (8,9% vs. 1,4%, HR 6,4; 95% CI 1,9...21,7; p < 0,001). 12 kuu tulemused olid sarnased (12,4% vs. 2,0%, HR 7,3; 95% CI 2,6...20,8; p < 0,001).
Mitmes prospektiivses uuringus (21, 22, 19) selgus, et krüptogeense ajuinfarktiga patsiendid, kellel standardmeetodil KVA‑d ei leita, võivad saada diagnoosi kauakestvama (72 tundi ja enam) EKG jälgimise järel. Ilmnes ka trend, et mida vanem oli patsient, seda suurem oli diagnostiline kasu (21, 18).
Uuringud, mis hindasid pikema rütmijälgimise mõju kliinilistele tulemusnäitajatele ajuinfarkti sekundaarses preventsioonis, ei näidanud sellest olulist kasu (23).
Töörühm leidis, et on piisavalt hea kvaliteediga andmeid, mis kirjeldavad erinevate jälgimisperioodide mõju KVA tuvastamisele, ning mõõdukalt andmeid, mis näitavad, et KVA tuvastamisele järgneb patsiendi käsitluse muutus. Töörühm tõdes, et puuduvad andmed, mis viitavad otseselt korduva ajuinfarkti sageduse vähenemisele pikema rütmijälgimise tulemusena.
Töörühm pidas 24‑tunnist rütmijälgimist standardseks, laialdaselt kasutatavaks ning KVA sagedaste paroksüsmide puhul efektiivseks diagnoosimismeetodiks. Sellega kaasnev kulu on mõõdukas ning meetod on patsiendile hästi talutav.
Harvade KVA paroksüsmide kahtluse ja krüptogeense ajuinfarkti või TIA või arteriaalse trombemboolia anamneesiga patsientide puhul pidas töörühm põhjendatuks kasutada pikemaajalist rütmijälgimist, kuna on tõendatud selle diagnostiline kasu ning mõju patsiendi edasisele käsitlusele. Töörühm tõdes, et nende meetodite kättesaadavus Eestis varieerub ja mõnega neist (implanteeritav rütmivalvur) kaasneb oluline ressursikulu. Seetõttu võib olla põhjendatud nende kasutamine eelkõige väga suure embooliariskiga patsientidel.
Kaasaegsed südamestimulaatorid registreerivad kodade kiire kontraktsioonisageduse perioode ning mitmed salvestavad ka nende intrakardiaalse EKG. Seetõttu soovitas töörühm stimulaatorite kontrollimisel pöörata tähelepanu episoodide dokumenteerimisele ja patsiendi nõustamisele edasiste tegevuste kohta.
Kui elektrilise südamestimulaatoriga patsiendi puhul on KVA esinemise kahtlus, sh kui on esinenud krüptogeenne ajuinfarkt või TIA või arteriaalne trombemboolia (või soovitakse hiljem sagedus- ja rütmikontrolli tõhusust hinnata), on soovitatav aktiivselt kasutada südamestimulaatori mälus olevaid andmeid.
Uuringus EMBRACE (N = 572, 19) jaotati hiljutise krüptogeense ajuinfarktiga patsiendid, kellel tavapärasel uuringul KVA‑d ei leitud, 24 tunni rütmijälgimise ning EKG‑d 30 päeva jooksul automaatselt registreeriva seadme rühma. 30‑päevase monitooringu rühmas leiti oluliselt rohkem KVA juhte (16% vs. 3%; p < 0,001) ning suukaudsete antikoagulantide kasutus kahekordistus.
Uuringus CRYSTAL AF (N = 441, 20) randomiseeriti krüptogeense ajuinfarktiga patsiendid pärast 24‑tunnist EKG jälgimist implanteeritava rütmivalvuri ja standardkäsitluse rühma.
Sekkumise rühmas leiti kuue kuuga rohkem KVA‑ga patsiente (8,9% vs. 1,4%, HR 6,4; 95% CI 1,9...21,7; p < 0,001). 12 kuu tulemused olid sarnased (12,4% vs. 2,0%, HR 7,3; 95% CI 2,6...20,8; p < 0,001).
Mitmes prospektiivses uuringus (21, 22, 19) selgus, et krüptogeense ajuinfarktiga patsiendid, kellel standardmeetodil KVA‑d ei leita, võivad saada diagnoosi kauakestvama (72 tundi ja enam) EKG jälgimise järel. Ilmnes ka trend, et mida vanem oli patsient, seda suurem oli diagnostiline kasu (21, 18).
Uuringud, mis hindasid pikema rütmijälgimise mõju kliinilistele tulemusnäitajatele ajuinfarkti sekundaarses preventsioonis, ei näidanud sellest olulist kasu (23).
Töörühm leidis, et on piisavalt hea kvaliteediga andmeid, mis kirjeldavad erinevate jälgimisperioodide mõju KVA tuvastamisele, ning mõõdukalt andmeid, mis näitavad, et KVA tuvastamisele järgneb patsiendi käsitluse muutus. Töörühm tõdes, et puuduvad andmed, mis viitavad otseselt korduva ajuinfarkti sageduse vähenemisele pikema rütmijälgimise tulemusena.
Töörühm pidas 24‑tunnist rütmijälgimist standardseks, laialdaselt kasutatavaks ning KVA sagedaste paroksüsmide puhul efektiivseks diagnoosimismeetodiks. Sellega kaasnev kulu on mõõdukas ning meetod on patsiendile hästi talutav.
Harvade KVA paroksüsmide kahtluse ja krüptogeense ajuinfarkti või TIA või arteriaalse trombemboolia anamneesiga patsientide puhul pidas töörühm põhjendatuks kasutada pikemaajalist rütmijälgimist, kuna on tõendatud selle diagnostiline kasu ning mõju patsiendi edasisele käsitlusele. Töörühm tõdes, et nende meetodite kättesaadavus Eestis varieerub ja mõnega neist (implanteeritav rütmivalvur) kaasneb oluline ressursikulu. Seetõttu võib olla põhjendatud nende kasutamine eelkõige väga suure embooliariskiga patsientidel.
Kaasaegsed südamestimulaatorid registreerivad kodade kiire kontraktsioonisageduse perioode ning mitmed salvestavad ka nende intrakardiaalse EKG. Seetõttu soovitas töörühm stimulaatorite kontrollimisel pöörata tähelepanu episoodide dokumenteerimisele ja patsiendi nõustamisele edasiste tegevuste kohta.
Kui elektrilise südamestimulaatoriga patsiendi puhul on KVA esinemise kahtlus, sh kui on esinenud krüptogeenne ajuinfarkt või TIA või arteriaalne trombemboolia (või soovitakse hiljem sagedus- ja rütmikontrolli tõhusust hinnata), on soovitatav aktiivselt kasutada südamestimulaatori mälus olevaid andmeid.
| 8 | Kui diagnoosite patsiendil KVA esimest korda, dokumenteerige kliinilised andmed ja tehke uuringud ning analüüsid vähemalt tabelis 4 näidatud ulatuses. Tehke sama juhul, kui patsiendil on KVA varem diagnoositud, ent neid andmeid ei ole seni dokumenteeritud. Töörühma praktiline soovitus. |
Tabel 4. KVA‑ga patsiendi uurimine
| Anamnees | Elu- ja pereanamnees ning tervist mõjutavad harjumused. Haiguse anamnees (sh kaasuvad haigused), kõik kasutatavad ja varem kasutatud ravimid (sh käsimüügiravimid) koos annustega, ravimite talumatus ja allergia. KVA esmakordse tekke aeg, KVA vorm, KVA esinemise aeg, vallandavad ja soodustavad tegurid (sh aeglane südametöö, raske füüsiline pingutus, alkoholi tarvitamine, suitsetamine, kõrge arteriaalne rõhk, äge kaasuv haigus jm), KVA sümptomid ja nende mõju patsiendi igapäevaelule. Viited südamepuudulikkusele (sh õhupuudustunne, ortopnoe, paroksüsmaalne öine düspnoe, koormustaluvuse vähenemine, väsimus, pahkluupiirkonna turse). |
| Läbivaatus | Kognitiivne seisund, kohapeal mõõdetud kehamass ja pikkus, KMI, vööümbermõõt. Südame löögisagedus, regulaarsus, toonid, patoloogilised kahinad, kopsude kuulatlus, arteriaalne rõhk, pulsid perifeersetel arteritel, kägiveenide täitumus, tursete olemasolu. Täielik muude organisüsteemide läbivaatus, sh kopsuhaigustele, neeruhaigustele, kilpnäärmehaigustele viitavate tunnuste olemasolu. |
| Uuringud | EKG: südame rütm ja löögisagedus, viited struktuursele südamehaigusele või ülekoormusele (hüpertroofia, isheemia, varasem müokardiinfarkt), viited elektrilisele südamehaigusele (erutustekke- ja juhtehäired, manifestne lisajuhtetee). TTE vajadusel: vt 9. soovitus. |
| Analüüsid | Hemogramm, naatrium, kaalium, kreatiniin ja eGFR (CKD‑EPI), TSH, ALAT, glükoos või HbA1c, LDL, vajadusel NT‑proBNP või BNP. |
Töörühm andis praktilise soovituse KVA esmakordseks diagnoosimiseks vajalike uuringute kohta, lähtudes rahvusvahelistest ravijuhenditest ja olulistest kliinilistest küsimustest, mis mõjutavad patsiendi edasist käsitlust, samuti soovist ühtlustada Eesti senist varieeruvat uurimis- ja dokumenteerimistava.
| 9 | Kui diagnoosite patsiendil KVA esimest korda ja plaanite siinusrütmi taastavat/säilitavat ravi või kahtlustate struktuurset südamehaigust või südamepuudulikkust, korraldage TTE‑uuring, kui seda ei ole viimase aasta jooksul tehtud. Tugev soovitus, madal tõendatus. |
TTE‑uuringu vajalikkuse hindamisel kasutatud kliinilised tulemusnäitajad olid KVA taasteke pärast edukat kardioversiooni, ajuinfarkt vm arteriaalne trombemboolia ning kardiovaskulaarsurm. Ühes süsteemses ülevaates summeeriti 29 kliinilise uuringu tulemused (24).
TTE‑ga mõõdetavate parameetrite võime suhtes KVA taasteket ennustada olid uuringute tulemused vastukäivad ega näidanud veenvalt ühegi sel uuringul mõõdetava parameetri ennustusvõimet. Mõned uuringud viitasid sellele, et vasaku koja väiksem diameeter võib ennustada siinusrütmi tõenäolisemat püsimist.
Kolm uuringut viitasid sellele, et vasaku vatsakese ehhokardiograafiliselt leitud süstoolne düsfunktsioon on insuldi ja arteriaalse trombemboolia sõltumatu ennustaja (vastavalt RR 2,5 (95% CI 1,5...4,4), p < 0,0012; RR 2,6 (95% CI 1,4...4,9), p = 0,0031 ja OR 1,8 (95% CI 1,2...2,7), p = 0,003). Üks uuring seda ei kinnitanud.
Kahe uuringu tulemuste alusel on vasaku vatsakese hüpertroofia insuldi ja arteriaalse trombemboolia sõltumatu ennustaja (vastavalt OR 2,8 (1,8...4,4), p = 0,000129 ja OR 6,56; p < 0,01). Üks uuring sellist seost ei näidanud.
Kardiovaskulaarsurma prognoosimise osas näitas üks uuring, et spontaanse ehhokontrasti alusel hinnatud vasaku koja hemodünaamiline düsfunktsioon oli KVA‑ga patsientidel kardiovaskulaarsurma (letaalse lõppega ajuinfarkt, müokardiinfarkt, südamepuudulikkus, emboolia või kardiaalne äkksurm) sõltumatu ennustaja (RR 7,96; 95% CI 1,6...41; p = 0,013).
Töörühm tõdes, et andmed selle kohta, kas ja millised TTE‑uuringul mõõdetud parameetrid võimaldavad usaldusväärselt prognoosida siinusrütmi taastamise edukust või siinusrütmi püsimist, on vastuolulised ning TTE ei anna olulist lisateavet trombemboolia riski kohta.
TTE‑d võib kasutada vasaku vatsakese düsfunktsiooni või hüpertroofia hindamiseks. Töörühm leidis, et TTE on väga sageli põhjendatud struktuurse südamehaiguse välistamiseks enne antiarütmilise ravi alustamist. Ka siis, kui antiarütmilist ravi ei tehta, on kasulik teada vasaku vatsakese funktsiooni, kuna südame löögisageduse aeglustamiseks kasutatavad mittedihüdropüridiinsed kaltsiumikanalite blokaatorid on vasaku vatsakese olulise süstoolse düsfunktsiooni puhul vastunäidustatud. Tahhükardiomüopaatia korral võimaldab TTE hinnata südame löögisageduse aeglustamise mõju vasaku vatsakese funktsioonile. Paljudel KVA‑ga patsientidel võib olla TTE-uuringuks ka lisanäidustusi.
TTE‑uuringuiks kulub nii rahalist kui ka ajalist ressurssi. TTE tegemine kõigil esmakordselt diagnoositud KVA juhtudel võib suurendada uuringute koguhulka kuni 10%. Uuring ei ole esmatasandi kontekstis odav.
Uuring on patsientidele ohutu ja vähekoormav, tõenäoliselt on patsiendid uuringuga pigem nõus, soovides välistada tõsist südamehaigust.
TTE‑ga mõõdetavate parameetrite võime suhtes KVA taasteket ennustada olid uuringute tulemused vastukäivad ega näidanud veenvalt ühegi sel uuringul mõõdetava parameetri ennustusvõimet. Mõned uuringud viitasid sellele, et vasaku koja väiksem diameeter võib ennustada siinusrütmi tõenäolisemat püsimist.
Kolm uuringut viitasid sellele, et vasaku vatsakese ehhokardiograafiliselt leitud süstoolne düsfunktsioon on insuldi ja arteriaalse trombemboolia sõltumatu ennustaja (vastavalt RR 2,5 (95% CI 1,5...4,4), p < 0,0012; RR 2,6 (95% CI 1,4...4,9), p = 0,0031 ja OR 1,8 (95% CI 1,2...2,7), p = 0,003). Üks uuring seda ei kinnitanud.
Kahe uuringu tulemuste alusel on vasaku vatsakese hüpertroofia insuldi ja arteriaalse trombemboolia sõltumatu ennustaja (vastavalt OR 2,8 (1,8...4,4), p = 0,000129 ja OR 6,56; p < 0,01). Üks uuring sellist seost ei näidanud.
Kardiovaskulaarsurma prognoosimise osas näitas üks uuring, et spontaanse ehhokontrasti alusel hinnatud vasaku koja hemodünaamiline düsfunktsioon oli KVA‑ga patsientidel kardiovaskulaarsurma (letaalse lõppega ajuinfarkt, müokardiinfarkt, südamepuudulikkus, emboolia või kardiaalne äkksurm) sõltumatu ennustaja (RR 7,96; 95% CI 1,6...41; p = 0,013).
Töörühm tõdes, et andmed selle kohta, kas ja millised TTE‑uuringul mõõdetud parameetrid võimaldavad usaldusväärselt prognoosida siinusrütmi taastamise edukust või siinusrütmi püsimist, on vastuolulised ning TTE ei anna olulist lisateavet trombemboolia riski kohta.
TTE‑d võib kasutada vasaku vatsakese düsfunktsiooni või hüpertroofia hindamiseks. Töörühm leidis, et TTE on väga sageli põhjendatud struktuurse südamehaiguse välistamiseks enne antiarütmilise ravi alustamist. Ka siis, kui antiarütmilist ravi ei tehta, on kasulik teada vasaku vatsakese funktsiooni, kuna südame löögisageduse aeglustamiseks kasutatavad mittedihüdropüridiinsed kaltsiumikanalite blokaatorid on vasaku vatsakese olulise süstoolse düsfunktsiooni puhul vastunäidustatud. Tahhükardiomüopaatia korral võimaldab TTE hinnata südame löögisageduse aeglustamise mõju vasaku vatsakese funktsioonile. Paljudel KVA‑ga patsientidel võib olla TTE-uuringuks ka lisanäidustusi.
TTE‑uuringuiks kulub nii rahalist kui ka ajalist ressurssi. TTE tegemine kõigil esmakordselt diagnoositud KVA juhtudel võib suurendada uuringute koguhulka kuni 10%. Uuring ei ole esmatasandi kontekstis odav.
Uuring on patsientidele ohutu ja vähekoormav, tõenäoliselt on patsiendid uuringuga pigem nõus, soovides välistada tõsist südamehaigust.
| 10 |
KVA diagnoosi vormistamisel:
Töörühma praktiline soovitus.
|
Töörühm tõdes, et KVA diagnoosi dokumenteerimine praktikas varieerub. Võttes arvesse minimaalselt vajalikke elemente, mis on arstide teabevahetuses olulised ja määravad patsiendi kliinilise käsitluse, peeti vajalikuks diagnoosis vähemalt KVA vormi (esmakordselt diagnoositud, paroksüsmaalne, persisteeruv, pikalt persisteeruv või permanentne), trombemboolia riskiskoori ja sümptomite olemasolu kirjeldamist.
KVA riskitegurite mõjutamine
| 11 | Selgitage KVA‑ga patsientidel välja kõik KVA‑d soodustavad elustiilitegurid (ülekaal, vähene füüsiline aktiivsus, alkoholitarbimine, suitsetamine), mida on võimalik mõjutada. Leppige kokku plaan nende mõjutamiseks ning eesmärgid. Tugev soovitus, madal tõendatus. |
|
| 12 | Kontrollige, kas patsiendil on kaasuvaid haigusi, mis soodustavad KVA teket (ülekaal, obstruktiivne uneapnoe, kõrgvererõhktõbi, suhkurtõbi, hüpertüreoos), ja vajaduse korral optimeerige nende ravi. Töörühma praktiline soovitus. |
|
| 13 | Sümptomaatilise KVA‑ga, hästimotiveeritud patsientidel võite lisaks kasutada riskitegurite ja kaasuvate haiguste intensiivset kompleksset mõjutamist elustiilimuudatuste, farmakoteraapia jt sekkumiste abil (vt joonis 1). Nõrk soovitus, madal tõendatus. |
Tervislik eluviis (KMI < 25 kg/m2, regulaarne treening ≥ 20 min ööpäevas, karskus või vähene alkoholitarbimine (≤ 2 ühiku(t) päevas meestel ja ≤ 1 ühik(u) päevas naistel) ning suitsetamisest hoidumine) on seotud KVA‑sse haigestumise väiksema riskiga (25).
Ühes randomiseeritud uuringus (26) leiti, et kehakaalu intensiivsele vähendamisele suunatud sekkumine vähendas KVA sümptomikoormust, sümptomite raskust, paroksüsmide arvu ja kogukestust võrreldes tavalise elustiilinõustamisega. Sekkumise rühmas saavutati kehakaalu vähenemine 14,3 kg, võrdlusrühmas 3,6 kg.
Randomiseeritud uuringute andmed kardiorespiratoorse võimekuse parandamise soodsa mõju kohta KVA tekkele, taastekkele ja tüsistustele puuduvad. 2017. aastal avaldatud Cochrane’i ülevaade treeningupõhisest kardioloogilisest taastusravist KVA puhul (27) leidis kuus lühikese jälgimisajaga randomiseeritud uuringut 421 patsiendil. Mõju elulemusele ei tuvastatud, kuna surmasid peaaegu ei esinenud. Ei selgunud ka erinevust raskete kõrvaltoimete ega elukvaliteedi osas. Sekkumine parandas füüsilist võimekust, ent tõenduse kvaliteet oli väga madal.
Kohortuuringus (N = 308, 28) 1415 järjestikusel KVA‑ga patsiendil (KMI ≥ 27) pakuti kõigile osalemist riskitegurite mõjutamise ja treeningu programmis (dieet, individualiseeritud koormusega treening, hüpertensiooni ravi optimeerimine, düslipideemia korrektsioon, glükoosi ainevahetuse, uneapnoe, alkoholi ja suitsetamise mõjutamine, vt joonis 1), neist 308 nõustus osalema. Hinnati KVA raskust (KVA raskusastmete skaala, ingl AF Severity Scale) ja KVA esinemist seitsmeööpäevase monitooringu alusel. Algne kardiorespiratoorne võimekus oli väike 95‑l, adekvaatne 134‑l ja suur 79 patsiendil ning see ennustas kehakaalust olenemata KVA puudumist uuringu lõpus (iga lisa-MET algses koormustaluvuses oli seotud KVA taastekkeriski 13% vähenemisega, HR 0,87, 95% CI 0,80...0,94; p < 0,001). Uuringu lõpus ei olnud KVA‑d 17%‑l väikese, 76%‑l adekvaatse ja 84%‑l suure kardiorespiratoorse võimekusega patsientidest (p < 0,001). Uuringu jooksul võrreldi võimekust kuni kahe MET‑i ning kahe või enama MET‑i võrra parandanud inimeste tulemusi: edukamal rühmal oli püsivam kehakaalu vähenemine, suurem vererõhulangus, lipiidiprofiili suurem muutus, väiksem vere glükoosisisaldus, väiksem CRP-hs‑i sisaldus. Ilma ablatsiooni ja antiarütmilise ravita KVA‑ta patsientide osakaal oli võimekust üle kahe MET‑i parandanute hulgas 61% ning kuni kaks MET‑i saavutanutel 18%, iga juurde saadud MET vähendas arütmia taastekke riski 9% (kohandatult kehakaalule ja algsele võimekusele). Uuringu lõpus oli arütmiavaba 89% kaks või enam MET-i vs. 40% alla kahe MET‑i juurde saavutanud patsientidest. Kardiorespiratoorse võimekuse paranemine ja kehakaalu vähenemine toimisid koosmõjus. Vähe kehakaalu vähendanud ning füüsilist võimekust suurendanud inimestest olid uuringu lõpus arütmiavabad 34% ning oluliselt kehakaalu vähendanud ning füüsilist võimekust suurendanud inimestest 94% (p < 0,001).
Sama autor on kohortuuringus (N = 165, 29) näidanud, et riskitegurite agressiivne mõjutamine on seotud KVA ablatsioonravi pikaajalise edukusega:
üksikprotseduuri järel olid arütmiavabad 32,9% riskitegurite mõjutamise rühma patsientidest ning 9,7% võrdlusrühma patsientidest (p < 0,001), korduvate ablatsioonide järgselt vastavalt 87,0% ja 17,8% (p < 0,001).
2016. aastal avaldatud süstemaatiline ülevaade vaatlusuuringutest (30) hõlmas kuut uuringut 205 094 osaleja ja 15 919 KVA juhuga. Iga võimekuse suurenemise MET vähendas kodade virvenduse riski 9% (RR 0,91; 95% CI 0,84...1,00; p = 0,05). Suurima ja väikseima füüsilise võimekusega inimeste KVA riski erinevus oli kahekordne (RR 0,51; 95% CI 0,28...0,91; p = 0,02), keskmise ja väikseima füüsilise võimekusega inimeste KVA riski erinevus oli 28% (RR 0,72; 95% CI 0,56...–0,93; p = 0,01).
Töörühm leidis, et KVA peamiste riskitegurite sedastamiseks on epidemioloogiliste uuringute andmeid piisavalt. Hoolimata randomiseeritud uuringute puudumisest leiti, et elustiilitegurite mõjutamine nõustamise käigus on põhjendatud kõigi patsientide puhul, kuna sellega ei kaasne märkimisväärset ressursikulu ja kasu on vähemalt tõenäoline.
Hiljutiste kohortuuringute tulemuste alusel otsustas töörühm soovitada hästimotiveeritud patsientide puhul intensiivset kompleksset elustiili ja riskitegurite alast sekkumist (vt joonis 1). Sellega ei pruugi kõik patsiendid nõustuda ja kuna kaasneb ressursikulu, on soovitatav sekkumine suunata patsientidele, kelle puhul on loota järjepidevat omapoolset panust.
Joonis 1. Riskitegurite ja kaasuvate haiguste kompleksne mõjutamine
Ühes randomiseeritud uuringus (26) leiti, et kehakaalu intensiivsele vähendamisele suunatud sekkumine vähendas KVA sümptomikoormust, sümptomite raskust, paroksüsmide arvu ja kogukestust võrreldes tavalise elustiilinõustamisega. Sekkumise rühmas saavutati kehakaalu vähenemine 14,3 kg, võrdlusrühmas 3,6 kg.
Randomiseeritud uuringute andmed kardiorespiratoorse võimekuse parandamise soodsa mõju kohta KVA tekkele, taastekkele ja tüsistustele puuduvad. 2017. aastal avaldatud Cochrane’i ülevaade treeningupõhisest kardioloogilisest taastusravist KVA puhul (27) leidis kuus lühikese jälgimisajaga randomiseeritud uuringut 421 patsiendil. Mõju elulemusele ei tuvastatud, kuna surmasid peaaegu ei esinenud. Ei selgunud ka erinevust raskete kõrvaltoimete ega elukvaliteedi osas. Sekkumine parandas füüsilist võimekust, ent tõenduse kvaliteet oli väga madal.
Kohortuuringus (N = 308, 28) 1415 järjestikusel KVA‑ga patsiendil (KMI ≥ 27) pakuti kõigile osalemist riskitegurite mõjutamise ja treeningu programmis (dieet, individualiseeritud koormusega treening, hüpertensiooni ravi optimeerimine, düslipideemia korrektsioon, glükoosi ainevahetuse, uneapnoe, alkoholi ja suitsetamise mõjutamine, vt joonis 1), neist 308 nõustus osalema. Hinnati KVA raskust (KVA raskusastmete skaala, ingl AF Severity Scale) ja KVA esinemist seitsmeööpäevase monitooringu alusel. Algne kardiorespiratoorne võimekus oli väike 95‑l, adekvaatne 134‑l ja suur 79 patsiendil ning see ennustas kehakaalust olenemata KVA puudumist uuringu lõpus (iga lisa-MET algses koormustaluvuses oli seotud KVA taastekkeriski 13% vähenemisega, HR 0,87, 95% CI 0,80...0,94; p < 0,001). Uuringu lõpus ei olnud KVA‑d 17%‑l väikese, 76%‑l adekvaatse ja 84%‑l suure kardiorespiratoorse võimekusega patsientidest (p < 0,001). Uuringu jooksul võrreldi võimekust kuni kahe MET‑i ning kahe või enama MET‑i võrra parandanud inimeste tulemusi: edukamal rühmal oli püsivam kehakaalu vähenemine, suurem vererõhulangus, lipiidiprofiili suurem muutus, väiksem vere glükoosisisaldus, väiksem CRP-hs‑i sisaldus. Ilma ablatsiooni ja antiarütmilise ravita KVA‑ta patsientide osakaal oli võimekust üle kahe MET‑i parandanute hulgas 61% ning kuni kaks MET‑i saavutanutel 18%, iga juurde saadud MET vähendas arütmia taastekke riski 9% (kohandatult kehakaalule ja algsele võimekusele). Uuringu lõpus oli arütmiavaba 89% kaks või enam MET-i vs. 40% alla kahe MET‑i juurde saavutanud patsientidest. Kardiorespiratoorse võimekuse paranemine ja kehakaalu vähenemine toimisid koosmõjus. Vähe kehakaalu vähendanud ning füüsilist võimekust suurendanud inimestest olid uuringu lõpus arütmiavabad 34% ning oluliselt kehakaalu vähendanud ning füüsilist võimekust suurendanud inimestest 94% (p < 0,001).
Sama autor on kohortuuringus (N = 165, 29) näidanud, et riskitegurite agressiivne mõjutamine on seotud KVA ablatsioonravi pikaajalise edukusega:
üksikprotseduuri järel olid arütmiavabad 32,9% riskitegurite mõjutamise rühma patsientidest ning 9,7% võrdlusrühma patsientidest (p < 0,001), korduvate ablatsioonide järgselt vastavalt 87,0% ja 17,8% (p < 0,001).
2016. aastal avaldatud süstemaatiline ülevaade vaatlusuuringutest (30) hõlmas kuut uuringut 205 094 osaleja ja 15 919 KVA juhuga. Iga võimekuse suurenemise MET vähendas kodade virvenduse riski 9% (RR 0,91; 95% CI 0,84...1,00; p = 0,05). Suurima ja väikseima füüsilise võimekusega inimeste KVA riski erinevus oli kahekordne (RR 0,51; 95% CI 0,28...0,91; p = 0,02), keskmise ja väikseima füüsilise võimekusega inimeste KVA riski erinevus oli 28% (RR 0,72; 95% CI 0,56...–0,93; p = 0,01).
Töörühm leidis, et KVA peamiste riskitegurite sedastamiseks on epidemioloogiliste uuringute andmeid piisavalt. Hoolimata randomiseeritud uuringute puudumisest leiti, et elustiilitegurite mõjutamine nõustamise käigus on põhjendatud kõigi patsientide puhul, kuna sellega ei kaasne märkimisväärset ressursikulu ja kasu on vähemalt tõenäoline.
Hiljutiste kohortuuringute tulemuste alusel otsustas töörühm soovitada hästimotiveeritud patsientide puhul intensiivset kompleksset elustiili ja riskitegurite alast sekkumist (vt joonis 1). Sellega ei pruugi kõik patsiendid nõustuda ja kuna kaasneb ressursikulu, on soovitatav sekkumine suunata patsientidele, kelle puhul on loota järjepidevat omapoolset panust.
Joonis 1. Riskitegurite ja kaasuvate haiguste kompleksne mõjutamine

Trombemboolia ennetus
| 14 | KVA‑ga patsiendi trombemboolia riski hindamiseks kasutage CHA2DS2‑VASc skoori (vt lisa 8). Tugev soovitus, kõrge tõendatus. |
KVA‑ga kaasneb arteriaalse trombemboolia (peamiselt ajuinfarkti) riski keskmiselt viiekordne suurenemine. Risk on heterogeenne ja sõltub mitmest riskitegurist (vanus, sugu, varasem ajuinfarkt või TIA, müokardiinfarkt, hüpertensioon, vasaku vatsakese süstoolne düsfunktsioon, perifeersete arterite ateroskleroos, diabeet, neerufunktsiooni halvenemine jt).
Riski kvantifitseerimine on oluline, et otsustada, kes saab antikoagulantravist kasu ning kellel on trombemboolia risk nii väike, et ei õigusta antikoagulatsiooni võimalikke kõrvaltoimeid. Riski kvantifitseerimiseks on loodud töövahendeid (riskiskoore), mida on valideeritud ja võrreldud kohortuuringuis ja nende süstemaatilistes ülevaadetes.
Töörühm lähtus NICE 2014 juhendi (24) tarvis tehtud süsteemsest ülevaatest. Kuna jätkuvalt püütakse välja töötada uusi riskihindamise vahendeid, tegi sekretariaat ka pärast NICE ülevaadet avaldatud kirjanduse otsingu. Töörühm leidis ühe uuema analüüsi, mis kinnitas NICE ülevaate järeldusi (31), ühe ATRIA skooringusüsteemi hindava uuringu (32), mille tulemus oli vastuolus kahe varasemaga, ning publikatsiooni uue, biomarkereid kaasava ABC insuldiskoori valideerimisest, mille kohta on andmeid seni vähe ning mis võib olla marginaalselt täpsem senistest (33).
NICE süsteemne ülevaade leidis 11 kohortuuringut ning kaasas need, kus esines üle 100 ajuinfarkti. Tulemusi riskitiheduste suhtena (HR) väljendades hinnati, kui palju erineb insuldirisk ühe või teise meetodiga tekitatud riskikategooriate vahel. Toodi välja ka c‑statistik, mis näitab keskmist tõenäosust, et skooringusüsteem teeb vahet väikese ja suure riskiga indiviidide vahel. NICE tegi ka kulutõhususe analüüsi, mille keskmes oli kahe Ühendkuningriigis kasutatava skoori (CHADS2 ja CHA2DS2-VASc) võrdlus.
Kokkuvõttes leiti järgmist.
Riski kvantifitseerimine on oluline, et otsustada, kes saab antikoagulantravist kasu ning kellel on trombemboolia risk nii väike, et ei õigusta antikoagulatsiooni võimalikke kõrvaltoimeid. Riski kvantifitseerimiseks on loodud töövahendeid (riskiskoore), mida on valideeritud ja võrreldud kohortuuringuis ja nende süstemaatilistes ülevaadetes.
Töörühm lähtus NICE 2014 juhendi (24) tarvis tehtud süsteemsest ülevaatest. Kuna jätkuvalt püütakse välja töötada uusi riskihindamise vahendeid, tegi sekretariaat ka pärast NICE ülevaadet avaldatud kirjanduse otsingu. Töörühm leidis ühe uuema analüüsi, mis kinnitas NICE ülevaate järeldusi (31), ühe ATRIA skooringusüsteemi hindava uuringu (32), mille tulemus oli vastuolus kahe varasemaga, ning publikatsiooni uue, biomarkereid kaasava ABC insuldiskoori valideerimisest, mille kohta on andmeid seni vähe ning mis võib olla marginaalselt täpsem senistest (33).
NICE süsteemne ülevaade leidis 11 kohortuuringut ning kaasas need, kus esines üle 100 ajuinfarkti. Tulemusi riskitiheduste suhtena (HR) väljendades hinnati, kui palju erineb insuldirisk ühe või teise meetodiga tekitatud riskikategooriate vahel. Toodi välja ka c‑statistik, mis näitab keskmist tõenäosust, et skooringusüsteem teeb vahet väikese ja suure riskiga indiviidide vahel. NICE tegi ka kulutõhususe analüüsi, mille keskmes oli kahe Ühendkuningriigis kasutatava skoori (CHADS2 ja CHA2DS2-VASc) võrdlus.
Kokkuvõttes leiti järgmist.
- Mõõduka kvaliteediga tõendus, et
- CHA2DS2‑VASc‑d kasutades oli trombemboolia HR 2,2...2,69 neil patsientidel, kellel oli CHADS2 skoor 1.
- Kõrge kvaliteediga tõendus, et
- CHADS2 skoori kasutades oli insuldi HR 1,48 (pideva tunnusena) ja 2,44 (kui kasutati kolme riskigruppi);
- trombemboolia HR oli ACCP skoori puhul 2,59; ACC/AHA/ESC skoori puhul 2,59; CHADS2 skoori puhul 2,27...2,51 ja CHA2DS2‑VASc skoori puhul 3,74.
- Mõõduka kvaliteediga tõendus, et
- trombemboolia c‑statistik antikoaguleerimata patsientidel oli ACCP skoori puhul 0,60 (st kesine).
- Madala kuni mõõduka kvaliteediga tõendus, et
- trombemboolia c‑statistik oli CHA2DS2‑VASc skoori puhul 0,56...0,85 (kesine kuni hea, seitse uuringut);
- trombemboolia c‑statistik oli CHADS2 skoori puhul 0,61...0,72 (kesine kuni rahuldav, üheksa uuringut).
- Kulutõhususanalüüs (üldine antikoagulatsiooni kulutõhususe mudel) näitas, et CHA2DS2‑VASc skoori kasutamine antikoagulatsioonivajaduse hindamisel on rahaliselt marginaalselt soodsam kui CHADS2 skoori kasutamine.
Töörühm võttis soovitust andes arvesse CHA2DS2‑VASc skoori mõõdukaid eeliseid eespool viidatud uuringuis ning selle levinud kasutamist Eestis. Lisas 8 on esitatud CHA2DS2‑VASc skoorid KVA‑ga patsiendi trombemboolia riski hindamiseks.
| 15 | Hinnake KVA‑ga patsiendi verejooksuriski enne antikoagulantravi alustamist ja regulaarselt ravi ajal, dokumenteerige, korrigeerige mõjutatavaid riskitegureid. Töörühma praktiline soovitus. |
|
| 16 | KVA‑ga patsiendi verejooksuriski hindamiseks võite kasutada HAS‑BLED‑i skoori (vt lisa 9). Nõrk soovitus, madal tõendatus. Nõrk soovitus, madal tõendatus. |
Põhiline teave verejooksuriski hindamise vahendite kohta tuleneb NICE 2014 ravijuhendi (24) koostamise käigus tehtud ülevaatest, mis hõlmas 17 uuringut. Peamine tulemusnäitaja oli olulise veritsuse HR. Nihke (ingl bias) vähendamiseks tulemustes toodi nendes uuringutes, kus hinnati üle 100 veritsusepisoodi, välja HR‑i mediaan ja CI. Iga uuringu kohta esitati ROC‑kõvera alune pindala (ingl area under the receiver operating characteristic curve) (c‑statistikuna). ROC‑kõvera alune pindala kirjeldab antud kontekstis skoori prognostilist täpsust olulise veritsuse tekkeriski eristamiseks erinevate kategooriate patsientidel. NICE kasutas ROC‑kõvera aluse pindala kohta järgmisi kriteeriume: < 0,5 halvem kui juhus; 0,5...0,6 kesine skoor; 0,61...0,7 puudulik skoor; 0,71...0,80 rahuldav skoor; 0,81...0,90 hea skoor; 0,91...1,0 väga hea skoor.
Kokkuvõttes leiti järgmist.
- Keskmise kvaliteediga tõendus kuuest uuringust näitas c‑statistikut HAS‑BLED‑i skoori kohta vahemikus 0,6...0,795, mis tähistab puuduliku ja rahuldava kvaliteediga meetodeid.
- Hea kvaliteediga tõendus ühest uuringust näitas ATRIA skoori kohta c‑statistikut 0,6.
- Keskmise kvaliteediga tõendus neljast uuringust näitas c‑statistikut HEMORR2HAGES‑i skoori kohta vahemikus 0,59...0,782.
- Hea kvaliteediga tõendus kahest uuringust näitas c‑statistikut CHADS2 skoori kohta vahemikus 0,51...0,59.
Võrreldes suure riski kategooriat väikese riski kategooriaga oli veritsuse tekke HR‑i mediaan HAS‑BLED‑i skoori kohta 3,57 (mõõdukas tõenduse kvaliteet), HEMORR2HAGES‑i skoori kohta 2,90 (madal tõenduse kvaliteet) ja ATRIA skoori kohta 2,48 (kõrge tõenduse kvaliteet). Need võrdlused tehti ühe uuringupatsientide rühma kohta ja nende põhjal leiti, et HAS‑BLED‑i skoor oli erineva riskiga rühmade eristamiseks kõige parem.
Pärast NICE ravijuhendi ülevaate koostamist on avaldatud järgmised andmed.
Pärast NICE ravijuhendi ülevaate koostamist on avaldatud järgmised andmed.
- Uuringu ORBIT skoor (1 punkt: vanus > 75 a, eGFR < 60 ml/min/1,73 m2, antiagregandi kasutamine; 2 punkti: verejooksu anamnees, aneemia või hemoglobiin < 130 g/l meestel ja < 120 g/l naistel). Ka see ei ületanud HAS‑BLED‑i näitajaid (34).
- Uuringud biomarkereid kaasava ABC‑skoori kohta, millesse kaasatud kasvu diferentseerimisfaktor 15 (ingl growth differentiation factor‑15, GDF‑15) ei ole rutiinselt laboris määratav (35).
Töörühm pidas verejooksuriski hindamist antikoagulantravi alustamise eel ning ravi ajal väga oluliseks. Lisaks veritsusriski hindamisele saab mõnda veritsuse riskitegurit, eelkõige arteriaalset rõhku, INR‑i stabiilsust, kaasuvat farmakoteraapiat ning alkoholi kasutamist, ravi ajal mõjutada.
Töörühm pidas verejooksuriski hindamist antikoagulantravi alustamise eel ning ravi ajal väga oluliseks. Lisaks veritsusriski hindamisele saab mõnda veritsuse riskitegurit, eelkõige arteriaalset rõhku, INR‑i stabiilsust, kaasuvat farmakoteraapiat ning alkoholi kasutamist, ravi ajal mõjutada.
Töörühm leidis, et ühe või teise veritsusriski hindamise skoori tugevaks eelistamiseks on tõendus vähene, kõik laialdasemalt kasutatavad skoorid olid ligikaudu võrdsed. Kuna Euroopa Kardioloogide Seltsi ravijuhend (7) soovitab kasutada HAS‑BLED‑i skoori (hüpertensioon, neeru- või maksafunktsiooni häire, insult, veritsus anamneesis, labiilne INR, vanus > 65 a, veritsusriski suurendavad ravimid või alkohol), otsustati anda nõrk soovitus selle kasutamiseks ka Eestis. Lisas 9 on esitatud HAS‑BLED‑i skoorid KVA‑ga patsiendi veritsusriski hindamiseks.
Töörühm pidas verejooksuriski hindamist antikoagulantravi alustamise eel ning ravi ajal väga oluliseks. Lisaks veritsusriski hindamisele saab mõnda veritsuse riskitegurit, eelkõige arteriaalset rõhku, INR‑i stabiilsust, kaasuvat farmakoteraapiat ning alkoholi kasutamist, ravi ajal mõjutada.
Töörühm leidis, et ühe või teise veritsusriski hindamise skoori tugevaks eelistamiseks on tõendus vähene, kõik laialdasemalt kasutatavad skoorid olid ligikaudu võrdsed. Kuna Euroopa Kardioloogide Seltsi ravijuhend (7) soovitab kasutada HAS‑BLED‑i skoori (hüpertensioon, neeru- või maksafunktsiooni häire, insult, veritsus anamneesis, labiilne INR, vanus > 65 a, veritsusriski suurendavad ravimid või alkohol), otsustati anda nõrk soovitus selle kasutamiseks ka Eestis. Lisas 9 on esitatud HAS‑BLED‑i skoorid KVA‑ga patsiendi veritsusriski hindamiseks.
| 17 | Kui CHA2DS2‑VASc ≥ 2, määrake KVA‑ga patsiendile trombemboolia vältimiseks antikoagulantravi (vt lisa 8). Tugev soovitus, kõrge tõendatus. |
|
| 18 | Kui CHA2DS2‑VASc = 1, kaaluge KVA‑ga patsiendile trombemboolia vältimiseks antikoagulantravi määramist, võttes arvesse verejooksuriski. Nõrk soovitus, madal tõendatus. |
|
| 19 | Ärge määrake pikaajalist antikoagulantravi trombemboolia riskiteguriteta KVA‑ga patsiendile (kui CHA2DS2‑VASc = 0). Tugev soovitus, kõrge tõendatus. |
Antikoagulantravi elulemust parandav ja trombemboolia riski vähendav toime (suhteline riski vähenemine 60%) on hästi teada ja kirjeldatud K‑vitamiini antagonistide uuringute alusel (36). Hästi on teada ka kõrvaltoimena esinev verejooksu risk. Iga patsiendi puhul on oluline hinnata trombemboolia riski, et otsustada, kas antikoagulantravist saadav kasu, st trombemboolia riski vähendav toime, ületab veritsusriski suurenemisest tingitud kahju.
Antikoagulantravi alustamist õigustava ajuinfarktiriski alampiiri uuringus (37) oli Markovi mudeli järgi K‑vitamiini antagonistide kasutamine netokasulik ajuinfarkti 1,7% aastase riski puhul ning OSAK‑i kasutamine 0,9% riski puhul.
Hiljutised uuringud on viidanud, et varasemate kohortuuringute alusel antud hinnangud erineva CHA2DS2‑VASc skooriga patsientide ajuinfarktiriskile võivad olla ebatäpsed, st kuna insuldirisk populatsioonis langeb, väheneb see ka erinevates CHA2DS2‑VASc riskikategooriates (38).
Metaanalüüsi (39) hinnang ajuinfarkti aastasele riskile oli CHA2DS2‑VASc skoori = 1 puhul 1,61% ning CHA2DS2‑VASc skoori = 2 puhul 2,49%. Pärast metaanalüüsi Ühendkuningriigis avaldatud uuringus (40) leiti, et ajuinfarkti haigestumus CHA2DS2‑VASc skooriga = 1 rühmas oli 0,6 ning CHA2DS2‑VASc skoori = 2 puhul 1,2 juhtu 100 patsientaasta kohta. Veel ühe uuringu (32) hinnangud muutunud insuldiriskile on esitatud tabelis 5.
Tabel 5. Ajuinfarktid 100 patsientaasta kohta CHA2DS2‑VASc algses ja 2015. a kohordis
Antikoagulantravi alustamist õigustava ajuinfarktiriski alampiiri uuringus (37) oli Markovi mudeli järgi K‑vitamiini antagonistide kasutamine netokasulik ajuinfarkti 1,7% aastase riski puhul ning OSAK‑i kasutamine 0,9% riski puhul.
Hiljutised uuringud on viidanud, et varasemate kohortuuringute alusel antud hinnangud erineva CHA2DS2‑VASc skooriga patsientide ajuinfarktiriskile võivad olla ebatäpsed, st kuna insuldirisk populatsioonis langeb, väheneb see ka erinevates CHA2DS2‑VASc riskikategooriates (38).
Metaanalüüsi (39) hinnang ajuinfarkti aastasele riskile oli CHA2DS2‑VASc skoori = 1 puhul 1,61% ning CHA2DS2‑VASc skoori = 2 puhul 2,49%. Pärast metaanalüüsi Ühendkuningriigis avaldatud uuringus (40) leiti, et ajuinfarkti haigestumus CHA2DS2‑VASc skooriga = 1 rühmas oli 0,6 ning CHA2DS2‑VASc skoori = 2 puhul 1,2 juhtu 100 patsientaasta kohta. Veel ühe uuringu (32) hinnangud muutunud insuldiriskile on esitatud tabelis 5.
Tabel 5. Ajuinfarktid 100 patsientaasta kohta CHA2DS2‑VASc algses ja 2015. a kohordis
| Skoor | Juhte 100 patsientaasta kohta | |
| CHA2DS2‑VASc algne kohort | 2015. a kohort | |
| 0 | 0 | 0,38 |
| 1 | 1,3 | 0,78 |
| 2 | 2,2 | 1,92 |
| 3 | 3,2 | 2,84 |
| 4 | 4,0 | 3,70 |
| 5 | 6,7 | 5,08 |
| 6 | 9,8 | 7,09 |
| 7 | 9,6 | 8,98 |
| 8 | 6,7 | 9,01 |
| 9 | 15,2 | 15,49 |
Hiljutises mittesüsteemses ülevaates summeeriti arstide ja patsientide eelistuste uuringud. Selgus, et arstide peamine mure on ravist tingitud verejooks, ent patsientide jaoks on see alles viiendal kohal pärast ravimi ja toidu koostoimeid, toime kiire antagoniseerimise võimalust, ravimi kliinilist kasutuskogemust ja analüüside andmise vajadust (41). Teine uuring viitas, et patsiendid eelistavad kogeda pigem nelja olulist verejooksu kui ühte ajuinfarkti ning ravi aktsepteerimise alampiir oli ajuinfarkti absoluutse riski vähenemine 0,8% võrra (42).
Töörühm pidas oluliseks nii antikoagulantravi määramist trombemboolia suure riskiga patsientidele kui ka antikoagulantravi vältimist patsientidel, kel veritsusrisk ületab insuldiriski.
Tõdeti, et CHA2DS2‑VASc skoori moodustavate riskitegurite kaal on erinev, st naissugu on skoori kaasatud riskiteguritest nõrgim ajuinfarkti ennustaja ega ole ainsana enamasti piisav antikoagulantravi soovitamiseks. Samas pidas töörühm väga oluliseks, et ravijuhendi soovituse sõnastus oleks lihtne.
Töörühm võttis arvesse madala kvaliteediga tõendust, et arstide ja patsientide eelistused ning soov võtta antikoagulantraviga seoses riske võivad erineda.
Töörühm soovitas CHA2DS2‑VASc skoori väärtuse 2 või enam puhul kasutada antikoagulatsiooni ja CHA2DS2‑VASc skoori 1 puhul kaaluda antikoagulatsiooni, võttes arvesse olemasoleva riskiteguri kaalu ning patsiendi veritsusriski. Töörühm soovitas mitte kasutada pikaajalist antikoagulatsiooni trombemboolia väga väikese riski puhul, kuna siin ületab veritsusest tingitud oht kasu.
Töörühm pidas oluliseks nii antikoagulantravi määramist trombemboolia suure riskiga patsientidele kui ka antikoagulantravi vältimist patsientidel, kel veritsusrisk ületab insuldiriski.
Tõdeti, et CHA2DS2‑VASc skoori moodustavate riskitegurite kaal on erinev, st naissugu on skoori kaasatud riskiteguritest nõrgim ajuinfarkti ennustaja ega ole ainsana enamasti piisav antikoagulantravi soovitamiseks. Samas pidas töörühm väga oluliseks, et ravijuhendi soovituse sõnastus oleks lihtne.
Töörühm võttis arvesse madala kvaliteediga tõendust, et arstide ja patsientide eelistused ning soov võtta antikoagulantraviga seoses riske võivad erineda.
Töörühm soovitas CHA2DS2‑VASc skoori väärtuse 2 või enam puhul kasutada antikoagulatsiooni ja CHA2DS2‑VASc skoori 1 puhul kaaluda antikoagulatsiooni, võttes arvesse olemasoleva riskiteguri kaalu ning patsiendi veritsusriski. Töörühm soovitas mitte kasutada pikaajalist antikoagulatsiooni trombemboolia väga väikese riski puhul, kuna siin ületab veritsusest tingitud oht kasu.
Antikoagulandi valik
| 20 | Tutvustage patsiendile kõiki antikoagulante ja ravimit valides võtke arvesse patsiendi eelistust. Töörühma praktiline soovitus. |
|
| 21 | KVA‑ga patsiendile antikoagulanti valides võite veritsuste väiksema riski tõttu eelistada OSAK‑it (trombiini või Xa‑faktori inhibiitorit). Nõrk soovitus, tugev tõendatus. |
|
| 22 | Kui KVA‑ga patsient saab juba ravi K‑vitamiini antagonistiga (varfariin) ja ≥ 70% kontrollimistest vastab INR eesmärkväärtusele, ei ole vaja ravi vahetada. Töörühma praktiline soovitus. |
Põhiline kliiniline tõendus tuleneb NICE tehnoloogiahindamise aruannetest dabigatraani, rivaroksabaani ning apiksabaani kohta võrreldes varfariiniga (43, 44, 45). Need on olnud aluseks ka NICE 2014. aasta ravijuhendi (24) koostamisel. Siin juhendis esitatud uuringutulemused põhinevad ravimiomaduste kinnitatud kokkuvõtetel.
Lisaks tegime kirjanduse otsingu alates 2014. a avaldatud metaanalüüside kohta, mis käsitlevad randomiseeritud võrdlusi OSAK‑ite ja K‑vitamiini antagonistide vahel (kuna Eesti kulutõhususe analüüsi sisendid pärinevad 2013. aastast).
Leitud ülevaated põhinesid samadel kliinilistel uuringutel, mis olid NICE ravijuhendi aluseks, ning jõudsid võrreldavatele järeldustele.
Dabigatraan
Andmed kliinilise efektiivsuse ja ohutuse kohta võrreldes varfariiniga pärinevad hea kvaliteediga uuringust RE‑LY. See oli topeltpime randomiseeritud uuring dabigatraaneteksilaadi kahe annusega (110 mg ja 150 mg kaks korda ööpäevas), mida võrreldi varfariiniga. Kokku randomiseeriti 18 113 patsienti, kelle keskmine vanus oli 71,5 aastat ja keskmine CHADS2 skoor oli 2,1. Varfariini patsientidel saavutati TTR 67%‑l mõõtmistest. Peamised tulemused on esitatud tabelis 6.
Rivaroksabaan
Andmed kliinilise efektiivsuse ja ohutuse kohta võrreldes varfariiniga pärinevad hea kvaliteediga topeltpimedast randomiseeritud uuringust ROCKET AF, kus 14 264 patsienti randomiseeriti saama ööpäevas kas 20 mg rivaroksabaani või varfariini. Patsientide mediaanvanus oli 73 aastat ja keskmine CHADS2 skoor oli 3,5. Varfariini patsientidel saavutati TTR 55%‑l mõõtmistest. Peamised tulemused on esitatud tabelis 6.
Apiksabaan
Andmed kliinilise efektiivsuse ja ohutuse kohta võrreldes varfariiniga pärinevad hea kvaliteediga topeltpimedast randomiseeritud uuringust ARISTOTLE, kus 18 201 patsienti randomiseeriti saama ravi apiksabaaniga või varfariiniga. Patsientide mediaanvanus oli 70 aastat ja keskmine CHADS2 skoor oli 2,1. Varfariini patsientidel saavutati TTR 66%‑l mõõtmistest. Peamised tulemused on esitatud tabelis 6.
Tabel 6. OSAK‑itega tehtud kliiniliste uuringute peamised efektiivsus- ja ohutustulemused (7, kohandatud)
Lisaks tegime kirjanduse otsingu alates 2014. a avaldatud metaanalüüside kohta, mis käsitlevad randomiseeritud võrdlusi OSAK‑ite ja K‑vitamiini antagonistide vahel (kuna Eesti kulutõhususe analüüsi sisendid pärinevad 2013. aastast).
Leitud ülevaated põhinesid samadel kliinilistel uuringutel, mis olid NICE ravijuhendi aluseks, ning jõudsid võrreldavatele järeldustele.
Dabigatraan
Andmed kliinilise efektiivsuse ja ohutuse kohta võrreldes varfariiniga pärinevad hea kvaliteediga uuringust RE‑LY. See oli topeltpime randomiseeritud uuring dabigatraaneteksilaadi kahe annusega (110 mg ja 150 mg kaks korda ööpäevas), mida võrreldi varfariiniga. Kokku randomiseeriti 18 113 patsienti, kelle keskmine vanus oli 71,5 aastat ja keskmine CHADS2 skoor oli 2,1. Varfariini patsientidel saavutati TTR 67%‑l mõõtmistest. Peamised tulemused on esitatud tabelis 6.
Rivaroksabaan
Andmed kliinilise efektiivsuse ja ohutuse kohta võrreldes varfariiniga pärinevad hea kvaliteediga topeltpimedast randomiseeritud uuringust ROCKET AF, kus 14 264 patsienti randomiseeriti saama ööpäevas kas 20 mg rivaroksabaani või varfariini. Patsientide mediaanvanus oli 73 aastat ja keskmine CHADS2 skoor oli 3,5. Varfariini patsientidel saavutati TTR 55%‑l mõõtmistest. Peamised tulemused on esitatud tabelis 6.
Apiksabaan
Andmed kliinilise efektiivsuse ja ohutuse kohta võrreldes varfariiniga pärinevad hea kvaliteediga topeltpimedast randomiseeritud uuringust ARISTOTLE, kus 18 201 patsienti randomiseeriti saama ravi apiksabaaniga või varfariiniga. Patsientide mediaanvanus oli 70 aastat ja keskmine CHADS2 skoor oli 2,1. Varfariini patsientidel saavutati TTR 66%‑l mõõtmistest. Peamised tulemused on esitatud tabelis 6.
Tabel 6. OSAK‑itega tehtud kliiniliste uuringute peamised efektiivsus- ja ohutustulemused (7, kohandatud)
| Dabigatraan | Rivaroksabaan | Apiksabaan | |||||
| Uuring | RE‑LY | ROCKET AF | ARISTOTLE | ||||
| Randomiseeritud avatud uuring | Randomiseeritud topeltpime uuring | Randomiseeritud topeltpime uuring | |||||
| Osalejate arv | 18 113 | 14 264 | 18 201 | ||||
| Jälgimisperiood, a | 2 | 1,9 | 2,8 | ||||
| Võrdlus | Varfariini kohandatud annus vs. dabigatraan 150 või 110 mg 2 korda ööpäevas | Varfariini kohandatud annus vs. rivaroksabaan 20 mg üks kord ööpäevas | Varfariini kohandatud annus vs. apiksabaan 5 mg kaks korda ööpäevas | ||||
| Osalejate vanus, a | 71,5 ±8,7 (keskmine ±SD) | 73 (65...78) [mediaan (kvartiilide vahe)] | 70 (63...76) [mediaan (kvartiilide vahe)] | ||||
| Mehi, % | 63,6 | 60,3 | 64,5 | ||||
| CHADS2 skoor | 2,1 | 3,5 | 2,1 | ||||
| Varfariin | D 150 | D 110 | Varfariin | R | Varfariin | A | |
| Osalejate arv |
6022 | 6079 | 6015 | 7133 | 7131 | 9081 | 9120 |
| Tulemusnäitaja esinemise määr, %/a | Tulemusnäitaja esinemise määr, %/a (suhteline risk vs. varfariin) | Tulemusnäitaja esinemise määr, %/a | Tulemusnäitaja esinemise määr, %/a (HR vs. varfariin) | Tulemusnäitaja esinemise määr, %/a | Tulemusnäitaja esinemise määr, %/a (HR vs. varfariin) | ||
| Insult / süsteemne emboolia | 1,72 | 1,12 (0,65; 0,52...0,81) | 1,54 (0,89; 0,73...1,09) | 2,4 | 2,1 (0,88; 0,75...1,03) |
1,60 | 1,27 (0,79; 0,66...0,95) |
| Ajuinfarkt | 1,22 | 0,93 (0,76; 0,59...0,97) | 1,34 (1,1; 0,88...1,37) | 1,42 | 1,34 (0,94; 0,75...1,17) |
1,05 | 0,97 (0,92; 0,74...1,13) |
| Hemorraagiline insult | 0,38 | 0,10 (0,26; 0,14...0,49) | 0,12 (0,31; 0,17...0,56) | 0,44 | 0,26 (0,59; 0,37...0,93) |
0,47 | 0,24 (0,51; 0,35...0,75) |
| Raske verejooks | 3,61 | 3,40 (0,94; 0,82...1,08) | 2,92 (0,80; 0,70...0,93) | 3,45 | 3,60 (1,04; 0,90...2,30) |
3,09 | 2,13 (0,69; 0,60...0,80) |
| Intrakraniaalne verejooks | 0,77 | 0,32 (0,42; 0,29...0,61) | 0,23 (0,29; 0,19...0,45) | 0,74 | 0,49 (0,67; 0,47...0,93) |
0,80 | 0,33 (0,42; 0,30...0,58) |
| Raske seedetrakti verejooks | 1,09 | 1,60 (1,48; 1,19...1,86) | 1,13 (1,04; 0,82...1,33) | 1,24 | 2,00 (1,61; 1,30...1,99) | 0,86 | 0,76 (0,89; 0,66...1,17) |
| Müokardiinfarkt | 0,64 | 0,81 (1,27; 0,94...1,71) | 0,82 (1,29; 0,96...1,75) | 1,12 | 0,91 (0,81; 0,63...1,06) |
0,61 | 0,53 (0,88; 0,66...1,17) |
| Surm | 4,13 | 3,64 (0,88; 0,77...1,00) | 3,75 (0,91; 0,80...1,03) | 2,21 | 1,87 (0,85; 0,70...1,02) |
3,94 | 3,52 (0,89; 0,80...0,99) |
D – dabigatraan, R – rivaroksabaan, A - apiksabaan
Tabel 7. Antikoagulantide efektiivsus ja kõrvaltoimed varfariiniga võrreldes võrgustikmetaanalüüsi andmetel (47)
Tabel 7. Antikoagulantide efektiivsus ja kõrvaltoimed varfariiniga võrreldes võrgustikmetaanalüüsi andmetel (47)

Kulutõhusus
2014. aastal avaldati analüüs antikoagulantide kulutõhususe kohta Eestis KVA tüsistuste ennetamisel (6). Leiti, et dabigatraani lisakulu tõhususe määr varfariiniga võrreldes on 20 696 eurot ühe kvaliteedile kohandatud eluaasta kohta ning rivaroksabaanil 30 215 eurot ühe kvaliteedile kohandatud eluaasta kohta. Apiksabaan ei olnud siis veel Eestis kasutusel.
Tabel 8. 2014. a kulutõhususanalüüsi tulemused võrreldes varfariini ja ravi puudumisega
2014. aastal avaldati analüüs antikoagulantide kulutõhususe kohta Eestis KVA tüsistuste ennetamisel (6). Leiti, et dabigatraani lisakulu tõhususe määr varfariiniga võrreldes on 20 696 eurot ühe kvaliteedile kohandatud eluaasta kohta ning rivaroksabaanil 30 215 eurot ühe kvaliteedile kohandatud eluaasta kohta. Apiksabaan ei olnud siis veel Eestis kasutusel.
Tabel 8. 2014. a kulutõhususanalüüsi tulemused võrreldes varfariini ja ravi puudumisega
| Strateegia | ICER QALY kohta võrdluses varfariiniga | ICER QALY kohta võrdluses ravi puudumisega |
| Varfariin | - | 1923 |
| Dabigatraan | 20 696 | 7734 |
| Rivaroksabaan | 30 215 | 7970 |
Hindasime koos analüüsi autoritega analüüsi ajakohastamise vajadust. Selleks võrdlesime kasutatud kliinilisi sisendeid viimati avaldatud metaanalüüsidega (46, 47, 48).
Jõudsime järeldusele, et kliinilise efektiivsuse ja ohutuse hinnang põhineb jätkuvalt samade uuringute metaanalüüsidel ning erineb üksnes detailides. Kuna lisandunud on apiksabaan, uuendasime analüüsi, ajakohastatud kliinilise sisendi saime ravimite võrgustikmetanalüüsist (47, tabel 7).
Tabel 9. 2014. a kulutõhususanalüüsi kliinilised sisendid (mudeli sündmuste aastased esinemissagedused protsentides uuringu RE‑LY andmete põhjal)
Jõudsime järeldusele, et kliinilise efektiivsuse ja ohutuse hinnang põhineb jätkuvalt samade uuringute metaanalüüsidel ning erineb üksnes detailides. Kuna lisandunud on apiksabaan, uuendasime analüüsi, ajakohastatud kliinilise sisendi saime ravimite võrgustikmetanalüüsist (47, tabel 7).
Tabel 9. 2014. a kulutõhususanalüüsi kliinilised sisendid (mudeli sündmuste aastased esinemissagedused protsentides uuringu RE‑LY andmete põhjal)
| Sündmused | Varfariin | Dabigatraan 110/150 mg | Rivaroksabaan | Aspiriin | Ravi puudumine |
| Ajuinfarkt | 1,21 | 1,34/0,92 | 1,14 | 1,94 | 4,05 |
| Intrakraniaalne verejooks | 0,76 | 0,23/0,31 | 0,51 | 0,39 | 0,25 |
| Ekstrakraniaalne verejooks | 2,84 | 2,66/3,02 | 2,95 | 3,22 | 1,72 |
| Väike verejooks | 16,37 | 13,16/14,85 | 17,05 | 7,37 | 7,53 |
| Müokardiinfarkt | 0,6 | 0,82/0,81 | 0,52 | 0,90 | 1,00 |
Tabel 10. 2018. a ajakohastatud mudeli sündmuste aastased esinemissagedused (%, tabelis ümardatud) (47)
| Sündmus | Varfariin | Dabigatraan 110/150 mg | Rivaroksabaan | Apiksabaan | Aspiriin | Ravi puudumine |
| Ajuinfarkt | 1,21 | 1,09/0,79 | 1,05 | 0,96 | 1,94 | 4,05 |
| Koljusisene verejooks | 0,76 | 0,23/0,31 | 0,54 | 0,31 | 0,39 | 0,25 |
| Ekstrakraniaalne verejooks | 2,84 | 2,27/2,64 | 3,00 | 1,96 | 3,22 | 1,72 |
| Väike verejooks | 16,37 | 13,16/14,85 | 17,02 | 13,42 | 7,37 | 7,53 |
| Müokardiinfarkt | 0,64 | 0,82/0,81 | 0,59 | 0,56 | 0,9 | 1 |
Võrreldes 2014. aasta mudeliga on dabigatraani puhul sündmuste esinemissagedused vähenenud või jäänud samaks. Rivaroksabaani puhul on vähenenud insuldi esinemissagedus ning suurenenud intra- ja ekstrakraniaalse verejooksu ja müokardiinfarkti esinemissagedused
Tabel 11. Täiendkulu tõhususe määrad võrdluses varfariini ja ravi puudumisega 2018. a analüüsi alusel
Tabel 11. Täiendkulu tõhususe määrad võrdluses varfariini ja ravi puudumisega 2018. a analüüsi alusel
| Strateegia | ICER QALY kohta võrdluses varfariiniga |
ICER QALY kohta võrdluses ravi puudumisega |
| Varfariin | — | 2611 |
| Apiksabaan | 10 796 | 5645 |
| Dabigatraan | 12 401 | 6084 |
| Rivaroksabaan | 23 618 | 7055 |
Töörühm kaalus andmeid erinevate antikoagulantide efektiivsuse kohta ning leidis, et OSAK‑ite eelised hästi kontrolli all hoitud INR‑iga varfariinravi ees on vähesed. Tõdeti, et Eestis on varfariinravi harva optimaalne ning patsientidel puudub hea tugisüsteem. Leiti, et praktikas on tõenäoline OSAK‑ite parem keskmine tõhusus võrreldes varfariiniga, tulenevalt lihtsamast ravikorraldusest.
Töörühm leidis, et OSAK‑itel on selge eelis ohutuse seisukohast, kuna koljusisese verejooksu risk on kliiniliselt olulisel määral väiksem ning erinevus veritsusriskis on piisavalt suur, et tuua kaasa paremad üldsuremuse näitajad.
Töörühm eeldas, et patsiendid väärtustavad OSAK‑ite puhul lihtsamat ravijälgimist ning paremat ohutust võrreldes varfariiniga.
Töörühm märkis OSAK‑ite kõrget hinda, ent leidis nende kulutõhususe olevat aktsepteeritavas vahemikus. Nende ravimite laialdase kasutamise eelarvemõju on väga suur ning sellest tulenevalt loobuti tugeva soovituse andmisest nende eelistamiseks. Lisas 7 on esitatud antikoagulantravi alustamise ja jälgimise põhimõtted.
Töörühm leidis, et OSAK‑itel on selge eelis ohutuse seisukohast, kuna koljusisese verejooksu risk on kliiniliselt olulisel määral väiksem ning erinevus veritsusriskis on piisavalt suur, et tuua kaasa paremad üldsuremuse näitajad.
Töörühm eeldas, et patsiendid väärtustavad OSAK‑ite puhul lihtsamat ravijälgimist ning paremat ohutust võrreldes varfariiniga.
Töörühm märkis OSAK‑ite kõrget hinda, ent leidis nende kulutõhususe olevat aktsepteeritavas vahemikus. Nende ravimite laialdase kasutamise eelarvemõju on väga suur ning sellest tulenevalt loobuti tugeva soovituse andmisest nende eelistamiseks. Lisas 7 on esitatud antikoagulantravi alustamise ja jälgimise põhimõtted.
| 23 | Mehaanilise klapiproteesi või hemodünaamiliselt olulise mitraalstenoosi puhul kasutage KVA‑ga patsiendil antikoagulatsiooniks K‑vitamiini antagoniste (nt varfariini). Tugev soovitus, kõrge tõendatus. |
|
| 24 | Ärge kasutage mehaanilise klapiproteesi puhul KVA‑ga patsiendil antikoagulatsiooniks otsese toimega suukaudset antikoagulanti (trombiini või Xa‑faktori inhibiitorit). Tugev soovitus, mõõdukas tõendatus. |
Mehaanilise klapiproteesi ja hemodünaamiliselt olulise mitraalstenoosiga patsiendid jäeti välja kõigi kolme Eestis kasutatava OSAK‑i virvendusarütmia uuringust (49, 50, 51, 52). Uuringutesse oli kaasatud ka muude klapiriketega patsiente (mitraalregurgitatsioon, aordiklapi regurgitatsioon, aordiklapi stenoos, mitraalklapi prolaps).
Ainult dabigatraaniga on tehtud uuring mehaanilise klapiproteesiga patsientidel (53), Xa‑faktori inhibiitorite kohta uuringud puuduvad.
Uuringus RE‑ALIGN võrreldi dabigatraani ja varfariini 12 nädala jooksul kahes patsiendirühmas: viimase seitsme päeva jooksul aordi- või mitraalklapi proteesimise operatsiooni läbinud patsientidel ja vähemalt kolm kuud varem sama operatsiooni läbinutel.
Uuring katkestati pärast 252 patsiendi uuringusse kaasamist (168 dabigatraanirühmas, 84 varfariinirühmas), kuna dabigatraani saanud patsientidel esines rohkem trombemboolilisi ja veritsustega seotud tüsistusi.
Ainult dabigatraaniga on tehtud uuring mehaanilise klapiproteesiga patsientidel (53), Xa‑faktori inhibiitorite kohta uuringud puuduvad.
Uuringus RE‑ALIGN võrreldi dabigatraani ja varfariini 12 nädala jooksul kahes patsiendirühmas: viimase seitsme päeva jooksul aordi- või mitraalklapi proteesimise operatsiooni läbinud patsientidel ja vähemalt kolm kuud varem sama operatsiooni läbinutel.
Uuring katkestati pärast 252 patsiendi uuringusse kaasamist (168 dabigatraanirühmas, 84 varfariinirühmas), kuna dabigatraani saanud patsientidel esines rohkem trombemboolilisi ja veritsustega seotud tüsistusi.
- Ajuinfarkti või täpsustamata insulti esines dabigatraanirühmas üheksal (5%) patsiendil, varfariinirühmas insulti ei esinenud.
- Asümptomaatiline klapitromboos esines viiel (3%) patsiendil dabigatraanirühmas ja varfariinirühmas seda ei esinenud.
- Verejooks esines 45 (27%) dabigatraanirühma ning 10 (12%) varfariinirühma patsiendil. Veritsuste sagedus oli dabigatraaniga suurem nii varajase kui ka hilise postoperatiivse antikoagulatsiooni puhul.
- Oluline verejooks esines vastavalt seitsmel (4%) ja kahel patsiendil (2%). Kõik olulise verejooksu juhtumid olid verejooksud perikardiõõnde ja esinesid varajase postoperatiivse antikoagulatsiooni rühmas.
- Üks patsient dabigatraanirühmas ja kaks patsienti varfariinirühmas surid.
Töörühm leidis, et K‑vitamiini antagonistide toime ja ohutus on pikaajalise kliinilise kasutamise järel mehaanilise klapiproteesiga patsientidel hästi teada. K‑vitamiini antagonistide suurim risk on intrakraniaalne hemorraagia, mille sagedus on OSAK‑ite uuringuis olnud madalam. Ohutuseelise eeldus on sarnane kliiniline efektiivsus trombemboolia ennetuses.
Töörühm leidis, et olemasolevad andmeid näitavad, et dabigatraan on mehaanilise klapiproteesiga patsientidel vähem efektiivne kui K‑vitamiini antagonistid. Uuringu andmed viitavad ka suuremale veritsusriskile.
Kuigi muude OSAK‑itega ei ole uuringuid tehtud, viitab dabigatraaniuuring sellele, et koagulatsiooni ja hemostaasi regulatsioon on neil patsientidel oluliselt erinev teistest KVA‑ga patsientidest ning seniste uuringute tulemusi neile laiendada ei saa.
Töörühm pidas põhjendatuks eristada mehaanilise klapiproteesiga patsiente ja hemodünaamiliselt olulise mitraalstenoosiga patsiente, kuna esimeste puhul on kliinilises uuringus selgelt näidatud OSAK‑i kasutamise ohtlikkust, teise rühma puhul lähtuti andmete puudumisest kasu/riski suhte kohta.
Töörühm leidis, et olemasolevad andmeid näitavad, et dabigatraan on mehaanilise klapiproteesiga patsientidel vähem efektiivne kui K‑vitamiini antagonistid. Uuringu andmed viitavad ka suuremale veritsusriskile.
Kuigi muude OSAK‑itega ei ole uuringuid tehtud, viitab dabigatraaniuuring sellele, et koagulatsiooni ja hemostaasi regulatsioon on neil patsientidel oluliselt erinev teistest KVA‑ga patsientidest ning seniste uuringute tulemusi neile laiendada ei saa.
Töörühm pidas põhjendatuks eristada mehaanilise klapiproteesiga patsiente ja hemodünaamiliselt olulise mitraalstenoosiga patsiente, kuna esimeste puhul on kliinilises uuringus selgelt näidatud OSAK‑i kasutamise ohtlikkust, teise rühma puhul lähtuti andmete puudumisest kasu/riski suhte kohta.
| 25 | Ärge kasutage KVA‑ga patsiendil trombemboolia profülaktikaks antiagregantravi, kui selle kasutamiseks ei ole muid näidustusi. Tugev soovitus, mõõdukas tõendatus. |
Trombemboolia keskmise riskiga patsientide vanemates uuringutes oli suhtelise riski vähenemine atsetüülsalitsüülhappega 20...25% ning veritsusrisk väike (54).
Hilisemas uuringus (55) oli atsetüülsalitsüülhappe veritsusrisk võrreldav K‑vitamiini antagonisti omaga: insulti, intrakraniaalset verejooksu ja arteriaalset embooliat esines 1,8% aastas varfariini ja 3,8% atsetüülsalitsüülhapperühmas (RR 0,48, 95% CI 0,28...0,80; p = 0,003), ekstrakraniaalseid verejookse esines 1,4% varfariini- ja 1,6% ASH rühmas (RR 0,87; 95% CI 0,43...1,73).
Apiksabaaniga võrreldes (56) oli ASH veritsusrisk sarnane, ent efektiivsus väiksem: insulti ja arteriaalset embooliat esines 1,6% aastas apiksabaanirühmas ning 3,7% aastas ASHrühmas (HR 0,45; 95% CI 0,32...0,62; p < 0,001), olulisi verejookse esines 1,4% aastas apiksabaani rühmas ja 1,2% ASHrühmas (HR 1,13; 95% CI 0,74...1,75; p = 0,57), intrakraniaalsete verejooksude hulk oli sarnane.
Töörühm pidas põhjendatuks trombemboolia olulise riski puhul alustada efektiivset ravi antikoagulantidega ning vältida vähem efektiivsete ja võimalik et sama ohtlike antiagregantide soovitamist.
Hilisemas uuringus (55) oli atsetüülsalitsüülhappe veritsusrisk võrreldav K‑vitamiini antagonisti omaga: insulti, intrakraniaalset verejooksu ja arteriaalset embooliat esines 1,8% aastas varfariini ja 3,8% atsetüülsalitsüülhapperühmas (RR 0,48, 95% CI 0,28...0,80; p = 0,003), ekstrakraniaalseid verejookse esines 1,4% varfariini- ja 1,6% ASH rühmas (RR 0,87; 95% CI 0,43...1,73).
Apiksabaaniga võrreldes (56) oli ASH veritsusrisk sarnane, ent efektiivsus väiksem: insulti ja arteriaalset embooliat esines 1,6% aastas apiksabaanirühmas ning 3,7% aastas ASHrühmas (HR 0,45; 95% CI 0,32...0,62; p < 0,001), olulisi verejookse esines 1,4% aastas apiksabaani rühmas ja 1,2% ASHrühmas (HR 1,13; 95% CI 0,74...1,75; p = 0,57), intrakraniaalsete verejooksude hulk oli sarnane.
Töörühm pidas põhjendatuks trombemboolia olulise riski puhul alustada efektiivset ravi antikoagulantidega ning vältida vähem efektiivsete ja võimalik et sama ohtlike antiagregantide soovitamist.
Südamelöögi sageduse esmane vähendamine
| 26 | Kui diagnoosite KVA ja patsiendil on vaja vähendada südame löögisagedust, kasutage beetaadrenoblokaatorit või mittedihüdropüridiinset kaltsiumikanali blokaatorit. Tugev soovitus, madal tõendatus. |
|
| 27 | Kui KVA‑ga patsiendil on südamepuudulikkus või teadaolevalt langenud vasaku vatsakese süstoolne funktsioon, kasutage südame löögisageduse esmaseks vähendamiseks beetaadrenoblokaatorit, digoksiini või vajadusel nende kombinatsiooni. Tugev soovitus, madal tõendatus. |
|
| 28 | Ärge kasutage dekompenseerunud südamepuudulikkusega ja KVA‑ga patsiendil südame löögisageduse vähendamiseks mittedihüdropüridiinset kaltsiumikanali blokaatorit. Tugev soovitus, mõõdukas tõendatus. |
|
| 29 | Kriitiliselt haigel või vasaku vatsakese raskelt langenud süstoolse funktsiooniga KVA‑ga patsiendil, kellel tahhükardia põhjustab hemodünaamika ebastabiilsust, võite südame löögisageduse vähendamiseks kasutada intravenoosset amiodarooni. Nõrk soovitus, madal tõendatus. |
Andmed südame löögisagedust vähendavate ravimite toime kohta ravi pikaajalistele tulemustele (olulised tulemusnäitajad) puuduvad.
Tahhüfrekventse KVA diagnoosimisel on esmane eesmärk sümptomeid ja tahhükardiomüopaatia ohtu vähendav ravi südame löögisageduse vähendamiseks, sealjuures on soovitatav ravimite kiire toime.
Südame löögisagedust vähendavatest ravimitest on kasutusel beetaadrenoblokaatorid, mittedihüdropüridiinsed kaltsiumikanalite blokaatorid ja digoksiin.
On arvukalt uuringuid, mis kinnitavad intravenoossete beetaadrenoblokaatorite ja kaltsiumikanalite mittedihüdropüridiinsete blokaatorite efektiivsust südame löögisageduse kiirel vähendamisel. Töörühma hinnangul olulisemaks peetud tulemusnäitajaid ei ole uuritud.
AHA 2014 juhend (57) esitab uuringutest ülevaate, mille kokkuvõte on järgmine.
Tahhüfrekventse KVA diagnoosimisel on esmane eesmärk sümptomeid ja tahhükardiomüopaatia ohtu vähendav ravi südame löögisageduse vähendamiseks, sealjuures on soovitatav ravimite kiire toime.
Südame löögisagedust vähendavatest ravimitest on kasutusel beetaadrenoblokaatorid, mittedihüdropüridiinsed kaltsiumikanalite blokaatorid ja digoksiin.
On arvukalt uuringuid, mis kinnitavad intravenoossete beetaadrenoblokaatorite ja kaltsiumikanalite mittedihüdropüridiinsete blokaatorite efektiivsust südame löögisageduse kiirel vähendamisel. Töörühma hinnangul olulisemaks peetud tulemusnäitajaid ei ole uuritud.
AHA 2014 juhend (57) esitab uuringutest ülevaate, mille kokkuvõte on järgmine.
- Beetaadrenobokaatorid, k.a esmolool, propranolool ja metoprolool, on intravenoossel manustamisel KVA‑ga patsiendile efektiivsed südame löögisagedust vähendavad ravimid.
- Intravenoosselt manustatav diltiaseem osutus tõhusaks ja talutavaks sageduskontrolli ravimiks 83% juhtudest.
- Verapamiil on intravenoossel manustamisel KVA‑ga patsiendile efektiivne sageduskontrolli ravim.
- Digoksiin vähendab vatsakeste löögisagedust, ent toime ilmneb tunni pärast ning saavutab maksimumi kuue tunniga.
- Amiodaroon on vähem efektiivne kui kaltsiumikanalite blokaatorid ja toime ilmneb aeglasemalt, ent ta põhjustab vähem hemodünaamilist ebastabiilsust. Intravenoosne amiodaroon võib toimida teistmoodi kui suukaudne, vahel suurendada löögisagedust ja provotseerida eluohtlikke rütmihäired preeksitatsiooniga patsientidel.
Ravimite ohutust hindavatest uuringutest on teada, et diltiaseemil ja verapamiilil on negatiivne inotroopne toime, mis võib vasaku vatsakese väljutusfraktsiooni langusega patsientidel põhjustada südamepuudulikkuse süvenemist (58).
Töörühm tõdes, et kaua kasutusel olnud ravimite teadusandmed on praeguse standardi järgi vähesed, ent ravimite toime ja ohutusprofiil on pikaajalise kliinilise kasutamise järel hästi teada ning sellest lähtudes saab anda muude ravijuhenditega sarnaseid soovitusi südame löögisageduse esmaseks vähendamiseks tahhüfrekventse KVA diagnoosimise korral.
Töörühm tõdes, et kaua kasutusel olnud ravimite teadusandmed on praeguse standardi järgi vähesed, ent ravimite toime ja ohutusprofiil on pikaajalise kliinilise kasutamise järel hästi teada ning sellest lähtudes saab anda muude ravijuhenditega sarnaseid soovitusi südame löögisageduse esmaseks vähendamiseks tahhüfrekventse KVA diagnoosimise korral.
Südame löögisageduse pikaajaline kontrolli all hoidmine
| 30 | Saavutage KVA‑ga patsiendil südame löögisagedus alla 110 x/min rahuolekus. Tugev soovitus, madal tõendatus. |
|
| 31 | Kui KVA‑ga patsiendil esinevad pärast südame löögisageduse eesmärkväärtuse < 110 x/min saavutamist vatsakeste suurest löögisagedusest tulenevad sümptomid, vähendage südame löögisagedust alla 80 x/min. Tugev soovitus, madal tõendatus. |
|
| 32 | Kui arstivisiidil on KVA‑ga patsiendi südame löögisagedus eesmärgile vastav, ent sümptomid püsivad, võite kasutada südame löögisageduse 24‑tunnist jälgimist. Töörühma praktiline soovitus. |
Uuringus ei leitud erinevust esmase tulemusnäitaja osas (kardiovaskulaarsurm, hospitaliseerimine südamepuudulikkuse tõttu, arteriaalne emboolia, veritsus või eluohtlik rütmihäire). Kolmeaastase jälgimisperioodi jooksul esines esmast tulemusnäitajat 12,9% vähemintensiivse sageduskontrolli rühmas ja 14,9% intensiivse sageduskontrolli rühmas.
Suurem osa patsientidest saavutas vähemintensiivses rühmas eesmärkväärtused (304 [97,7%] vs. 203 [67,0%] intensiivses rühmas; p < 0,001). KVA sümptomite ja kõrvaltoimete sagedus olid sarnased mõlemas rühmas.
Sama uuringu teine publikatsioon analüüsis südame löögisageduse vähendamise intensiivsuse mõju elukvaliteedile ning ei leidnud erinevusi (60).
Töörühm lähtus ühe mõõduka kvaliteediga kliinilise uuringu andmetest ning soovitas saavutada kõikidel patsientidel südame löögisageduse vähemalt alla 110 x/min.
Töörühm tõdes, et ilmselt on paljud patsiendid sellise löögisageduse juures veel sümptomaatilised ning sel juhul tuleb sageduskontrolli tõhustada.
Töörühm juhtis tähelepanu, et arstivisiidil hinnatud südame löögisagedus ei pruugi kajastada vastavat näitajat igapäevatoimingute juures, ning soovitas ambulatoorset rütmijälgimist juhul, kui sümptomid viitavad tahhükardiale, ent seda arstivisiidil ei esine.
| 33 | Kasutage südame löögisageduse vähendamist vajaval KVA‑ga patsiendil esmalt monoteraapiat beetaadrenoblokaatori või mittedihüdropüridiinse kaltsiumikanali blokaatoriga. Valige ravim patsiendi sümptomite, südame löögisageduse, kaasuvate haiguste ja patsiendi eelistuse järgi (vt tabel 12). Tugev soovitus, madal tõendatus. |
|
| 34 | Kui monoteraapia KVA sümptomeid ei leevenda ja sümptomid on arvatavasti tingitud vatsakeste suurest löögisagedusest, kaaluge ravimite kombineerimist (beetaadrenoblokaator, mittedihüdropüridiinne kaltsiumikanali blokaator, digoksiin), võttes arvesse koostoimest tulenevaid ohte (vt tabel 12). Nõrk soovitus, madal tõendatus. |
|
| 35 | Ärge kasutage permanentse KVA‑ga patsientidel südame löögisageduse vähendamiseks I ja III klassi antiarütmikume. Tugev soovitus, mõõdukas tõendatus. |
|
| 36 | Kui KVA‑ga patsiendil on südamepuudulikkus või teadaolevalt raskelt langenud vasaku vatsakese süstoolne funktsioon (väljutusfraktsioon ≤ 40%), kasutage südame löögisageduse vähendamiseks beetaadrenoblokaatorit või digoksiini. Tugev soovitus, mõõdukas tõendatus. |
Uuringus AFFIRM (61) näisid beetaadrenoblokaatorid kõige efektiivsemad ja olid enim kasutatud ravimiklass sageduskontrolli saavutamiseks, ent selle uuringu eesmärk ei olnud sageduskontrolli ravimite omavaheline võrdlus.
On hulk ajaloolisi uuringuid, mis võrdlevad väikestel patsiendirühmadel üksikute ravimite lühiajalist mõju südame löögisagedusele võrreldes platseeboga. Valdavalt on need ebaadekvaatse metoodikaga ning ei kajasta tulemusnäitajaid, mida töörühm oluliseks pidas.
Tõenduse ülevaade on esitatud NICE 2014 juhendis (24). Kui ristuva uuringukavaga uuringud kõrvale jäeti, leiti kolm asjakohast kliinilist uuringut, mis näitasid järgnevat.
- Väga madala kvaliteediga andmed ühest uuringust (N = 738) näitasid, et 21 kuud kestnud kasutamise järel ei erinenud suremus beetaadrenoblokaatori ja platseebo rühmades (sama kinnitas hilisem metaanalüüs, 62).
- Väga madala kvaliteediga andmed ühest uuringust (N = 100) näitasid, et 21 ravikuu jooksul hospitaliseeriti südamepuudulikkuse tõttu rohkem beetaadrenoblokaatorit kasutanud patsiente võrrelduna platseeboga.
- Väga madala kvaliteediga andmed ühest uuringust (N = 46) näitasid, et KVA‑ga ja südamepuudulikkusega patsientidel oli kuuendal ravikuul digoksiin efektiivsem kui beetaadrenoblokaator südame 24 tunni keskmise löögisageduse vähendamisel.
- Madala kvaliteediga andmed ühest uuringust (N = 100) näitasid, et pärast kuuekuulist kasutamist puudus kliiniline erinevus digoksiini ja beetaadrenoblokaatori vahel vasaku vatsakese väljutusfraktsiooni muutuses.
- Väga madala kvaliteediga andmed ühest uuringust (N = 15) näitasid, et puudus kliiniline erinevus digoksiini ja amiodarooni toimel vatsakeste löögisagedusele füüsilisel koormusel.
Töörühm soovitas südame löögisageduse pikaajaliseks kontrolli all hoidmiseks beetaadrenoblokaatoreid, kaltsiumikanalite mittedihüdropüridiinseid blokaatoreid ja vajadusel neile digoksiini lisamist.
Töörühm arutas ka hiljutisi epidemioloogiliste vaatlusuuringute ja randomiseeritud uuringu post hoc analüüsi tulemusi, mis viitavad digoksiini võimalikule suremust suurendavale toimele (63). Uuringute andmed on vastukäivad, ent töörühm pidas oluliseks ravimi plasmakontsentratsiooni jälgimist ning selle hoidmist toimivas vahemikus (0,5...0,9 nmol/l) võimalikult väiksena.
Töörühm oli kahtlev beetaadrenoblokaatori, kaltsiumikanali blokaatori ja digoksiini kolmikkombinatsiooni kasutamise ohutuses.
Töörühm rõhutas, et amiodaroon võib küll olla efektiivne südame löögisageduse kontrolli all hoidmisel, ent tema pikaajalise kasutamisega kaasnevad ohtlikud ekstrakardiaalsed kõrvaltoimed.
Kuna antiarütmikumidel on proarütmiline toime ning need on südame löögisageduse vähendamisel väheefektiivsed, anti soovitus nende kasutamise vältimiseks, kui ravi eesmärk on sageduskontroll. Eesti praktikas on arvukalt juhtumeid, kus nende ravimite kasutamist permanentse KVA puhul ei ole lõpetatud ning töörühm rõhutas, et seda tuleb teha.
Sarnaselt südame löögisageduse esmasele vähendamisele KVA diagnoosimise korral soovitas töörühm vasaku vatsakese langenud väljutusfraktsiooniga südamepuudulikkuse puhul ka pikaajaliseks kasutamiseks beetaadrenoblokaatoreid ja digoksiini. Töörühm rõhutas beetaadrenoblokaatorite puhul piisava annuse kasutamise olulisust. Digoksiini kasutamisel on vaja jälgida, et ravimi plasmakontsentratsioon oleks toimiva vahemiku (0,5...0,9 nmol/l) madalamas osas.
Tabel 12. Südame löögisagedust vähendavad ravimid

Siinusrütmi taastav ja säilitav ravi
| 37 | Kui KVA põhjustab patsiendi hemodünaamika ebastabiilsust, tehke kohe elektriline kardioversioon. Tugev soovitus, madal tõendatus. |
|
| 38 | Kui KVA põhjustab patsiendi hemodünaamika ebastabiilsust ja elektrilist kardioversiooni ei saa teha, võite siinusrütmi taastamiseks kasutada intravenoosset amiodarooni. Nõrk soovitus, madal tõendatus. |
Rütmihäirest tingitud hemodünaamilise ebastabiilsuse puhul on vaja siinusrütm võimalikult kiiresti taastada. Elektrilise kardioversiooni efektiivsus on ligikaudu 90%. Farmakoloogiline kardioversioon on vähem efektiivne ning ravimite valik ägeda haigusseisundi puhul piiratud. Sellest lähtudes andis töörühm soovituse eelistada elektrilist kardioversiooni.
| 39 | Kaaluge siinusrütmi taastamist KVA‑ga patsientidel, kellel peale südame löögisageduse eesmärgi saavutamist sümptomid püsivad või kellel sageduse eesmärki ei õnnestu saavutada. Nõrk soovitus, madal tõendatus. |
Ühes süsteemses ülevaates leiti seitse uuringut, milles võrreldi sageduskontrolli siinusrütmi taastamise ja säilitamisega (64). Suremuse ja trombemboolia tulemused olid võrreldavad. Üks randomiseeritud uuring näitas siinusrütmi säilitava ravi puhul elukvaliteedi paremust ning üks suur vaatlusuuring viitas selle strateegia puhul võimalikule paremale elulemusele viie- ja kaheksa-aastase jälgimisperioodi järel.
Töörühm võttis arvesse kahe strateegia võrreldavaid kaugtulemusi randomiseeritud uuringuis ning siinusrütmi taastamise ja säilitamise peamiselt sümptomaatilist eesmärki. Samuti võeti arvesse siinusrütmi säilitamiseks vajalike antiarütmikumide kõrvaltoimeid.
Sellest lähtudes pidas töörühm ravistrateegia valikul õigeks individuaalset lähenemist. Töörühm andis nõrga soovituse kaaluda siinusrütmi taastamist ja säilitamist patsientidel, kellel sümptomid püsivad peale sageduskontrolli saavutamist, ning patsientidel, kellel sageduskontrolli strateegia ei ole tõhus.
Töörühm võttis arvesse kahe strateegia võrreldavaid kaugtulemusi randomiseeritud uuringuis ning siinusrütmi taastamise ja säilitamise peamiselt sümptomaatilist eesmärki. Samuti võeti arvesse siinusrütmi säilitamiseks vajalike antiarütmikumide kõrvaltoimeid.
Sellest lähtudes pidas töörühm ravistrateegia valikul õigeks individuaalset lähenemist. Töörühm andis nõrga soovituse kaaluda siinusrütmi taastamist ja säilitamist patsientidel, kellel sümptomid püsivad peale sageduskontrolli saavutamist, ning patsientidel, kellel sageduskontrolli strateegia ei ole tõhus.
| 40 | Alla 48 tunni kestnud KVA puhul võite siinusrütmi taastamiseks kasutada nii elektrilist kui ka farmakoloogilist kardioversiooni (vt tabel 13). Meetodi valikul arvestage oma kogemuse ja patsiendi eelistusega. Nõrk soovitus, mõõdukas tõendatus. |
|
| 41 | Üle 48 tunni kestnud KVA puhul eelistage siinusrütmi taastamiseks elektrilist kardioversiooni. Tugev soovitus, mõõdukas tõendatus. |
Hiljutise kirjanduse ülevaate (65) andmeil ei ole kahte kardioversioonimeetodit usaldusväärses kliinilises uuringus võrreldud. Farmakoloogilist kardioversiooni platseeboga võrdlevad uuringud näitavad farmakoloogilise kardioversiooni väiksemat varajast efektiivsust võrreldes elektrilise kardioversiooni uuringutega. Elektrilise kardioversiooni efektiivsus on üle 90%, ent see kahaneb, kui KVA kestus on pikem.
Farmakoloogiliseks kardioversiooniks on KVA lühiajalise kestuse korral kasutusel flekainiid, propafenoon, ibutiliid, dofetiliid ja amiodaroon. Kauem kui seitse päeva kestva KVA korral on mõningaid andmeid dofetiliidi, amiodarooni ja ibutiliidi efektiivsusest. Struktuurse südamehaiguse puhul on valik piiratum.
Veeni manustatud flekainiid taastab siinusrütmi hiljuti tekkinud KVA puhul 67...92% juhtudel kuue tunni jooksul ning on efektiivsem kui prokaiinamiid, sotalool, propafenoon ja amiodaroon. Kasutatakse ka 200...300 mg suukaudset annust. Veeni manustamise efektiivsus on võrreldav suure (100...400 mg) suukaudse annusega, ent toime on kiirem (52 vs. 110 min). Flekainiid ei sobi struktuurse südamehaiguse puhul.
Propafenoon on efektiivsem paroksüsmaalse KVA puhul võrreldes persisteeruvaga, efektiivsus läheneb flekainiidi omale. Ka propafenoon ei sobi struktuurse südamehaiguse puhul. Uuringutest selgub, et veeni manustamise puhul taastas propafenoon siinusrütmi 23...54% juhtudest olenevalt KVA kestusest. Suur suukaudne annus (450...600 mg) taastas siinusrütmi 56...83% patsientidest olenevalt KVA kestusest.
Amiodaroon ei ole kuigi tõhus ravim kiireks kardioversiooniks, siinusrütm taastub tunde hiljem kui flekainiidi, propafenooni või vernakalandi kasutamisel. Suukaudsel kasutamisel taastub siinusrütm kuni 25% patsientidest umbes kuuenädalase kasutamise järel. Ravim vähendab oluliselt vatsakeste löögisagedust.
Vernakalant on uus veeni manustatav antiarütmikum siinusrütmi taastamiseks. Siinusrütm taastub 10 minuti jooksul umbes 50% alla kaheksa päeva kestnud KVA‑ga patsientidest. Vernakalant on efektiivsem kui intravenoosne amiodaroon, kuid seda ei ole võrreldud muude antiarütmikumidega.
Elektrilise kardioversiooni tüsistustena tuuakse välja rütmihäired, peamiselt bradükardia. Hiljutises uuringus oli selle sagedus 0,9% (asüstoolia > 5 s, bradükardia < 40 x/min), sekkumist vajavat ventrikulaarset tahhükardiat ei esinenud (66).
Lisaks väiksemale efektiivsusele tuuakse ülevaates farmakoloogilise kardioversiooni puudustena välja pikem EKG jälgimise vajadus (umbes 50% ravimi lõplikust poolväärtusajast), IA- ja IC‑klassi ravimite puhul oht 1 : 1 ülejuhteks, kui KVA muutub kodade laperdusarütmiaks (selle ennetamiseks on kasutatud lisaks AV juhtivust aeglustavat ravimit).
Farmakoloogilise kardioversiooni eelisena tuuakse välja asjaolu, et see ei vaja sedatsiooni ja seetõttu saab seda kasutada inimestel, kellele sedatsioon on vastunäidustatud.
Ühes hiljutises majandusanalüüside ülevaates viidati sellele, et kõik leitud analüüsid peale ühe näitasid, et elektriline kardioversioon on tervishoiusüsteemi perspektiivist kulutõhusam kui farmakoloogiline (67).
Töörühm tõdes, et elektriline kardioversioon on tõendatult tõhusam kui farmakoloogiline, eriti pikemat aega kestnud KVA puhul. Ent arstidel võib olla erinev kogemus, ohutu sedatsioon ei pruugi olla kõikjal kättesaadav ja patsientidel võib olla kindlaid eelistusi kardioversiooni meetodi suhtes. Töörühm võttis arvesse ka majandusanalüüside ülevaadet, milles viidati sellele, et peaaegu kõigis analüüsides oli elektriline kardioversioon majanduslikult mõistlikum.
Seetõttu anti soovitus lähtuda alla 48 tunni kestnud KVA puhul siinusrütmi taastamise meetodit valides kogemusest ja patsiendi eelistusest, pikemat aega kestnud KVA puhul anti tugev soovitus eelistada elektrilist kardioversiooni.
Tabel 13. Farmakoloogiline kardioversioon
Farmakoloogiliseks kardioversiooniks on KVA lühiajalise kestuse korral kasutusel flekainiid, propafenoon, ibutiliid, dofetiliid ja amiodaroon. Kauem kui seitse päeva kestva KVA korral on mõningaid andmeid dofetiliidi, amiodarooni ja ibutiliidi efektiivsusest. Struktuurse südamehaiguse puhul on valik piiratum.
Veeni manustatud flekainiid taastab siinusrütmi hiljuti tekkinud KVA puhul 67...92% juhtudel kuue tunni jooksul ning on efektiivsem kui prokaiinamiid, sotalool, propafenoon ja amiodaroon. Kasutatakse ka 200...300 mg suukaudset annust. Veeni manustamise efektiivsus on võrreldav suure (100...400 mg) suukaudse annusega, ent toime on kiirem (52 vs. 110 min). Flekainiid ei sobi struktuurse südamehaiguse puhul.
Propafenoon on efektiivsem paroksüsmaalse KVA puhul võrreldes persisteeruvaga, efektiivsus läheneb flekainiidi omale. Ka propafenoon ei sobi struktuurse südamehaiguse puhul. Uuringutest selgub, et veeni manustamise puhul taastas propafenoon siinusrütmi 23...54% juhtudest olenevalt KVA kestusest. Suur suukaudne annus (450...600 mg) taastas siinusrütmi 56...83% patsientidest olenevalt KVA kestusest.
Amiodaroon ei ole kuigi tõhus ravim kiireks kardioversiooniks, siinusrütm taastub tunde hiljem kui flekainiidi, propafenooni või vernakalandi kasutamisel. Suukaudsel kasutamisel taastub siinusrütm kuni 25% patsientidest umbes kuuenädalase kasutamise järel. Ravim vähendab oluliselt vatsakeste löögisagedust.
Vernakalant on uus veeni manustatav antiarütmikum siinusrütmi taastamiseks. Siinusrütm taastub 10 minuti jooksul umbes 50% alla kaheksa päeva kestnud KVA‑ga patsientidest. Vernakalant on efektiivsem kui intravenoosne amiodaroon, kuid seda ei ole võrreldud muude antiarütmikumidega.
Elektrilise kardioversiooni tüsistustena tuuakse välja rütmihäired, peamiselt bradükardia. Hiljutises uuringus oli selle sagedus 0,9% (asüstoolia > 5 s, bradükardia < 40 x/min), sekkumist vajavat ventrikulaarset tahhükardiat ei esinenud (66).
Lisaks väiksemale efektiivsusele tuuakse ülevaates farmakoloogilise kardioversiooni puudustena välja pikem EKG jälgimise vajadus (umbes 50% ravimi lõplikust poolväärtusajast), IA- ja IC‑klassi ravimite puhul oht 1 : 1 ülejuhteks, kui KVA muutub kodade laperdusarütmiaks (selle ennetamiseks on kasutatud lisaks AV juhtivust aeglustavat ravimit).
Farmakoloogilise kardioversiooni eelisena tuuakse välja asjaolu, et see ei vaja sedatsiooni ja seetõttu saab seda kasutada inimestel, kellele sedatsioon on vastunäidustatud.
Ühes hiljutises majandusanalüüside ülevaates viidati sellele, et kõik leitud analüüsid peale ühe näitasid, et elektriline kardioversioon on tervishoiusüsteemi perspektiivist kulutõhusam kui farmakoloogiline (67).
Töörühm tõdes, et elektriline kardioversioon on tõendatult tõhusam kui farmakoloogiline, eriti pikemat aega kestnud KVA puhul. Ent arstidel võib olla erinev kogemus, ohutu sedatsioon ei pruugi olla kõikjal kättesaadav ja patsientidel võib olla kindlaid eelistusi kardioversiooni meetodi suhtes. Töörühm võttis arvesse ka majandusanalüüside ülevaadet, milles viidati sellele, et peaaegu kõigis analüüsides oli elektriline kardioversioon majanduslikult mõistlikum.
Seetõttu anti soovitus lähtuda alla 48 tunni kestnud KVA puhul siinusrütmi taastamise meetodit valides kogemusest ja patsiendi eelistusest, pikemat aega kestnud KVA puhul anti tugev soovitus eelistada elektrilist kardioversiooni.
Tabel 13. Farmakoloogiline kardioversioon

| 42 | Kardioversiooni järel määrake patsiendile neljaks nädalaks antikoagulatsioon ka siis, kui ei esine trombemboolia riskitegureid. Trombemboolia suurenenud risk kaasneb nii farmakoloogilise kui ka elektrilise kardioversiooniga ja püsib esimeste nädalate jooksul peale kardioversiooni. Töörühma praktiline soovitus. |
|
| 43 | Siinusrütmi tohib hemodünaamiliselt stabiilsel, antikoaguleerimata, KVA‑ga haigel taastada juhul, kui on kindel, et KVA on kestnud alla 48 tunni. Arvestage, et KVA võib olla asümptomaatiline ja patsient võib selle tekkimise aega valesti hinnata, eriti normofrekventse KVA puhul. Töörühma praktiline soovitus. |
|
| 44 | Siinusrütmi tohib hemodünaamiliselt stabiilsel KVA‑ga patsiendil taastada juhul, kui patsient on olnud adekvaatselt antikoaguleeritud vähemalt kolm nädalat või söögitorukaudsel ehhokardiograafilise uuringuga on välistatud trombid südameõõntes. Töörühma praktiline soovitus. |
Töörühm otsustas anda praktilisi soovitusi trombemboolia ja antikoagulatsiooni kohta seoses kardioversiooniga.
Rahvusvaheliselt on konsensusele jõutud, et antikoaguleerimata patsiendil on siinusrütmi taastamise järgne trombemboolia risk aktsepteeritavalt väike kuni 48 tundi kestnud rütmihäire puhul (7).
Trombemboolia risk on seotud siinusrütmi taastumise, mitte kardioversiooni meetodiga, st risk on olemas ka farmakoloogilise kardioversiooni puhul.
Praktilise kogemuse ja südamestimulaatorite kontrolli andmestiku kohaselt ei ole patsiendid sageli võimelised rütmihäire tekke aega täpselt hindama. Ebakindluse puhul on mõistlik patsient vähemalt kolmeks nädalaks enne kardioversiooni antikoaguleerida või teha südameõõntes trombide välistamiseks söögitorukaudne ehhokardiograafiline uuring.
Rahvusvaheliselt on konsensusele jõutud, et antikoaguleerimata patsiendil on siinusrütmi taastamise järgne trombemboolia risk aktsepteeritavalt väike kuni 48 tundi kestnud rütmihäire puhul (7).
Trombemboolia risk on seotud siinusrütmi taastumise, mitte kardioversiooni meetodiga, st risk on olemas ka farmakoloogilise kardioversiooni puhul.
Praktilise kogemuse ja südamestimulaatorite kontrolli andmestiku kohaselt ei ole patsiendid sageli võimelised rütmihäire tekke aega täpselt hindama. Ebakindluse puhul on mõistlik patsient vähemalt kolmeks nädalaks enne kardioversiooni antikoaguleerida või teha südameõõntes trombide välistamiseks söögitorukaudne ehhokardiograafiline uuring.
| 45 | Harvade sümptomaatiliste paroksüsmidega KVA‑ga patsiendile, kellel siinusrütm ise ei taastu ning kellel on varem sama ravimit haiglas siinusrütmi taastamiseks edukalt ja ohutult kasutatud, võite soovitada siinusrütmi taastamiseks propafenooni (450...600 mg) või flekainiidi (200...300 mg) ühekordse suukaudse annuse kasutamist (nn tablett-taskus-strateegia, ingl pill-in-the-pocket approach). Kui patsient ei saa püsiravi beetaadrenoblokaatori ega mittedihüdropüridiinse kaltsiumikanali blokaatoriga, tuleb koos antiarütmikumiga võtta beetaadrenoblokaatorit. Nõrk soovitus, mõõdukas tõendatus. |
Tablett-taskus-strateegiaks nimetatakse farmakoloogilist kardioversiooni, mille puhul patsient kasutab sümptomaatilise KVA tekkimise korral varem kontrollitud tingimustes manustatuna efektiivseks ja ohutuks osutunud antiarütmikumi.
Flekainiidi ja propafenooni efektiivsus siinusrütmi taastamisel on tablett-taskus-strateegia puhul hinnanguliselt 50...80%. Enamasti peetakse vajalikuks beetaadrenoblokaatori või kaltsiumikanalite mittedihüdropüridiinse blokaatori kasutamist koos antiarütmikumiga, kui üks neist ravimirühmadest ei ole püsiravis kasutusel (et vältida 1 : 1 atrioventrikulaarset ülejuhtivust, kui KVA läheb üle kodade laperdusarütmiaks).
Hiljutises ülevaates (65) tõdeti, et hea kvaliteediga uuringuid, kus oleks võrreldud koduse ja haiglapõhise farmakoloogilise kardioversiooni strateegiaid, ei ole.
Ühes prospektiivses enne-pärast kavandiga uuringus (68) leiti, et paroksüsmaalse KVA‑ga patsientide puhul oli keskmine erakorralise ravi vajadus nii haiglasse pöördumiste kui ka hospitaliseerimiste arvu poolest ühes kuus tablett-taskus-strateegia puhul märkimisväärselt väiksem (kasutati IC‑klassi antiarütmikume). Erakorralise meditsiini osakonna visiite ja hospitaliseerimisi oli uurimisperioodi ajal märkimisväärselt vähem võrreldes uuringus osalemise eelse aastaga. Uuringus osalenud 165 patsiendil (79%) oli kokku 618 arütmiaepisoodi, millest 569 episoodi (92%) lahenes 36 ±93 minuti jooksul peale sümptomite teket. Keskmine jälgimisaeg oli selles uuringus 15 ±5 kuud. Ravi oli edukas 534 episoodi puhul (94%) ja aeg sümptomite kadumiseni oli 113 ±84 minutit. Ravi oli efektiivne 139 patsiendi arütmiahoo puhul (84%). Kõrvaltoimeid esines ühe või mitme arütmiaepisoodi ajal 12 patsiendil (7%), k.a kodade laperdust (1 patsiendil) ja mittekardiaalseid kõrvaltoimeid (11 patsiendil). Osalenud patsiendid olid 18...75‑aastased, vasaku vatsakese väljutusfraktsioon oli suurem kui 50%, anamneesis ei olnud rasket südamehaigust, süstoolne vererõhk oli kõrgem kui 100 mmHg ja südame löögisagedus suurem kui 70 lööki minutis. Kasutati flekainiidi ja propafenooni.
Teises uuringus (69) kasutati propafenooni 600 mg annusena suukaudselt ja leiti, et see on ohutu ja efektiivne 56...83% juhtudel olenevalt KVA kestusest ja jälgimisperioodi pikkusest.
Ühes süsteemses tõhususe ja kulutõhususe ülevaates ning modelleeritud analüüsis (70) leiti, et tablett-taskus-strateegia flekainiidi või propafenooni kasutades on marginaalselt vähem efektiivne kui siinusrütmi taastamine haiglas või pidev siinusrütmi säilitav ravi (vähem QALY‑sid), ent ka odavam. Viidati ka, et patsiendid võivad eelistada kodust ravi.
Töörühm leidis, et kodune kardioversioon on hea ravivõimalus arukate, varem kontrollitud tingimustes sama ravimit edukalt kasutanud patsientide ravis.
Töörühm tõdes, et ohutuse tagamiseks peab patsientide valik olema väga hoolikas.
Töörühm nõustus kirjanduses avaldatud seisukohaga, et osad patsiendid võivad eelistada kodust kardioversiooni, ja andis nõrga soovituse seda valitud patsientidel koos sageduskontrolli tagava ravimiga kasutada.
Flekainiidi ja propafenooni efektiivsus siinusrütmi taastamisel on tablett-taskus-strateegia puhul hinnanguliselt 50...80%. Enamasti peetakse vajalikuks beetaadrenoblokaatori või kaltsiumikanalite mittedihüdropüridiinse blokaatori kasutamist koos antiarütmikumiga, kui üks neist ravimirühmadest ei ole püsiravis kasutusel (et vältida 1 : 1 atrioventrikulaarset ülejuhtivust, kui KVA läheb üle kodade laperdusarütmiaks).
Hiljutises ülevaates (65) tõdeti, et hea kvaliteediga uuringuid, kus oleks võrreldud koduse ja haiglapõhise farmakoloogilise kardioversiooni strateegiaid, ei ole.
Ühes prospektiivses enne-pärast kavandiga uuringus (68) leiti, et paroksüsmaalse KVA‑ga patsientide puhul oli keskmine erakorralise ravi vajadus nii haiglasse pöördumiste kui ka hospitaliseerimiste arvu poolest ühes kuus tablett-taskus-strateegia puhul märkimisväärselt väiksem (kasutati IC‑klassi antiarütmikume). Erakorralise meditsiini osakonna visiite ja hospitaliseerimisi oli uurimisperioodi ajal märkimisväärselt vähem võrreldes uuringus osalemise eelse aastaga. Uuringus osalenud 165 patsiendil (79%) oli kokku 618 arütmiaepisoodi, millest 569 episoodi (92%) lahenes 36 ±93 minuti jooksul peale sümptomite teket. Keskmine jälgimisaeg oli selles uuringus 15 ±5 kuud. Ravi oli edukas 534 episoodi puhul (94%) ja aeg sümptomite kadumiseni oli 113 ±84 minutit. Ravi oli efektiivne 139 patsiendi arütmiahoo puhul (84%). Kõrvaltoimeid esines ühe või mitme arütmiaepisoodi ajal 12 patsiendil (7%), k.a kodade laperdust (1 patsiendil) ja mittekardiaalseid kõrvaltoimeid (11 patsiendil). Osalenud patsiendid olid 18...75‑aastased, vasaku vatsakese väljutusfraktsioon oli suurem kui 50%, anamneesis ei olnud rasket südamehaigust, süstoolne vererõhk oli kõrgem kui 100 mmHg ja südame löögisagedus suurem kui 70 lööki minutis. Kasutati flekainiidi ja propafenooni.
Teises uuringus (69) kasutati propafenooni 600 mg annusena suukaudselt ja leiti, et see on ohutu ja efektiivne 56...83% juhtudel olenevalt KVA kestusest ja jälgimisperioodi pikkusest.
Ühes süsteemses tõhususe ja kulutõhususe ülevaates ning modelleeritud analüüsis (70) leiti, et tablett-taskus-strateegia flekainiidi või propafenooni kasutades on marginaalselt vähem efektiivne kui siinusrütmi taastamine haiglas või pidev siinusrütmi säilitav ravi (vähem QALY‑sid), ent ka odavam. Viidati ka, et patsiendid võivad eelistada kodust ravi.
Töörühm leidis, et kodune kardioversioon on hea ravivõimalus arukate, varem kontrollitud tingimustes sama ravimit edukalt kasutanud patsientide ravis.
Töörühm tõdes, et ohutuse tagamiseks peab patsientide valik olema väga hoolikas.
Töörühm nõustus kirjanduses avaldatud seisukohaga, et osad patsiendid võivad eelistada kodust kardioversiooni, ja andis nõrga soovituse seda valitud patsientidel koos sageduskontrolli tagava ravimiga kasutada.
| 46 | Kui sümptomaatiliste paroksüsmidega KVA puhul on koostöös patsiendiga valitud siinusrütmi säilitav ravistrateegia, kasutage esimese siinusrütmi säilitava ravimina beetaadrenoblokaatorit. Tugev soovitus, mõõdukas tõendatus. |
|
| 47 | Kui sümptomaatiliste paroksüsmidega KVA puhul on koostöös patsiendiga valitud siinusrütmi säilitav ravistrateegia ja beetablokaatori kasutamine on vastunäidustatud või see ei ole tõhus, valige antiarütmikum, lähtudes ohutusest ning kaasuvatest haigustest (vt tabel 14). Tugev soovitus, väga madal tõendatus. |
|
| 48 | Ärge kasutage IC‑klassi antiarütmikume (flekainiid, propafenoon) südame isheemiatõve ja struktuurse südamehaigusega patsientidel. Tugev soovitus, mõõdukas tõendatus. |
|
| 49 | Ärge kasutage amiodarooni pikaajaliselt, välja arvatud juhul, kui on kindel vajadus siinusrütmi säilitava ravi järele ja muud antiarütmikumid ei ole efektiivsed või on vastunäidustatud. Tugev soovitus, kõrge tõendatus. |
Siinusrütmi säilitavate ravimite efektiivsuse ja ohutuse süsteemne ülevaade oluliste tulemusnäitajate kaupa on koostatud NICE 2014 ravijuhendi (24) tarvis. Enamiku uuringute kliinilise tõenduse kvaliteet on väga madal kuni keskmine.
Suremus
Madala kvaliteediga tõendus, võrdlus platseeboga:
Suremus
Madala kvaliteediga tõendus, võrdlus platseeboga:
- propafenoon andis uuringute andmetel suremuse osas vastukäivaid tulemusi (viis uuringut, N = 1098);
- sotalool ei vähendanud suremust platseeboga võrreldes (12 uuringut, N = 3002).
Väga madala kvaliteediga tõendus, võrdlus platseeboga:
- disopüramiid, beetablokaatorid ja amiodaroon andsid uuringute andmetel suremuse osas vastukäivaid tulemusi (kaheksa uuringut, N = 1381).
Väga madala kvaliteediga tõendus, võrdlus ravimite vahel:
- flekainiid võib olla efektiivsem võrreldes propafenooniga, kuid ka propafenoon võib suremust vähendada (üks uuring, N = 297);
- amiodaroon võib olla efektiivsem I klassi antiarütmikumidest ja on võimalik, et amiodaroon vähendab suremust (üks uuring, N = 643);
- amiodaroon võib olla efektiivsem sotaloolist, kuid on võimalik, et ka sotalool vähendab suremust (üks uuring, N = 1113);
- III klassi antiarütmikumid võivad olla efektiivsemad kui I klassi antiarütmikumid, kuid on võimalik, et ka I klassi antiarütmikumid vähendavad suremust (üks uuring, N = 2875);
- amiodaroon võib olla dronedaroonist kliiniliselt vähem efektiivne, kuid on võimalik, et amiodaroon vähendab suremust (üks uuring, N = 504);
- sotalooli ja I klassi antiarütmikumide toimes ei ole kliinilist erinevust, välja arvatud kinidiini puhul (neli uuringut, N = 594).
KVA kordumine
Nõrga kuni keskmise tugevusega tõendus näitab, et flekainiid, propafenoon, amiodaroon ja sotalool on kliiniliselt efektiivsed võrreldes platseeboga (24 uuringut, N = 4249).
Madala kvaliteediga tõendus näitab, et disopüramiid ja beetaadrenoblokaatorid võivad olla kliiniliselt efektiivsed võrreldes platseeboga (neli uuringut, N = 708).
Amiodaroon on kliiniliselt efektiivsem võrreldes:
Nõrga kuni keskmise tugevusega tõendus näitab, et flekainiid, propafenoon, amiodaroon ja sotalool on kliiniliselt efektiivsed võrreldes platseeboga (24 uuringut, N = 4249).
Madala kvaliteediga tõendus näitab, et disopüramiid ja beetaadrenoblokaatorid võivad olla kliiniliselt efektiivsed võrreldes platseeboga (neli uuringut, N = 708).
Amiodaroon on kliiniliselt efektiivsem võrreldes:
- I klassi antiarütmikumidega (mõõduka kvaliteediga tõendus, neli uuringut, N = 643),
- sotalooliga (mõõduka kvaliteediga tõendus, viis uuringut, N = 1113),
- dronedarooniga (kõrge kvaliteediga tõendus, üks uuring, N = 504).
Väga madala kvaliteediga tõendus näitab, et järgnevate ravimite toimetes ei pruugi olla olulisi erinevusi:
- flekainiid ja propafenoon (kaks uuringut, N = 297),
- sotalool ja I klassi antiarütmikumid, v.a kinidiin (neli uuringut, N = 594),
- sotalool ja beetaadrenoblokaatorid (kaks uuringut, N = 263).
Madala kvaliteediga tõendus viitas sellele, et III klassi antiarütmikumide ja I klassi antiarütmikumide vahel ei pruugi olla erinevust, kuid trend viitas III klassi antiarütmikumide võimalikule suuremale efektiivsusele (seitse uuringut, N = 1603).
Ravimite ärajätmine kõrvaltoimete tõttu
Leiti madala kuni keskmise kvaliteediga tõendus, et disopüramiidi, flekainiidi, propafenooni, beetablokaatori, amiodarooni ja sotalooli tarvitamise korral esines rohkem ravimite ärajätmist kõrvaltoimete tõttu võrreldes platseeboga (26 uuringut, N = 4838).
Järgnevatel juhtudel esines rohkem ravimite ärajätmist kõrvaltoimete tõttu:
Ravimite ärajätmine kõrvaltoimete tõttu
Leiti madala kuni keskmise kvaliteediga tõendus, et disopüramiidi, flekainiidi, propafenooni, beetablokaatori, amiodarooni ja sotalooli tarvitamise korral esines rohkem ravimite ärajätmist kõrvaltoimete tõttu võrreldes platseeboga (26 uuringut, N = 4838).
Järgnevatel juhtudel esines rohkem ravimite ärajätmist kõrvaltoimete tõttu:
- I klassi ravimid võrreldes disopüramiidiga (madal tõenduse kvaliteet, üks uuring, N = 113),
- I klassi ravimid võrreldes amiodarooniga (väga madal tõenduse kvaliteet, neli uuringut, N = 652),
- amiodaroon võrreldes dronedarooniga (keskmise kvaliteediga tõendus, üks uuring, N = 504),
- I klassi ravimid, v.a kinidiin, võrreldes sotalooliga (madala kvaliteediga tõendus, neli uuringut, N = 567),
- sotalool võrreldes muude beetablokaatoritega (madala kvaliteediga tõendus, kaks uuringut, N = 263).
Väga madala kvaliteediga tõendus viitas sellele, et järgnevatel juhtudel esines rohkem ravimi ära jätmist kõrvaltoimete tõttu:
- propafenoon võrreldes flekainiidiga, kuid efektiivsuses oli eelis propafenoonil (kaks uuringut, N = 297);
- miodaroon võrreldes sotalooliga, kuid efektiivsuses oli eelis amiodaroonil (neli uuringut, N = 618);
- I klassi ravimid võrreldes III klassi ravimitega, ka efektiivsuses oli eelis III klassi ravimeil (seitse uuringut, N = > 100).
Töörühm pidas väga oluliseks valida siinusrütmi säilitav ravim ohutuse põhjal. Sellest lähtudes anti soovitus kasutada esimese valikuna beetaadrenoblokaatorit, mis on teadaolevalt vähem efektiivne, ent ohutum kui muud võimalikud ravimid.
Eesti praktika varieeruvust silmas pidades anti tugev soovitus mitte kasutada Ic‑klassi antiarütmikume isheemiatõve ja struktuurse südamehaiguse puhul ning hoiatati amiodarooni pikaajalisel kasutamisel tekkida võivate ohtlike ekstrakardiaalsete kõrvaltoimete eest. Amiodarooni soovitatakse kasutada vaid patsientidel, kellel on kindel näidustus siinusrütmi säilitavaks raviks ning kellel teised antiarütmikumid ei toimi või ei sobi.
Tabel 14. Suukaudsed arütmiaravimid siinusrütmi säilitamiseks
Eesti praktika varieeruvust silmas pidades anti tugev soovitus mitte kasutada Ic‑klassi antiarütmikume isheemiatõve ja struktuurse südamehaiguse puhul ning hoiatati amiodarooni pikaajalisel kasutamisel tekkida võivate ohtlike ekstrakardiaalsete kõrvaltoimete eest. Amiodarooni soovitatakse kasutada vaid patsientidel, kellel on kindel näidustus siinusrütmi säilitavaks raviks ning kellel teised antiarütmikumid ei toimi või ei sobi.
Tabel 14. Suukaudsed arütmiaravimid siinusrütmi säilitamiseks

| 50 | Sagedaste sümptomaatiliste paroksüsmidega KVA korral kaaluge patsiendi suunamist kateeterablatsioonile. Töörühma praktiline soovitus. |
|
| 51 | Kasutage südamepuudulikkuse ja langenud väljutusfraktsiooniga patsientidel KVA uue paroksüsmi tekke ennetamiseks angiotensiini konverteeriva ensüümi inhibiitorit (või selle talumatuse korral angiotensiini retseptori blokaatorit) ja beetablokaatorit. Tugev soovitus, mõõdukas tõendatus. |
Arvestades antiarütmilise ravi kõrvaltoimeid ning mõõdukat efektiivsust, kaalus töörühm ablatsioonravi kasutamist siinusrütmi säilitamiseks. Arvestades ravimeetodi vähest kättesaadavust Eestis jäeti selle kliinilise tõenduse hindamine ravijuhendi käsitlusalast välja ning töörühm soovitas lähtuda Euroopa Kardioloogide Seltsi juhendi seisukohtadest. Lühike kokkuvõte patsiendi ablatsioonraviks sobivuse hindamisest ja rütmihäirete spetsialistile suunamisest on lisas 10.
Mitmed südamepuudulikkuse uuringud viitavad sellele, et ravi AKE inhibiitori või ARB‑iga vähendab vasaku vatsakese düsfunktsiooni või hüpertensiooniga patsientidel uue KVA teket (7).
Töörühm leidis, et on kohane rõhutada nende ravimite lisakasu KVA ärahoidmisel vasaku vatsakese langenud väljutusfraktsiooniga ja südamepuudulikkusega patsientidel, kuna siinusrütmi säilimine võib neil olla hemodünaamiliselt soodne.
Mitmed südamepuudulikkuse uuringud viitavad sellele, et ravi AKE inhibiitori või ARB‑iga vähendab vasaku vatsakese düsfunktsiooni või hüpertensiooniga patsientidel uue KVA teket (7).
Töörühm leidis, et on kohane rõhutada nende ravimite lisakasu KVA ärahoidmisel vasaku vatsakese langenud väljutusfraktsiooniga ja südamepuudulikkusega patsientidel, kuna siinusrütmi säilimine võib neil olla hemodünaamiliselt soodne.
Ravijuhendi koostamine
KVA ravi- ja käsitlusjuhendi koostamise algatas Eesti Kardioloogide Selts 2015. aastal. Moodustati töörühm ning sekretariaat (mõlema koosseisud on esitatud ravijuhendi alguses) ja alustati ravijuhendi koostamist. Töörühma ning sekretariaadi liikmeteks kutsuti asjakohaste kutsealade (kardioloogia, peremeditsiin, sisehaigused, neuroloogia, erakorraline meditsiin, kiirabi, õendus) ning Eesti Haigekassa esindajad.
Eesti Haigekassa ravijuhendite nõukoda kinnitas 2017. aasta mais KVA ravi- ja käsitlusjuhendi käsitlusala, mille määratlemiseks kasutati 17 PICO‑formaadis kliinilist küsimust. Ravijuhendi käsitlusala, ravijuhendi täisversioon, tõendusmaterjali kokkuvõtted, soovituste kokkuvõtted, ravijuhendi rakenduskava, koosolekute protokollid ning ravijuhendi koostajate huvide deklaratsioonide kokkuvõte on veebilehel www.ravijuhend.ee.
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2011) põhimõtetest. Kliiniliste küsimuste arutamiseks ning soovituste sõnastamiseks pidas töörühm 9 koosolekut. Iga koosoleku alguses vaadati läbi töörühma ja sekretariaadi liikmete võimalike majanduslike huvide deklaratsioonid ning veenduti otsustajate kallutamatuses. Koosolek oli otsustusvõimeline, kui kohal oli vähemalt 2/3 töörühma liikmetest. Koosolekute otsused olid konsensuslikud. Sekretariaat valmistas igaks koosolekuks ette kliiniliste küsimuste tõendusmaterjali. Selleks analüüsiti olemasolevate ravijuhendite soovitusi ning nende aluseks olevat tõendusmaterjali, vajadusel ka uuemate teadusuuringute tulemusi. Soovituste sõnastamise aluseks oli tõendusmaterjali tugevus, sekkumise kasu tervisele, potentsiaalne kahju ja riskid ning võimalused soovitatava tegevuse rakendamiseks Eesti kontekstis.
Ravijuhendit uuendatakse viis aastat pärast selle kinnitamist või uute asjakohaste teadusandmete ilmnemisel.
Eesti Haigekassa ravijuhendite nõukoda kinnitas 2017. aasta mais KVA ravi- ja käsitlusjuhendi käsitlusala, mille määratlemiseks kasutati 17 PICO‑formaadis kliinilist küsimust. Ravijuhendi käsitlusala, ravijuhendi täisversioon, tõendusmaterjali kokkuvõtted, soovituste kokkuvõtted, ravijuhendi rakenduskava, koosolekute protokollid ning ravijuhendi koostajate huvide deklaratsioonide kokkuvõte on veebilehel www.ravijuhend.ee.
Ravijuhendi koostamisel lähtuti „Eesti ravijuhendite koostamise käsiraamatu“ (2011) põhimõtetest. Kliiniliste küsimuste arutamiseks ning soovituste sõnastamiseks pidas töörühm 9 koosolekut. Iga koosoleku alguses vaadati läbi töörühma ja sekretariaadi liikmete võimalike majanduslike huvide deklaratsioonid ning veenduti otsustajate kallutamatuses. Koosolek oli otsustusvõimeline, kui kohal oli vähemalt 2/3 töörühma liikmetest. Koosolekute otsused olid konsensuslikud. Sekretariaat valmistas igaks koosolekuks ette kliiniliste küsimuste tõendusmaterjali. Selleks analüüsiti olemasolevate ravijuhendite soovitusi ning nende aluseks olevat tõendusmaterjali, vajadusel ka uuemate teadusuuringute tulemusi. Soovituste sõnastamise aluseks oli tõendusmaterjali tugevus, sekkumise kasu tervisele, potentsiaalne kahju ja riskid ning võimalused soovitatava tegevuse rakendamiseks Eesti kontekstis.
Ravijuhendit uuendatakse viis aastat pärast selle kinnitamist või uute asjakohaste teadusandmete ilmnemisel.
Tõendumaterjali otsimine ja hindamine
Ravijuhendi koostamiseks otsiti tõendusmaterjali Eesti ravijuhendite käsiraamatu juhiste järgi. Esmane otsingu eesmärk oli KVA‑ga seotud tõenduspõhiste ravijuhendite ja soovituste leidmine. Ravijuhendite otsimisel kasutas sekretariaat Tartu Ülikooli Kliinikumi Medinfokeskuse abi.
Spetsiaalsed ravijuhendite andmebaasid olid järgmised: National Guideline Clearinghouse (www.guideline.gov), National Institute for Health and Care Excellence (http://www.nice.org.uk), Australian Clinical Practice Guidelines (https://www.clinicalguidelines.gov.au), Scottish Intercollegiate Guidelines Network (http://www.sign.ac.uk), Käypä hoito (http://www.kaypahoito.fi), Canadian Medical Association Infobase (https://www.cma.ca).
Otsiti ajavahemikus 2010–2017 avaldatud ravijuhendeid järgmise otsingustrateegiaga:
Search ((("Atrial Fibrillation"[Mesh]) AND ("Guidelines as Topic"[Mesh] OR "Health Planning Guidelines"[Mesh] OR "Practice Guidelines as Topic"[Mesh] OR "Guideline" [Publication Type] OR "Standard of Care"[Mesh] OR "Clinical Protocols"[Mesh] OR "Practice Guideline" [Publication Type]))) OR ((("atrial fibrillation") AND ((guideline[Title]) OR guidelines[Title])) AND ("2016/01/01"[PDat] : "3000/12/31"[PDat] ))
Filters: Publication date from 2010/01/01
Ravijuhendeid hindasid teineteisest sõltumatult vähemalt kaks sekretariaadi liiget, suurt arvamuste lahknevust ei esinenud. Ravijuhendite hinnangu positiivsete vastuste osakaal oli vahemikus 44...80%. Kriteeriumitele vastasid 5 ravijuhendit.
Tabel 15. AGREE tööriistaga hinnatud KVA ravijuhendid
Spetsiaalsed ravijuhendite andmebaasid olid järgmised: National Guideline Clearinghouse (www.guideline.gov), National Institute for Health and Care Excellence (http://www.nice.org.uk), Australian Clinical Practice Guidelines (https://www.clinicalguidelines.gov.au), Scottish Intercollegiate Guidelines Network (http://www.sign.ac.uk), Käypä hoito (http://www.kaypahoito.fi), Canadian Medical Association Infobase (https://www.cma.ca).
Otsiti ajavahemikus 2010–2017 avaldatud ravijuhendeid järgmise otsingustrateegiaga:
Search ((("Atrial Fibrillation"[Mesh]) AND ("Guidelines as Topic"[Mesh] OR "Health Planning Guidelines"[Mesh] OR "Practice Guidelines as Topic"[Mesh] OR "Guideline" [Publication Type] OR "Standard of Care"[Mesh] OR "Clinical Protocols"[Mesh] OR "Practice Guideline" [Publication Type]))) OR ((("atrial fibrillation") AND ((guideline[Title]) OR guidelines[Title])) AND ("2016/01/01"[PDat] : "3000/12/31"[PDat] ))
Filters: Publication date from 2010/01/01
Ravijuhendeid hindasid teineteisest sõltumatult vähemalt kaks sekretariaadi liiget, suurt arvamuste lahknevust ei esinenud. Ravijuhendite hinnangu positiivsete vastuste osakaal oli vahemikus 44...80%. Kriteeriumitele vastasid 5 ravijuhendit.
Tabel 15. AGREE tööriistaga hinnatud KVA ravijuhendid
| Aasta | Väljaandja | Pealkiri |
| 2014 | Inglismaa (NICE) | Atrial fibrillation: the management of atrial fibrillation |
| 2014 | Ameerika Ühendriigid (AHA/ACC/HRS) | Guideline for the Management of Patients With Atrial Fibrillation |
| 2015 | Soome | Eteisvärinä |
| 2010-2016 | Kanada (CCS) | Management of Atrial Fibrillation |
| 2016 | Euroopa Kardioloogide Selts (European Society of Cardiology, ESC) | Guidelines for the management of atrial fibrillation |
Tõendusmaterjali kokkuvõtete koostamiseks otsiti lisaks metaanalüüse, süstemaatilisi ülevaateid ja üksikuuringuid, eelistades randomiseeritud võrdlusrühmaga uuringuid. Täiendavate otsingutega leitud, ravijuhendis kajastatud artiklid on tekstis viidatud.
Sekretariaat koostas kõigi kliiniliste küsimuste kohta ravijuhendites esitatud soovituste ja teemakohase tõendusmaterjali kokkuvõtted, mis on esitatud ravijuhendite kodulehel www.ravijuhend.ee. Samas on ära toodud ka otsingustrateegiad. Soovituste kokkuvõtetes kirjeldatakse tõendusmaterjali kvaliteeti, kasu, kahjude ja koormuse tasakaalu, patsiendi võimalikke väärtusi ning eelistusi ja ressursi tähendust. Samuti sõnastas sekretariaat soovituste kavandi, töörühm sõnastas konsensuslikult lõplikud soovitused koos suuna ja tugevusega. Soovituste sõnastamisel võeti arvesse nii sekkumiste kasu tervisele kui ka võimalikke kõrvaltoimeid ja riske, samuti patsientide eeldatavaid eelistusi ja sekkumiste majanduslikku põhjendatust.
Sekretariaat koostas kõigi kliiniliste küsimuste kohta ravijuhendites esitatud soovituste ja teemakohase tõendusmaterjali kokkuvõtted, mis on esitatud ravijuhendite kodulehel www.ravijuhend.ee. Samas on ära toodud ka otsingustrateegiad. Soovituste kokkuvõtetes kirjeldatakse tõendusmaterjali kvaliteeti, kasu, kahjude ja koormuse tasakaalu, patsiendi võimalikke väärtusi ning eelistusi ja ressursi tähendust. Samuti sõnastas sekretariaat soovituste kavandi, töörühm sõnastas konsensuslikult lõplikud soovitused koos suuna ja tugevusega. Soovituste sõnastamisel võeti arvesse nii sekkumiste kasu tervisele kui ka võimalikke kõrvaltoimeid ja riske, samuti patsientide eeldatavaid eelistusi ja sekkumiste majanduslikku põhjendatust.
Lisa 1. KVA käsitlus kiirabis
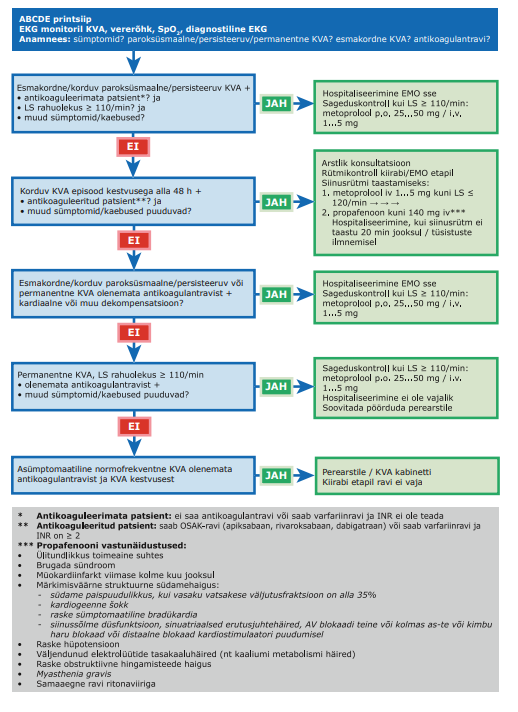

Lisa 2. KVA käsitlus EMOs
.
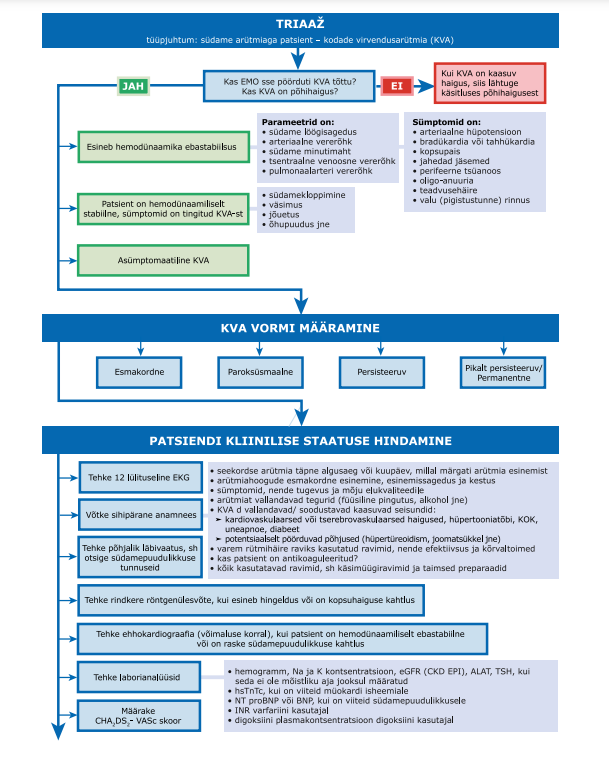
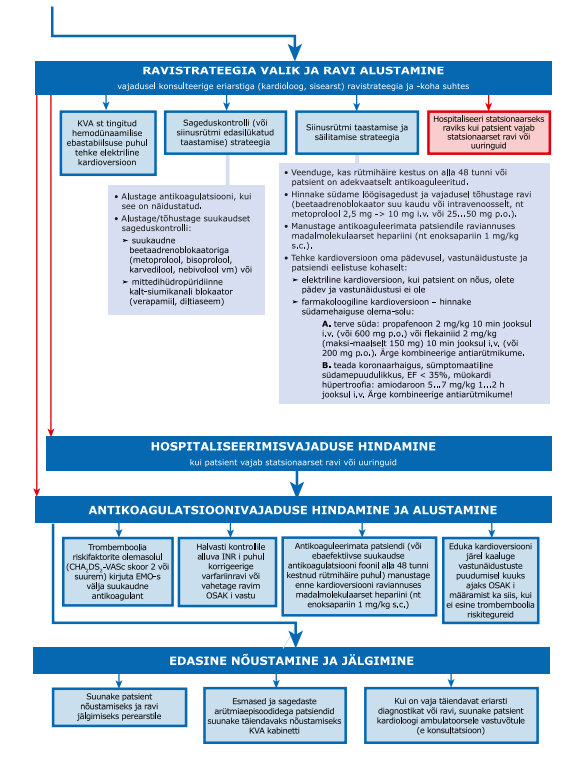

Lisa 3. KVA käsitlus perearstikeskuses
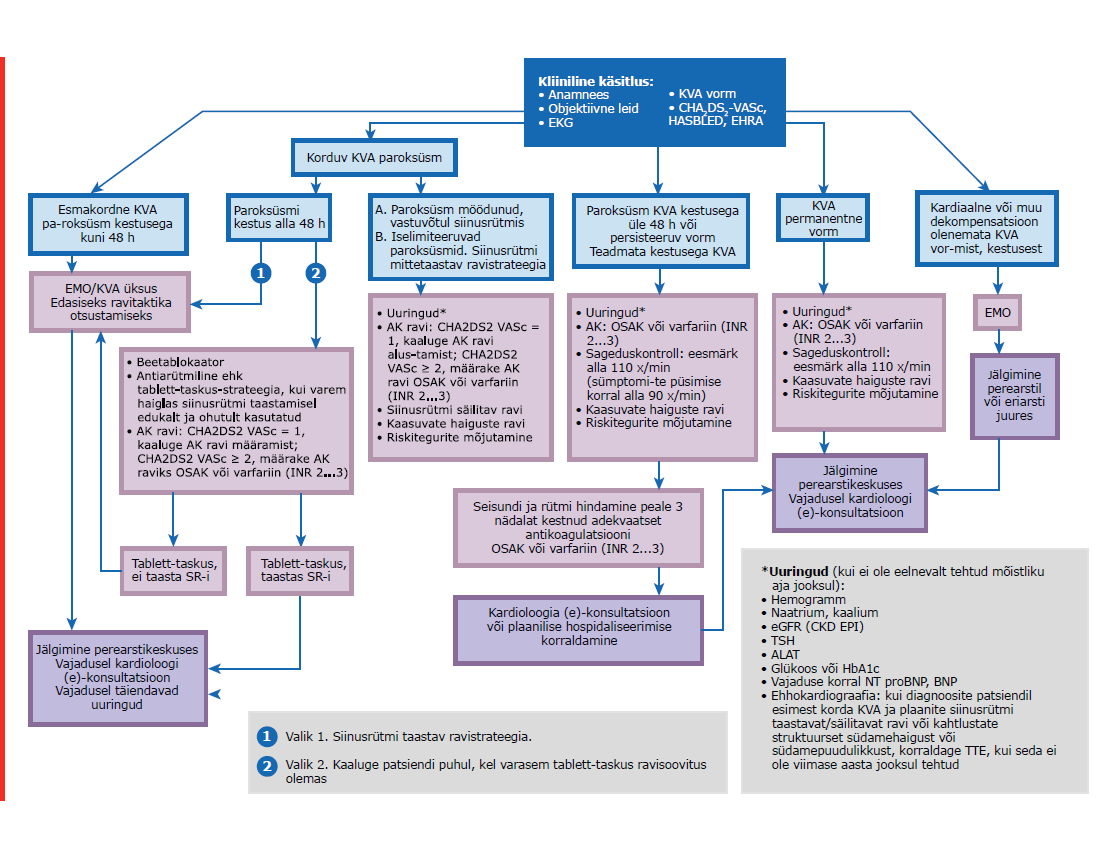

Lisa 4. Antikoagulatsioon ajuinfarkti ja TIA järel (üle võetud Euroopa Kardioloogide Seltsi juhendist, 7)

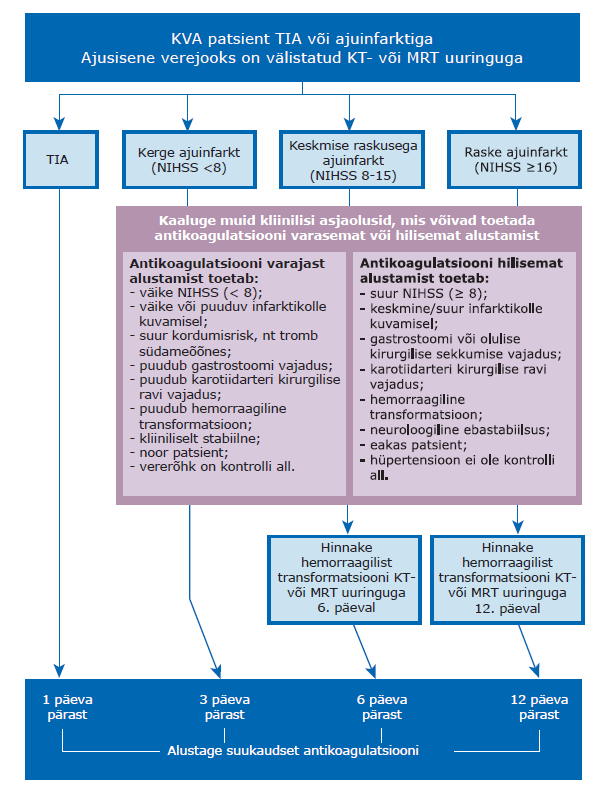
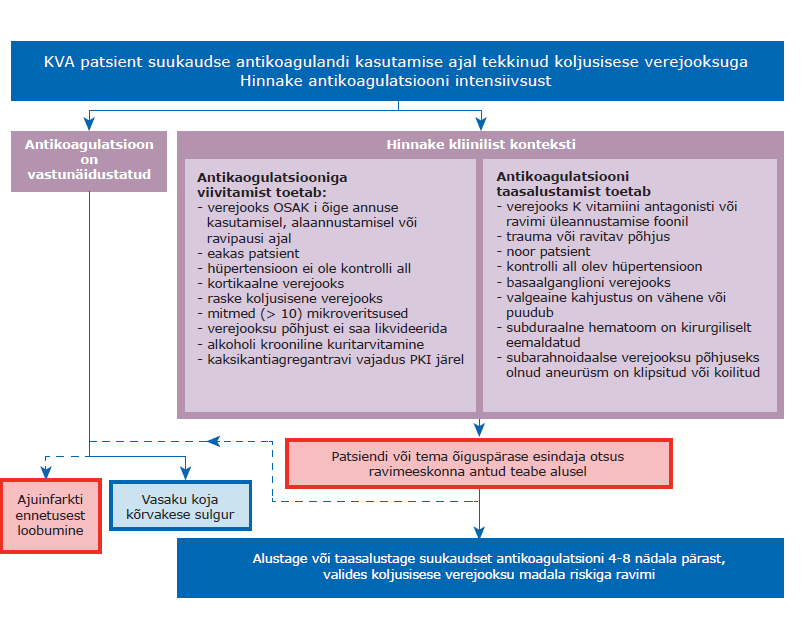
.

Lisa 5. Antikoagulatsioon isheemiatõve korral
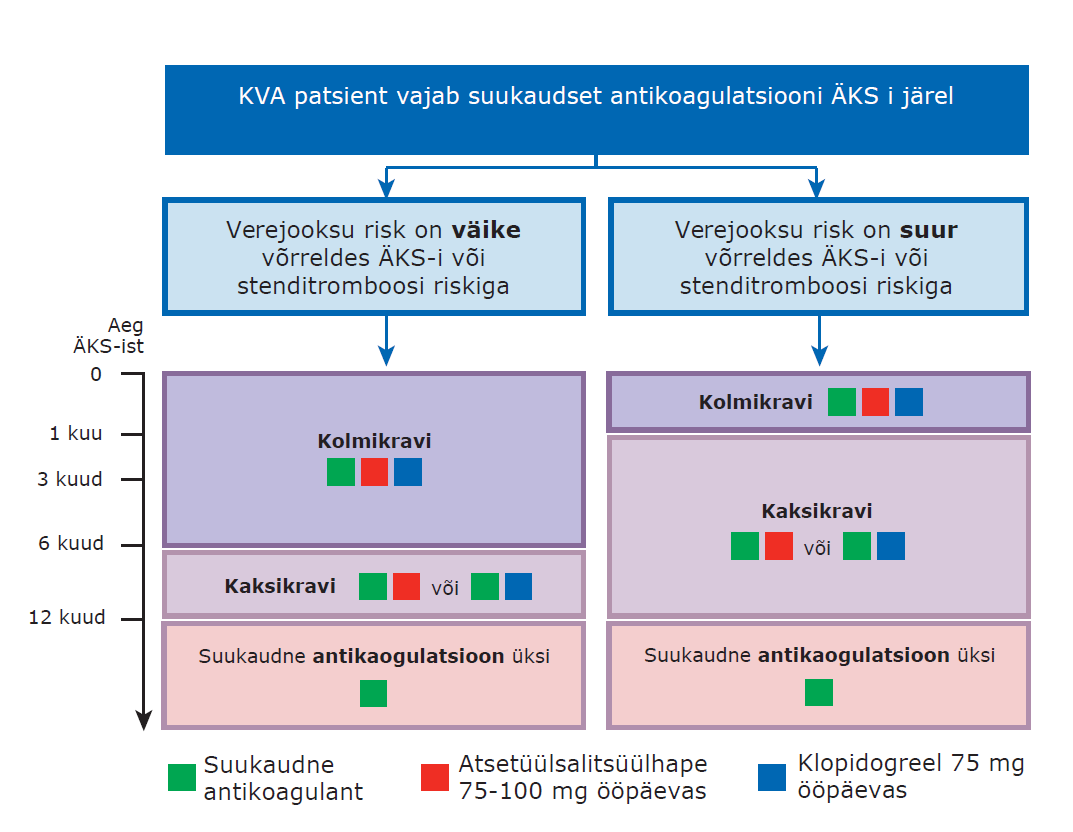
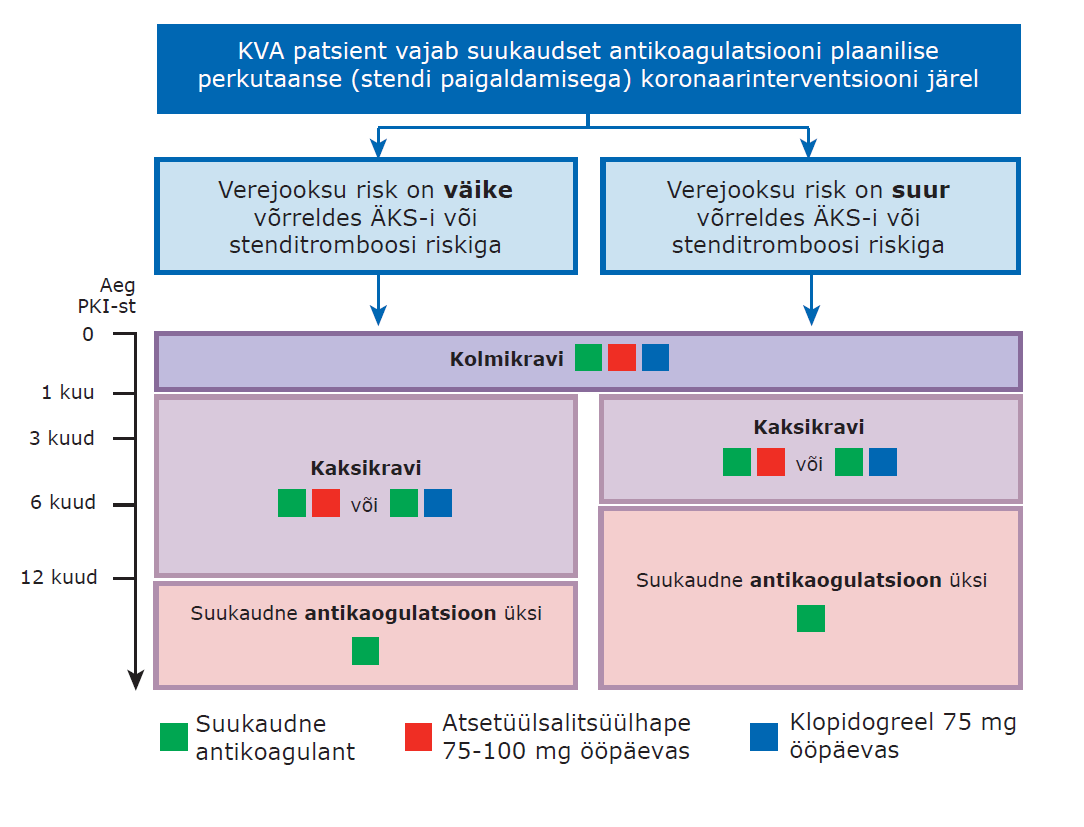


Lisa 6. KVA keskuse soovitav tegevus
KVA keskuse (kabineti, üksuse vm) tegevuse eesmärk on KVA patsientidel sümptomite vähendamine ja raskete tüsistuste ärahoidmine.
Silmas peetakse ka tervishoiusüsteemi optimaalset toimimist: patsientide õigeaegne pääs konsultatsioonile, kiirabikutsete, EMO külastuste ja erakorraliste/korduvate hospitaliseerimiste vältimine.
KVA keskuses töötavad KVA‑alase väljaõppe saanud õed koostöös kardioloogi või sisearstiga.
KVA keskus on võimeline korraldama farmakoloogilist ja elektrilist kardioversiooni.
KVA keskuse tegevused:
Silmas peetakse ka tervishoiusüsteemi optimaalset toimimist: patsientide õigeaegne pääs konsultatsioonile, kiirabikutsete, EMO külastuste ja erakorraliste/korduvate hospitaliseerimiste vältimine.
KVA keskuses töötavad KVA‑alase väljaõppe saanud õed koostöös kardioloogi või sisearstiga.
KVA keskus on võimeline korraldama farmakoloogilist ja elektrilist kardioversiooni.
KVA keskuse tegevused:
- patsiendi ja lähedaste nõustamine KVA diagnoosimise järel (rütmihäire olemus, uuringud, elustiili ja kaasuvate haiguste ravi tähtsus, trombemboolia ennetus jm)
- KVA patsiendi ja lähedaste nõustamine antikoagulantravi alal
- siinusrütmi säilitaval ravil oleva patsiendi ravi nõustamine KVA korduva paroksüsmi puhul
- sageduskontrollil oleva patsiendi ravi nõustamine
- teiste tervishoiutöötajate koolitus ja konsulteerimine KVA alal
Lisa 7. Antikoagulantravi alustamine ja jälgimine
|
Ravi alustav arst:
|
|
Ravi jälgimise sagedus
|
|
Ravi jälgimise visiidil:
|
Lisa 8. Trombemboolia ja veritsuse risikiskoorid - CHAD2DS2-VASc skoor KVA-ga patsiendi trombemboolia riski hindamiseks
| Riskitegur | Skoor | Selgitus | |
| C | Südamepuudulikkus | 1 | Parema, vasaku või mõlema vatsakese puudulikkuse sümptomid, mida kinnitavad südame düsfunktsiooni näitavad uuringute tulemused |
| H | Hüpertensioon | 1 | Arteriaalne vererõhk üle 140/90 mmHg vähemalt kahel mõõtmisel või antihüpertensiivne ravi |
| As | Vanus ≥ 75 a | 2 | |
| D | Diabeet | 1 | Paastuglükoos üle 7 mmol/l või diabeediravi |
| S2 | Ajuinfarkt, TIA, trombembol | 2 | |
| V | Vaskulaarhaigus | 1 | Varasem müokardiinfarkt, stenokardia, perkutaanne koronaarinterventsioon või aortokoronaarne šuntimine Klaudikatsioon, kõhuaordi või alajäsemearterite perkutaanne interventsioon või operatsioon, kõhu- või rindkereoperatsioon, arteri- või veenitromboos |
| A | Vanus 65...74 a | 1 | |
| Sc | Naissugu | 1 |
Lisa 9. Trombemboolia ja veritususe riskiskoorid - HAS-BLED-i skoor KVA-ga patsiendi veristususriksi hindamiseks
| Riskitegur | Skoor | Selgitus | |
| H | Hüpertensioon | 1 | Süstoolne arteriaalne vererõhk > 160 mmHg |
| A | Neeru- ja/või maksafunktsiooni häire | 1/2 | Neeruasendusravi, neerutransplantaat või kreatiniin > 200 µmol/l Maksatsirroos või bilirubiin > 2 korra või ASAT/ALAT/ALP > 3 korra üle referentspiiri |
| S | Insult | 1 | Insult anamneesis |
| B | Veritsus | 1 | Oluline veritsus anamneesis või kalduvus veritsustele |
| L | Labiilne INR | 1 | Alla 60% mõõtmistest eesmärkvahemikus |
| E | Vanus > 65 a | 1 | Antiagregandid, MSPVR |
| D | Ravimid ja/või alkohol | 1/2 | 8 või rohkem ühikut nädalas |
Lisa 10. Keda suunata kodade virvendus- ja laperdusarütmia puhul rütmihäirete spetsialisti konsultatsioonile
Paroksüsmaalse KVA‑ga patsient, kellel on täidetud kõik järgmised kriteeriumid
- KVA põhjustab oluliselt elukvaliteeti mõjutavaid sümptomeid
- ei ole olulist strukturaalset südamehaigust
- on edutult proovitud vähemalt ühte antiarütmikumi ja beetaadrenoblokaatorit maksimaalses talutavas annuses
- rütmihäiret soodustavad kaasuvad seisundid on kontrolli all (hüpertensioon, diabeet, alkoholitarbimine, KMI < 30)
- vanus kuni 70...75 aastat
- KVA põhjustab oluliselt elukvaliteeti mõjutavaid sümptomeid
- ei ole olulist strukturaalset südamehaigust
- on edutult proovitud vähemalt ühte antiarütmikumi ja beetaadrenoblokaatorit maksimaalses talutavas annuses
- rütmihäiret soodustavad kaasuvad seisundid on kontrolli all (hüpertensioon, diabeet, alkoholitarbimine, KMI < 30)
- vanus kuni 70...75 aastat
- alla 60‑aastane, ilma oluliste kaasuvate haigusteta, oluliselt elukvaliteeti mõjutavate KVA sümptomitega patsient soovib esmavalikuna kateeterablatsiooni
- patsient on alla 35‑aastane
- EKG‑l on preeksitatsioon (kaasasündinud lisajuhtetee kahtlus)
- EKG‑l on Hisi kimbu sääre blokaad (kui QRS > 150 ms või esineb oluline vasema vatsakese süstoolse funktsiooni langus)
- esineb tahhükardiomüopaatia (ei õnnestu saavutada sageduskontrolli)
- bradüfrekventne KVA ja Hisi kimbu sääre blokaad EKG‑l
- vaatamata rahuldavale sageduskontrollile jätkuvalt sümptomaatiline ja esineb vasema vatsakese süstoolse funktsiooni langus
- tüüpiline kodade laperdusarütmia (tüüpiline „saehammas“ EKG‑l lülitustes II, III, aVF ja V1), on esinenud vähemalt kaks episoodi
- korduv ebatüüpiline laperdusarütmia (sh südameoperatsiooni järgne)
- alla 60‑aastane, ilma oluliste kaasuvate haigusteta, oluliselt elukvaliteeti mõjutavate KVA sümptomitega patsient soovib esmavalikuna kateeterablatsiooni
- patsient on alla 35‑aastane
- EKG‑l on preeksitatsioon (kaasasündinud lisajuhtetee kahtlus)
- EKG‑l on Hisi kimbu sääre blokaad (kui QRS > 150 ms või esineb oluline vasema vatsakese süstoolse funktsiooni langus)
- esineb tahhükardiomüopaatia (ei õnnestu saavutada sageduskontrolli)
- bradüfrekventne KVA ja Hisi kimbu sääre blokaad EKG‑l
- vaatamata rahuldavale sageduskontrollile jätkuvalt sümptomaatiline ja esineb vasema vatsakese süstoolse funktsiooni langus
- tüüpiline kodade laperdusarütmia (tüüpiline „saehammas“ EKG‑l lülitustes II, III, aVF ja V1), on esinenud vähemalt kaks episoodi
- korduv ebatüüpiline laperdusarütmia (sh südameoperatsiooni järgne)
Kasutatud kirjandus
- Balshem H, Helfand M, Schünemann HJ, et al. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol. 2011; 64 (4): 401–6.
- Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008; 336 (7650): 924–6.
- The Global Burden of Disease Study 2013. [vaadatud 07.05.2018]. http://www.healthdata.org/gbd.
- Krijthe BP, Kunst A, Benjamin EJ, et al. Projections on the number of individuals with atrial fibrillation in the European Union, from 2000 to 2060. Eur Heart J. 2013;34(35):2746-51.
- Rahman F, Kwan GF, Benjamin EJ. Global epidemiology of atrial fibrillation. Nat Rev Cardiol. 2014;11(11):639–654.
- Reile R, Kõrv J, Voitk J jt. Antikoagulantide kulutõhusus virvendusarütmia tüsistuste ennetamisel Eestis. Tartu: Tartu Ülikooli tervishoiu instituut; 2014.
- Kirchhof P, Benussi S, Kotecha D et al. 2016 ESC guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016; 37: 2893-2962.
- Nieminen MS, Brutsaert D, Dickstein K et al. EuroHeart Failure Survey II (EHFS II): a survey on hospitalized acute heart failure patients: description of population. Eur Heart J. 2006;22(1): 2725-2736.
- Eesti Haigekassa. Kliinilise auditi „Virvendusarütmiaga patsiendi käsitlus Eesti Haiglates“ kokkuvõte. Tallinn; 2014 [vaadatud 07.05.2018]. https://www.haigekassa.ee/sites/default/files/HVA-aruanne/ravikvaliteedi-indikaatorid-2016/2016_af_kokkuvote_kodulehele_0607.pdf
- Calkins H, Hindricks G, Cappato R et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: Executive summary. Heart Rhythm 2017;14(10):e446-494.
- Wynn, GJ, Todd, DM, Webber, M et al. The European Heart Rhythm Association symptom classification for atrial fibrillation: validation and improvement through a simple modification. Europace. 2014; 16: 965-972.
- Cooke G, Doust J, Sanders S. Is pulse palpation helpful in detecting atrial fibrillation? A systematic review. J Fam Pract. Feb 2006; 55(2):130-4.
- Chan PH, Wong CK, Poh YC et al. Diagnostic Performance of a Smartphone-Based Photoplethysmographic Application for Atrial Fibrillation Screening in a Primary Care Setting. J Am Heart Assoc. 2016;5:e003428.
- Freedman B, Camm J, Calkins H et al. Screening for Atrial Fibrillation. A Report of the AF-SCREEN International Collaboration Circulation. 2017; 135(19):1851-1867.
- Kishore A, Vail A, Majid A, et al. Detection of atrial fibrillation after ischemic stroke or transient ischemic attack: a systematic review and meta-analysis. Stroke. 2014; 45(2):520-6.
- Sposato LA, Cipriano LE, Saposnik G et al. Diagnosis of atrial fibrillation after stroke and transient ischaemic attack: a systematic review and meta-analysis. Lancet Neurol. 2015;14(4):377-87.
- Dussault C, Toeg H, Nathan M et al. Electrocardiographic Monitoring for Detecting Atrial Fibrillation After Ischemic Stroke or Transient Ischemic Attack. Systematic Review and Meta-Analysis. Circ Arrhythm Electrophysiol. 2015;8(2):263-9.
- Higgins P, MacFarlane PW, Dawson J et al. Noninvasive cardiac event monitoring to detect atrial fibrillation after ischemic stroke: a randomized, controlled trial. Stroke. 2013;44(9):2525-31.
- Gladstone DJ, Spring M, Dorian P et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med. 2014;370(26):2467–77.
- Sanna T, Diener HC, Passman RS, et al. Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med. 2014;370(26):2478-86.
- Wachter R, Weber-Kruger M, Seegers J, et al. Age-dependent yield of screening for undetected atrial fibrillation in stroke patients: the Find- AF study. J Neurol. 2013;260(8):2042-5.
- Grond M, Jauss M, Hamann G, et al. Improved detection of silent atrial fibrillation using 72-hour Holter ECG in patients with ischemic stroke: a prospective multicenter cohort study. Stroke. 2013;44(12):3357–64.
- Powers WJ, Rabinstein AA, Ackerson T et al. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2018;49(3):e46-e110.
- (UK). Atrial Fibrillation: The Management of Atrial Fibrillation. National Institute for Health and Clinical Excellence: Guidance. London: National Institute for Health and Care Excellence (UK); 2014
- Larsson SC, Drca N, Jensen-Urstad M, Wolk A. Combined impact of healthy lifestyle factors on risk of atrial fibrillation: Prospective study in men and women. Int J Cardiol. 2016;203:46-9.
- Abed HS, Wittert GA, Leong DP et al. Effect of weight reduction and cardiometabolic risk factor management on symptom burden and severity in patients with atrial fibrillation: a randomized clinical trial. JAMA. 2013; 310(19): 2050-60.
- Risom SS, Zwisler AD, Johansen PP et al. Exercise-based cardiac rehabilitation for adults with atrial fibrillation. Cochrane Database Syst Rev. 2017;2:CD011197.
- Pathak RK, Elliott A, Middeldorp ME at al. Impact of CARDIOrespiratory FITness on Arrhythmia Recurrence in Obese Individuals With Atrial Fibrillation: The CARDIO-FIT Study. J Am Coll Cardiol. 2015;66(9):985-96.
- Pathak RK, Middeldorp ME, Lau DH et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol. 2014;64(21):2222-31.
- Zhu W et al. Association of Physical Fitness With the Risk of Atrial Fibrillation: A Systematic Review and Meta-Analysis. Clin Cardiol. 2016;39(7):421-8.
- Aakre CA, McLeod CJ, Cha SS et al. Comparison of clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation. Stroke 2014;45(2):426-31.
- van den Ham HA, Klungel OH, Singer DE et al. Comparative Performance of ATRIA, CHADS2, and CHA2DS2-VASc Risk Scores Predicting Stroke in Patients With Atrial Fibrillation: Results From a National Primary Care Database. J Am Coll Cardiol. 2015;66(17):1851-9.
- Oldgren J, Hijazi Z, Lindbäck J et al. Performance and Validation of a Novel Biomarker-Based Stroke Risk Score for Atrial Fibrillation. Circulation 2016;134(22):1697-1707.
- Senoo K, Proietti M, Lane DA, Lip GY. Evaluation of the HAS-BLED, ATRIA, and ORBIT Bleeding Risk Scores in Patients with Atrial Fibrillation Taking Warfarin. Am J Med. 2016;129(6):600-7.
- Hijazi Z, Oldgren J, Lindbäck J et al. The novel biomarker-based ABC (age, biomarkers, clinical history)-bleeding risk score for patients with atrial fibrillation: a derivation and validation study. Lancet 2016;387(10035):2302-2311.
- Hart RG, Pearce, LA, Aguilar, MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007; 146(12):857–867.
- Eckman MH jt. Moving the Tipping Poin. The Decision to Anticoagulate Patients With Atrial Fibrillation. Circ Cardiovasc Qual Outcomes. 2011;4(1):14-21.
- Potpara T, Dagres N, Mujović N et al. Decision-Making in Clinical Practice: Oral Anticoagulant Therapy in Patients with Non-valvular Atrial Fibrillation and a Single Additional Stroke Risk Factor. Adv Ther 2017;34(2):357–377.
- Joundi RA, Cipriano LE, Sposato LA et al. Ischemic stroke risk in patients with atrial fibrillation and CHA2DS2-VASc score of 1: systematic review and meta-analysis. Stroke 2016;47(5):1364–7.
- Allan V, Banerjee A, Shah AD et al. Net clinical benefit of warfarin in individuals with atrial fibrillation across stroke risk and across primary and secondary care. Heart 2017;103(3):210-218.
- Andrade JG jt. Values and preferences ofphysicians and patients with nonvalvular atrial fibrillation who receive oral anticoagulation therapy for stroke prevention. Can J Cardiol. 2016;32(6):747–53.
- Lahaye S jt. Evaluation of patients’ attitudes towards stroke prevention and bleeding risk in atrial fibrillation. Thromb Haemost. 2014;111(3):465–73.
- National Institute for Health and Care Excellence. Dabigatran etexilate for the prevention of stroke and systemic embolism in atrial fibrillation. Technology appraisal guidance 249. London: National Institute for Health and Care Excellence (UK) 2012
- National Institute for Health and Care Excellence. Rivaroxaban for the prevention of stroke and systemic embolism in people with atrial fibrillation. Technology appraisal guidance 256. London: National Institute for Health and Care Excellence (UK) 2012
- National Institute for Health and Care Excellence. Apixaban for preventing stroke and systemic embolism in people with nonvalvular atrial fibrillation. Technology appraisal guidance 275. London: National Institute for Health and Care Excellence (UK) 2013
- Cameron C, Coyle D, Richter T et al. Systematic review and network meta-analysis comparing antithrombotic agents for the prevention of stroke and major bleeding in patients with atrial fibrillation. BMJ Open. 2014;4(6):e004301.
- Lip GY, Mitchell SA, Liu X et al. Relative efficacy and safety of non-Vitamin K oral anticoagulants for non-valvular atrial fibrillation: Network meta-analysis comparing apixaban, dabigatran, rivaroxaban and edoxaban in three patient subgroups. Int J Cardiol. 2016;204:88-94.
- Guo L, Li S, Wang P et al. Comparative Efficacy of Clinical Events Prevention of Five Anticoagulants in Patients With Atrial Fibrillation (A Network Meta-Analysis). Am J Cardiol. 2017;119(4):585-593.
- Di Biase L. Use of Direct Oral Anticoagulants in Patients With Atrial Fibrillation and Valvular Heart Lesions. Journal of the American Heart Association: Cardiovascular and Cerebrovascular Disease. 2016;5(2):e002776.
- Connolly SJ, Ezekowitz MD, Yusuf S et al. RE‐LY Steering Committee and Investigators . Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139–1151.
- Patel MR, Mahaffey KW, Garg J et al. ROCKET AF Investigators . Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365(10):883–891.
- Granger CB, Alexander JH, McMurray JJ et al. ARISTOTLE Committees and Investigators . Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981–92.
- Eikelboom JW, Connolly SJ, Brueckmann M et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med 2013; 369(13):1206–1214
- Aguilar M, Hart R. Antiplatelet therapy for preventing stroke in patients with non-valvular atrial fibrillation and no previous history of stroke or transient ischemic attacks. Cochrane Database Syst Rev. 2005;CD001925.
- Mant J, Hobbs FD, Fletcher K et al. Warfarin versus aspirin for stroke prevention in an elderly community population with atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of the Aged Study, BAFTA): a randomised controlled trial. Lancet. 2007;370(9586):493-503.
- Connolly SJ, Eikelboom J, Joyner C et al. Apixaban in patients with atrial fibrillation. N Engl J Med. 2011;364(9):806-17.
- January CT, Wann LS, Alpert JS et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the Heart Rhythm Society. Circulation 2014;130(23):2071-104.
- Goldstein RE, Boccuzzi SJ, Cruess D, Nattel S. Diltiazem increases late-onset congestive heart failure in postinfarction patients with early reduction in ejection fraction. The Adverse Experience Committee; and the Multicenter Diltiazem Postinfarction Research Group. Circulation. 1991;83(1):52-60.
- Van Gelder IC, Groenveld HF, Crijns, HJ et al. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med. 2010; 362(15): 1363-1373.
- Groenveld HF, Crijns HJ, Van den Berg MP et al. The effect of rate control on quality of life in patients with permanent atrial fibrillation: data from the RACE II (Rate Control Efficacy in Permanent Atrial Fibrillation II) study. J Am Coll Cardiol. 2011;58(17):1795-803.
- Olshansky B1, Rosenfeld LE, Warner AL et al. The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) study: approaches to control rate in atrial fibrillation. J Am Coll Cardiol. 2004;43(7):1201-8.
- Kotecha D, Holmes J, Krum H et al. Efficacy of β blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet 2014;384(9961):2235-43.
- Ziff OJ, Lane DA, Samra M et al. Safety and efficacy of digoxin: systematic review and meta-analysis of observational and controlled trial data. BMJ. 2015; 351: h4451
- Kumar K, Manning WJ. Rhythm control versus rate control in atrial fibrillation. UpToDate 2017 (last updated Oct 10, 2016).
- Naccarelli GV, Ganz LI, Manning WJ. Atrial fibrillation: Cardioversion to sinus rhythm. UpToDate 2017 (last updated Oct 10, 2016).
- Grönberg T, Nuotio I, Nikkinen M et al. Arrhythmic complications after electrical cardioversion of acute atrial fibrillation: the FinCV study. Europace. 2013;15(10):1432.
- Brüggenjürgen B, Kohler S, Ezzat N et al. Cost Effectiveness of Antiarrhythmic Medications in Patients Suffering from Atrial Fibrillation. PharmacoEconomics 2013; 31(3):195-213.
- Alboni P, Botto GL, Baldi N et al. Outpatient treatment of recent-onset atrial fibrillation with the “pill-in-the-pocket” approach. N Engl J Med 2004;351(23):2384-91.
- Khan IA. Single oral loading dose of propafenone for pharmacological cardioversion of recent-onset atrial fibrillation. J Am Coll Cardiol. 2001;37(2):542-7.
- Saborido CM, Hockenhull J, Bagust A et al. Systematic review and cost-effectiveness evaluation of 'pill-in-the-pocket' strategy for paroxysmal atrial fibrillation compared to episodic in-hospital treatment or continuous antiarrhythmic drug therapy. Health Technol Assess. 2010;14(31):iii-iv, 1-75.
- Vibo R, Kõrv J, Roose M. The Third Stroke Registry in Tartu, Estonia, from 2001 to 2003. Acta Neurol Scand 2007: 116: 31–36.